磷脂酰肌醇蛋白多糖-3在肝细胞肝癌的表达及其与术后复发的相关性
2011-08-20蒋国华廖维甲覃理灵梅铭惠袁晟光
蒋国华,廖维甲,覃理灵,梅铭惠,陈 谦,袁晟光,刘 杰
(1.桂林市卫生学校,广西桂林 541002;2.桂林医学院附属医院,广西桂林 541001)
AFP诊断HCC是目前公认的肿瘤标志物,但阳性率仅为70%左右,假阴性率达30%,且AFP水平高低与肿瘤大小有关,不利于HCC的早期诊断和小肝癌的发现,尤其是术后复发的预测。HCC根治切除术后3年和5年的复发率分别高达50%和70%[1],需要寻找更加敏感的早期诊断和术后复发监测指标。近年发现磷脂酰肌醇蛋白聚糖3(glypican-3,GPC-3)与多种恶性肿瘤的发生发展密切相关,它是一种细胞膜表面的硫酸乙酰肝素糖蛋白,基因位于人染色体X26.10,由8个外显子组成,启动子区有多个转录因子结合位点[2],国内学者对GPC3研究不多,国外学者对GPC-3在HCC的发生和发展提出了一些假说。本文采用RT-PCR方法对HCC癌组织及癌旁组织测定GPC-3 mRNA的表达水平。
1 材料与方法
1.1 标本60例HCC癌组织及其癌旁组织取自本院肝胆外科HCC手术切除的肝脏组织。男52例,女性8例,平均年龄49岁;肿瘤直径<5 cm 13例,5 cm<肿瘤直径<10 cm 28例,>10 cm或伴有肝内外转移19例;肿瘤数目单个47例,2个或2个以上13例;肿瘤有完整包膜24例,无包膜或包膜不完整36例;11例有镜下门静脉癌栓,血清AFP阳性41例,HBsAg阳性56例。所有的组织标本均经术后病理检查证实。60例癌旁组织病理诊断:18例慢性肝炎,36例肝硬化,6例正常组织。标本经手术切除后立即分装放入液氮保存。
1.2 试剂和仪器RNA提取试剂盒Trizol(Invitrogn公司),maker、RT-PCR试剂盒(宝生物工程(大连)有限公司),紫外分光光度计和RT-PCR仪(BIO公司)。
1.3 引物设计与合成根据GenBank的相应cDNA序列,运用Premier 5.0软件设计GPC-3和β-Actin引物序列,并经Pubmed Blast对比分析,均具有较好的特异性,由上海生物工程公司合成。设计GPC-3上游引物序列为:5′-CCAACATGCTGCTCAAGAAAGATGGAAG-3′,下游引物序列为 :5′-CAAACTCAAAAGCTTGTGGAGTCAGGCT-3′,扩增片段长度为 226 bp;内对照基因β-Actin的上游引物序列为:5′-TCAC2CCACA CTGTGCCCATCTACGA-3′,下 游 引 物 序 列 为 :5′-CAGCGGAACCGCTCATTGCCAATGG-3′,扩增片断 长度为400 bp。
1.4 方法取HCC组织、癌旁组织约50 mg制成匀浆,加入1 ml TRIzol,冰浴。吸1 ml匀浆液至离心管中,4℃离心 12 000 r/min×10 min。取上清0.8 ml,加入0.2 ml氯仿,震荡2 min,4℃离心10 000 r/min×10 min,取上清0.3 ml,加100%异丙醇0.3 ml,再加50%异丙醇0.5 ml,震荡30 s,4℃离心12 000 r/min×5 min,弃上清,加1 ml 750 ml/L乙醇,轻轻洗涤沉淀,4℃离心12 000 r/min×5 min,弃上清,室温静置3 min,将乙醇晾干,加20 μ l 0.1%氯化锂溶解沉淀。抽提的 RNA质量鉴定:紫外分光光度计定260/280比值(比值均在1.7-2.0);并在MOPS甲醛变性胶中观察有无降解,所用RNA均无降解。为了去除基因组DNA的污染,全部RNA均用无RNA酶的DNA酶Ⅰ消化后,置-80℃备用。
总RNA通过逆转录反应合成cDNA,进行PCR扩增,PCR反应条件均为94℃预变性5 min;94℃变性30 s,55℃退 30 s,72℃延伸 40 s,共 35循环(βactin为28循环)。PCR产物在琼脂糖凝胶上电泳,经灰度扫描,凝胶图像分析仪分析,以GPC-3和βactin的比值作为GPC-3 mRNA的相对含量。对病人的临床病理学资料进行分析,研究HCC病人的GPC-3 mRNA阳性和阴性表达与其性别、年龄、肿瘤的大小 、肿瘤数目 、AFP 、HBsAg、有无包膜 、转移 、门静脉癌栓各指标间的关系;探讨GPC-3 mRNA表达水平与HCC术后复发的关联性,在笔者课题组的一项研究中,曾将肝癌术后3年内不复发患者设定为预后良好组,反之亦然[3]。
1.5 统计学处理应用SPSS13.0统计软件进行t检验和卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 GPC-3 mRNA在HCC组织及癌旁组织中的表达RT-PCR检测结果表明,60例HCC标本中,HCC癌组织中GPC-3 mRNA表达阳性的有41例,阳性率68.3%,癌旁组织中GPC-3 mRNA低表达或不表达。其中24对HCC的PCR产物电泳图如下图1。PCR产物在琼脂糖凝胶上的电泳图,经灰度扫描,系统软件分析,HCC组织、癌旁组织的GPC-3与β-actin比值的相对含量分别为:0.53±0.13,0.23±0.05,其差异有显著性,见表1。
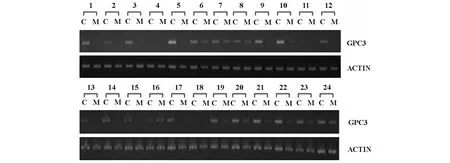
图1 基因GPC-3在HCC癌组织高表达(RT-PCR)

表1 基因GPC-3在HCC癌组织及癌旁组织表达水平的比较
2.2 统计学分析GPC-3mRNA阳性和阴性表达与其肿瘤大小、肿瘤数目、有无包膜、门静脉癌栓、HB-sAg及AFP水平各指标间均无明显差异(P>0.05);而与HCC术后3年内是不是复发有直接关系,在60例HCC标本中,有18例3年内不复发,其中GPC-3 mRNA表达阴性为15/18(83.3%),表达阳性为3/18(16.7%),两者比较有统计学意义(P<0.05)。
3 讨论
目前国内学者对GPC-3研究甚少,国外研究表明,GPC-3在肝癌组织中mRNA呈高表达[4],而在成人正常组织、HCC癌旁组织、肝炎、肝硬化组织中表达量极低或不表达[5,6];本研究证实这一点,实验结果表明,GPC-3 mRNA在HCC癌组织中高表达,阳性率68.3%,而在癌旁组织中为低表达或不表达,GPC-3在HCC组织中有稳定的表达,提示其在HCC的发生发展中具有重要作用,这种选择性表达特性使其成为目前恶性肿瘤诊断和治疗的新靶点。也可能是一种新的HCC的癌胚抗原。因此,近年来倍受关注,被学者称之为HCC新的特异性标志物及潜在分子治疗的靶点[7,8],GPC-3能显著提高小肝癌与肝硬化结节的鉴别诊断[8]。
本研究发现GPC-3 mRNA的表达与其肿瘤大小、肿瘤数目、有无包膜、门静脉癌栓、HBsAg及AFP水平各指标间均无明显差异(P>0.05),提示检测HCC组织中的GPC-3基因的表达对于预测肿瘤的恶性程度、病情轻重无明显价值。尤其是GPC-3 mRNA的表达高低与血清AFP水平无明显差异,在血清AFP阴性的原发性肝癌中仍有一定的阳性率,提示对血清AFP阴性的肝癌诊断具有一定的辅助意义,有望作为比AFP更加理想的肝细胞癌早期诊断的敏感标记物。但也有学者指出:GPC3是一个细胞周期相关的蛋白质[9],其在肝癌的发生、发展、信号通路等方面的研究也得到了广泛关注。
目前外科切除仍然是HCC最主要和有效的治疗方法,但绝大多数HCC患者发现时较晚,不一定有手术机会;另外,根治性切除术后的高复发率已成为提高肝癌生存率的一个瓶颈,也是攻克肝癌最重要的难关之一。因此,早期预测、诊断肝癌的复发,并采取有效措施进行干预是进一步提高肝癌外科疗效的关键。GPC-3 mRNA表达与HCC术后3年内是不是复发有直接关系,术后3年内不复发HCC患者的癌组织中GPC-3 mRNA呈现低表达水平,而在术后3年内复发HCC患者癌组织中呈现高表达水平。本研究虽然采用的病例数有限,但它却提示了:GPC-3 mRNA高表达水平极大地增加了HCC患者术年复发风险,也说明GPC-3可能是判断HCC预后重要指标;同时可以设想,通过外界因素,如小分子的GPC-3靶向药物、siRNA干扰等人工沉默敲除GPC-3基因,以达到降低HCC患者肝癌组织中GPC-3表达水平的目的,从而减少HCC患者术后复发的风险。迄今为止,人们对GPC-3的了解,尤其是在HCC中的了解十分有限,它的诸多功能、作用机制以及与相关基因的相互关系等许多方面还不十分清楚,有待于进一步深入研究。
[1]Llovet JM,Bu rroughs A,Bru ix J.Hepatocellular carcinoma[J].Lancet,2003,362(9399):1907.
[2]Baumhoer D,Tornillo L,Stadlmann S,et al.Glypican 3 expression in human nonneoplastic,preneoplastic,and neoplastic tissues:a tissue microarray analysis of 4,387 tissue samples[J].Am J Clin Pathol,2008,129:899.
[3]Xie XW,Mei MH,Liao WJ,et al.Expression of CIITA-related MHCII molecules in tumors linked to prognosis in hepatocellular carcinoma[J].Int J Oncol.2009Mar;34(3):681.
[4]Lai JP,Oseini AM,Moser CD,et al.The oncogenic effect of sulfatase 2 in human hepatocellular carcinoma is mediated in part by glypican 3-dependent Wnt activation[J].Hepatology,2010,52(5):1680.
[5]Yam auchi N,Watanabe A,H ishinuma M,et al.The glypican 3 oncofetal protein is a promising diagnostic markerfor hepatocellular carcinoma[J].Mod Pathol,2005,18(12):1591.
[6]Saito Y,Oba N,Nishinakagawa S,et al.Identification of beta2-microgloblin as a candidate for early diagnosis of imaging-invisible hepatocellular carcinoma in patient with liver cirrhosis[J].Oncol Rep,2010,23(5):1325.
[7]Suzuki M,Sugimoto K,Tanaka J,et al.Up-regulation of glypican-3 in human hepatocellular carcinoma[J].Anticancer Res,2010,30(12):5055.
[8]DiTommaso L,Franchi G,Park YN,et al.Diagnostic value of HSP70,glypican 3,and glutamine synthetase in hepatocellular nodules in cirrhosis[J].Hepatology,2007,45(3):725.
[9]Liu B,Bell AW,Paranjpe S,et al.Suppression of liver regeneration and hepatocyte proliferation in hepatocyte-targeted glypican 3 transgenic mice[J].Hepatology,2010,52(3):1060.
