三维适形放疗联合高强度聚焦超声治疗老年性前列腺癌临床疗效观察
2011-08-14姚晖李莉王芸王梦绮余建军
姚晖 李莉 王芸 王梦绮 余建军
上海市杨浦区市东医院放疗科,*超声聚焦室,上海 200438
前列腺癌是老年男性常见的恶性肿瘤之一,随着人们生活方式的改变、生态环境的恶化、人均寿命的延长及PSA检测的广泛应用,我国老年性前列腺癌发病率呈逐年上升趋势[1]。
三维适形放射治疗(three dimensional conformal radiotherapy,3D-CRT)是近年发展起来的一项新的放射治疗技术,能较大限度地提高肿瘤局部放射治疗剂量,降低正常组织放射剂量[2-3]。高强度聚焦超声(high intensity focused ultrasound,HIFU)是一种新兴的局部治疗肿瘤的微创技术。本研究采用3D-CRT联合HIFU治疗老年性前列腺癌,疗效报道如下。
1 资料和方法
1.1 患者资料
选择本院2004年1月—2009年12月在超声引导下行前列腺穿刺活检,确诊为前列腺肿瘤患者95例,年龄65~86岁,平均75.5岁,卡氏评分70分以上。前列腺癌Gleason分级:2~4级36例,5~6级42例,7级14例,8~10级3例。根据Jewett分期:B期48例,C期42,D期5例。所有患者均不能耐受或拒绝根治性前列腺切除术及盆腔淋巴结清扫术,而行双侧睾丸去势术,且术后未行化疗,但常规口服抗雄激素药物(氟他胺)治疗。按信封法将患者随机分为3D-CRT+HIFU组48例,3D-CRT组47例(表1)。

表1 两组临床资料比较Tab.1 The clinical comparisons of two groups
1.2 治疗方法
1.2.1 3D-CRT+HIFU组治疗方法
3D-CRT+HIFU组先采用15 MV X线3D-CRT。患者仰卧位,双手交叉抱头,真空体模固定体位。行CT模拟定位扫描后,将CT重建图像输入三维治疗计划系统。采用Pinnacle3计划系统设计照射计划。临床靶体积(clinical target volume,CTV)包括前列腺、精囊及外放1 cm范围。计划靶体积(plan target volume,PTV)为CTV外放1 cm,采用4~6个野进行适形治疗。3D-CRT计划优化通过剂量体积直方图(DVH)进行。90%的等剂量曲线包括CTV,PTV内部剂量差异<5%。每次2 Gy,1次/天,5天/周,总剂量为TD 60 Gy/30 Fx。放射治疗15次后,每日同步采用体外超声聚焦热疗方式经会阴治疗5次。治疗时取坐位,根据定位超声扫描图像选择治疗范围,包括整个前列腺进行扩大聚焦治疗。
1.2.2 3D-CRT组治疗方法
3D-CRT组采用15 MV X线3D-CRT。总剂量为TD(66~72) Gy/(33~36) Fx。放射治疗技术同3D-CRT+HIFU组。
1.2.3 疗效评定标准
治疗前及治疗后3个月作前列腺CT或彩超检查。按世界卫生组织(WHO)实体瘤近期疗效标准评价肿瘤退缩情况:完全缓解(CR)为肿瘤完全消退并至少维持4周以上,无新病灶出现;部分缓解(PR)为肿瘤消退≥50%,至少维持4周,无新病灶出现;无变化(NC)为肿瘤消退<50%或增大<25%;进展(PD)为肿瘤增大>25%或出现新病灶。以CR+PR为有效。
治疗前及治疗后3个月检查外周血PSA、fPSA、T淋巴细胞亚群和NK细胞。 2年内每隔3个月行全身检查,2年以后每6个月检查1次。
1.2.4 不良反应
治疗期间根据美国肿瘤放射治疗协会(RTOG)的标准详细评价两组不良反应。放射性膀胱炎0级:无变化;I级:排尿频繁或夜尿为治疗前的2倍,无需用药;Ⅱ级:排尿困难、尿急,膀胱痉挛需局部用麻醉药;Ⅲ级:尿频伴尿急和夜尿,排尿困难,盆腔痛或膀胱痉挛,需定时频繁给予麻醉剂,肉眼血尿伴或不伴血块;Ⅳ级:血尿需输血,急性膀胱梗阻。放射性直肠炎0级:无变化;I级:排便次数增加或排便习惯改变,无需用药;Ⅱ级:腹泻需用抗副交感神经药,直肠或腹部疼痛需用镇痛药;Ⅲ级:腹泻需肠胃外支持,腹部膨胀(平片示肠管扩张);Ⅳ级:急性或亚急性肠梗阻,瘘或穿孔,胃肠道出血需输血,腹痛或里急后重需置管减压,或肠扭转。
1.3 统计学处理
采用SPSS 13.0软件,计量资料比较采用秩和检验,计数资料采用χ2检验。P<0.05为差异有统计学意义;P<0.01为差异有显著的统计学意义。
2 结 果
2.1 疗效
95例患者均完成治疗及随访。随访时间为12~72个月,中位随访时间为48个月。3D-CRT+HIFU组中CR+PR 45例(94%);3D-CRT组中CR+PR 36例(77%),差异有统计学意义(χ2=5.54,P<0.05,表2)。
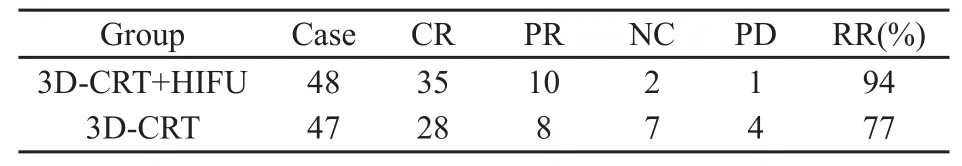
表2 两组疗效比较Tab.2 The comparisons of effect between two groups(n)
2.2 治疗前后血PSA及fPSA变化
两组患者治疗前后血PSA及fPSA指标差异有统计学意义 (P<0.05,表3)。
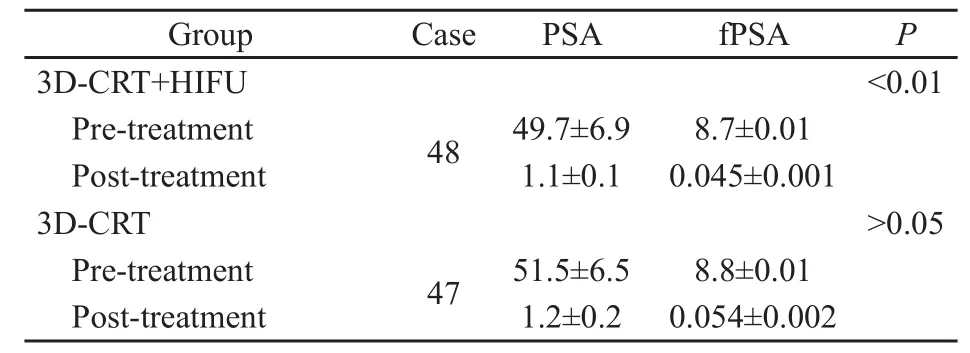
表3 治疗前后血PSA及fPSA指标变化Tab.3 Changes in blood PSAand fPSA after treatment(ng/mL)
2.3 治疗前后T淋巴细胞亚群及NK细胞变化
3D-CRT+HIFU组CD3+、CD4+、CD8+、CD4+/CD8+和NK细胞治疗后显著升高,治疗前后差异有显著统计学意义 (P<0.01),3D-CRT组治疗前后差异无统计学意义(P>0.05,表4)。
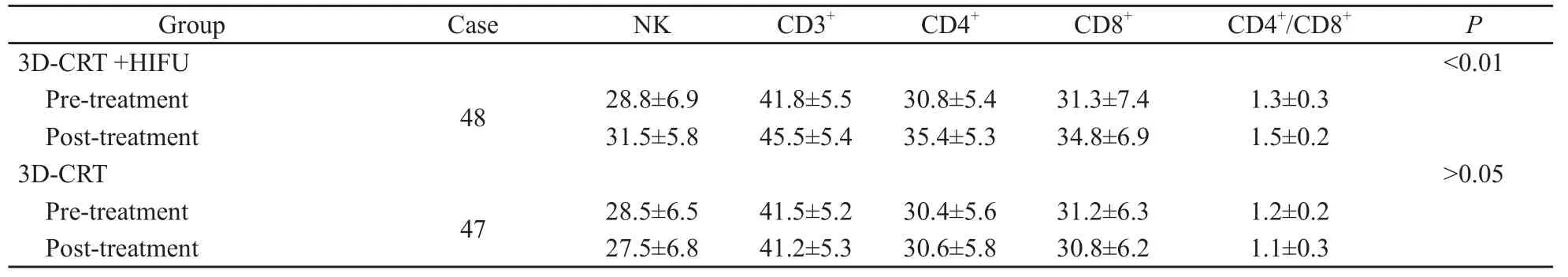
表4 治疗前后免疫功能指标变化Tab.4 Changes in T cell subsets and NK cells after treatment
2.4 急性不良反应
自治疗开始的90 d内,两组患者均出现不同程度的不良反应,但可耐受,无一例中断治疗。与3D-CRT组相比,3D-CRT+HIFU组血细胞减少、放射性直肠炎和膀胱炎等Ⅱ级以上急性不良反应减少,差异有显著统计学意义(P<0.01),但泌尿生殖道Ⅱ级以上急性不良反应较3D-CRT组增加,差异有统计学意义(P<0.05,表5)。
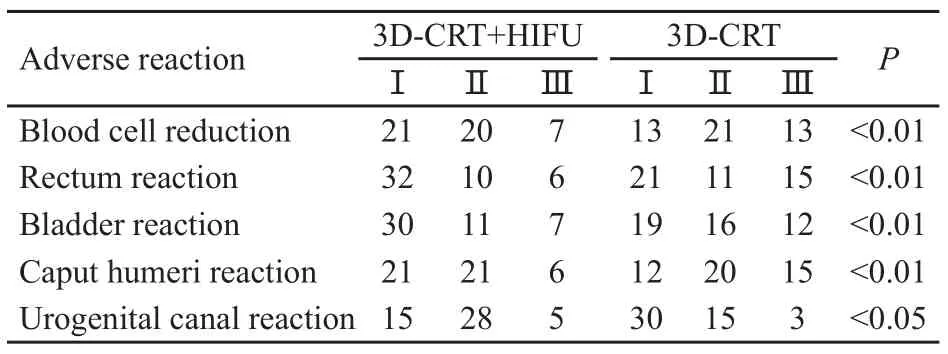
表5 两组急性不良反应比较Tab.5 Adverse reactions of the 2 groups
3 讨 论
前列腺癌在欧美国家60岁以上男性中的发病率高达75/10万,我国北京、上海、广州等大城市的发病率约为5/10万,且近年发病率有明显升高的趋势[1-2]。传统治疗手段包括手术、放疗、化疗及内分泌治疗等。对于早期前列腺癌患者,根治性前列腺切除术可以取得5~10年生存期,但有一定的手术并发症和死亡风险。
3D-CRT技术的开展,能提高前列腺癌患者生存率,降低局部复发率,且照射剂量与肿瘤生存呈线性关系。本研究结果显示,单纯3D-CRT能使前列腺肿瘤区域获得较满意的剂量分布,并减少正常组织的照射剂量和照射体积。由于本研究均为高龄患者,为提高生存质量,采用的放疗中位剂量只有70 Gy,局部控制率达77%,与国内文献报道前列腺癌局部无复发率的相似率达65%~97%[2-4]。
本研究结果显示,单纯3D-CRT治疗前列腺癌,局部未控制率达23%,可能与前列腺癌细胞处于S期细胞或乏氧细胞,对放射治疗敏感性较低有关。前列腺癌细胞在放射治疗中类似于晚反应组织,α/β值为1.5,也成为前列腺癌放射治疗后局部复发的原因之一。
细胞周期动力学研究显示,放疗和热疗同时应用,可使处于M期、S期及G期的细胞停止时间明显延长,原先处于静止期细胞进入细胞周期,从而增强放疗效果[5-6]。HIFU能选择性抑制DNA合成,直接杀伤处于S期的肿瘤细胞或阻止细胞进入S期。前列腺癌对放射治疗耐受的肿瘤细胞主要是S期细胞和乏氧细胞,而其对热疗具有高度敏感性[7]。3D-CRT联合HIFU治疗前列腺癌有互补不足的作用。HIFU热疗可以增加前列腺肿瘤周围部分细胞的氧合量,提高放射治疗对肿瘤细胞杀伤作用;除此之外,HIFU热疗还可以抑制肿瘤细胞放射损伤的修复作用。李鼎九等[8]的研究结果显示,热疗能抑制放射治疗所致的前列腺癌细胞SLD和PLD的修复。Maluta等[9]用适形放疗联合热疗治疗144例局部晚期前列腺癌患者,结果5年总生存率为87%,5年无生化指标复发生存率为49%。
近年来,随着基础研究的深入,人们对HIFU治疗肿瘤的效应认识更全面[10]。Yang等[11]发现,HIFU治疗能提高机体对肿瘤的特异性和非特异性免疫能力,在肿瘤原发灶消退的同时,远处转移灶也发生消退。Rosberger等[12]发现热疗后,CD4+/CD8+比值可发生逆转。随着肿瘤细胞被破坏,被抑制的机体免疫功能有所恢复,与本研究结果相似。
前列腺癌患者通过综合治疗后,仍可以存活较长时间。本研究2年随访资料显示,3D-CRT+HIFU组远处转移率为18%,3D-CRT组为20%。因此,在选择治疗方案时,应从延长患者生存时间和提高生活质量为目的考虑。如单纯采用高剂量(中位剂量70 Gy)放射杀灭肿瘤细胞,难免造成周围正常组织损伤。本研究急性不良反应发生率与国内外文献报道相似[13-15]。
总之,3D-CRT联合HIFU治疗老年性前列腺癌,能提高肿瘤局部控制率,升高患者机体免疫细胞,并显著减少急性不良反应,是治疗失去手术指征的老年性前列腺癌的有效方法,远期疗效还有待进一步随访。
[1] 叶定伟, 李长岭. 前列腺癌发病趋势的回顾和展望[J].中国癌症杂志, 2007, 4(2): 178-180.
[2] 房辉, 李晔雄. 前列腺癌的适形和调强适形放疗[J]. 癌症进展杂志, 2005, 3(5): 449-460.
[3] 余子豪. 前列腺癌三维适形与调强适形放射治疗[J]. 中华泌尿外科杂志, 2006, 27(9): 647-648.
[4] 王文玲, 文小平, 杨晓峰, 等. 37例前列腺癌三维适形放疗的预后分析[J]. 中华放射肿瘤杂志, 2006, 15(3): 201-203.
[5] 彭楠, 赵彼得. 临床肿瘤热疗[M]. 北京: 人民军医出版社, 2002: 50-59.
[6] 殷蔚伯, 谷铣之. 肿瘤放射治疗学[M]. 3版. 北京: 中国协和医科大学出版社, 2002: 437-443.
[7] 向作林, 曾昭冲, 吴铮. 三维适形加量放疗联合射频热疗治疗局部晚期前列腺癌的临床观察[J]. 临床肿瘤学杂志, 2009, 14(4): 361-363.
[8] 李鼎九, 胡自省, 钟锍斌. 肿瘤热疗学[M]. 郑州: 郑州大学出版社, 2003: 83-103.
[9] MALUTA S, DALL’OGLIO S, ROMANO M, et a1. Conformal radiotherapy plus local hyperthermia in patients affected by locally advanced high risk prostate cancer: preliminary results of a prospective phase Ⅱ study[J]. Int J Hyperthermia,2007, 23(5): 45l-456.
[10] 杨镇. 肿瘤免疫学[M]. 武汉: 湖北科学技术出版社,1998: 97.
[11] YANG R, REILLY C R, RESCORLA F J, et al. Effect of highintensity focused ultrasound in the treatment of experimental neuroblastoma[J]. J Pediatr Surg, 1992, 27(2): 246-250.
[12] ROSBERGER D F, COLEMAN D J, SILVERMAN R, et al. Immunomodulation in choridal melanoma: reversal of inverted CD4/CD8 ratios following treatment with ultrasonic hypertherrmial[J]. Biotechnol Ther,1994, 5 (1-2): 59-68.[13] 秦晓健, 叶定伟. 根治术后病理T3期或切缘阳性前列腺癌的辅助放疗的系统综述和荟萃分析[J]. 中国癌症杂志,2009, 19(2): 83-84.
[14] HANK G E, HANLON A L. The impact of radiation dose on survival following conformal treatment of prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2004, 60(Suppl): 168-173.
[15] POLLACK A, ZAGARS G K, STARKSCHALL G, et a1.Prostate cancer radiation dose response: results of the MD Anderson phase Ⅲ randomized trial[J]. Int J Radiat Oncol Biol Phys, 2002, 53(5): 1097-1105.
