213例偶发肾癌的临床特点及预后分析
2011-08-14周凯葛京平高建平张征宇周文泉
周凯 葛京平 高建平 张征宇 周文泉
1.南京大学医学院临床学院,江苏 南京 210002;2.南京军区南京总医院泌尿外科,江苏 南京 210002
偶发肾癌是指无临床症状或体征,在健康体检或因其他疾患行B超、CT等检查时发现的肾脏肿瘤,后经病理检查诊断为肾细胞癌,又称“无症状肾癌”[1]。肾细胞癌(renal cell carcinomas,RCC)起源于肾实质泌尿小管上皮系统,作为泌尿生殖系统的常见恶性肿瘤,近年来发病率呈上升趋势,其中偶发肾癌的检出率逐年提高。研究偶发肾癌的临床特点及影响肾癌预后的因素对提高肾癌患者的生存率,指导临床实践具有重要意义。本文就偶发肾癌与非偶发肾癌的临床资料、病理类型、肿瘤TNM分期及肿瘤细胞分级等是否有差异进行分析,采用Cox回归模型确定影响肾癌预后的独立因素,以期指导临床治疗和随访。
1 资料和方法
1.1 临床资料
收集我院泌尿外科2003年1月—2008年12月收治的431例肾细胞癌患者的资料,所有病例均经病理确诊,其中369例获随访,随访率为85.61%。其中男性249例,女性120例,男女性别比为2.08∶1;年龄16~80岁,平均年龄51岁;左侧肾癌180例,右侧肾癌189例,左右比为1∶1.05。肿瘤直径1~16 cm,平均5.52 cm。无症状肾癌213例,有泌尿系统症状156例,其中血尿102例,腰痛90例,协腹部包块8例,肾癌“三联征”表现6例。全部患者均行B超和CT检查。根据术前影像学资料、术中情况及术后病理资料,按2010年AJCC分期标准(第7版)重新进行病理分期:Ⅰ期(T1N0M0)185例,Ⅱ期(T2N0M0)107例、Ⅲ期(T1-3N0-1M0)59例,Ⅳ期(T0-4N0-1M0-1)18例;按2004年WHO肾细胞癌分类标准重新进行病理分类:肾透明细胞癌(clear cell renal cell carcinoma,CCRCC)265例,乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)50例,肾嫌色细胞癌(chromophobe cell renal carcinoma,ChRCC)43例,其他类型及未归类的病理类型(unclassified RCC)11例;采用三级分类标准进行肿瘤细胞分级:高分化(G1)297例、中分化(G2)45例、低分化(G3)27例。术后均进行严格的随访,随访内容包括血常规、血生化、胸片及腹部超声或CT检查。
1.2 治疗情况
328例患者行根治性肾切除术(laparoscopic nephron-sparing surgery,LNSS),30例行腹腔镜下保留肾单位手术(其中6例术前行肾动脉栓塞术),11例未予手术治疗。术后行α-干扰素免疫治疗355例,另3例行舒尼替尼靶向治疗。
1.3 统计学处理
采用SPSS 16.0软件进行统计学处理。偶发癌与非偶发癌在临床特点构成比的差异用Pearson卡方检验;采用Kaplan-Meier法计算总的生存率,偶发癌和非偶发癌两组的生存率;比较生存曲线采用log-rank检验;建立多因素Cox回归模型分析影响生存的独立预后因素;以P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床资料分析
369例肾癌患者中,偶发肾癌为213例(57.72%),非偶发肾癌为156例(42.28%)。肿瘤直径、病理分期、肿瘤细胞分级、远处转移以及行保留肾单位手术在两组中的分布差异均有统计学意义(P<0.05),而年龄、性别、肿瘤侧别及病理类型差异均无统计学意义(P>0.05)。各组临床病理资料见表1。
2.2 两组生存率分析
本研究通过设计随访表并以门诊、书信及电话等方式对所有患者进行随访,随访日期截至2009年6月1日,最终369例获得回访,62例失访,失访率为14.39%;随访时间1~6年。随访期间共有35例死亡,25例死于肝、肺及骨等远处转移,10例死于其他原因。1年生存率为95.21%,3年生存率为80.15%,5年生存率为62.52%。其中偶发肾癌组1、3及5年生存率分别为98.05%、85.62%及75.83%,非偶发组分别为90.02%、65.21%及60.57%,采用log-rank检验差异有统计学意义(P<0.05)。晚期偶发肾癌组与非偶发肾癌组的Ⅲ、Ⅳ期平均生存时间分别为26个月与22个月、16个月与14个月,logrank检验差异均无统计学意义(P>0.05)。
2.3 Cox比例回归模型多因素分析
模型结构为h(t,x) =h0(t) exp(β1x1+β2x2+…+βmxm),其中t表示生存时间,x=(x1,x2,…,xm)表示与生存时间可能有关的协变量;β=(β1,β2,…,βm)为Cox模型的回归系数。当回归系数βm为正值时,因子xm为危险因子;βm为负值时, xm为保护因子。选择年龄(x1)、性别(x2)、肿瘤直径(x3)、肿瘤位置(x4)、远处转移(x5)、术前栓塞治疗(x6)、病理分类(x7)、病理分期(x8)、肿瘤细胞分级(x9)、保留肾单位手术(x10)、是否偶发(x11)共11项指标进行Cox回归分析。采用基于偏最大似然估计的向前逐步回归法,筛选出对生存时间有显著影响的因素,采用系统默认变量进入方程标准为P≤0.05,移除标准为P>0.10。最终Cox比例风险回归模型选入4个指标:是否远处转移(x5)、TNM分期(x8)、肿瘤细胞分级(x9)和是否为偶发(x11),由此建立肾癌患者生存因素回归模型: h(t,x) =h0(t)exp(0.426x5+0.843x8+1.576x9-1.429x11),对数似然比检验χ2=52.19,P<0.001。结果显示,有无远处转移(P<0.001)、肿瘤T分期(P=0.012)、肿瘤细胞分级(P=0.004)、是否偶发(P=0.001) 为影响肾细胞癌患者预后的独立因素(表2)。
3 讨 论
RCC位列最常见恶性肿瘤第14位[2],其发病率存在地理差异,以欧洲和北美地区发病率最高,男性多于女性,但两者生存率相似。2009年,美国新增约57 760例肾癌患者,同年12 980人死亡,这一数据表明肾癌是最致命的泌尿生殖系统肿瘤[3]。随着社会经济的发展,人们对健康的重视以及B超、CT等影像学诊断水平的提高,偶发肾癌、早期肾癌以及微小癌的检出率不断增加,而出现肾癌“三联征”(包括血尿、腰痛及协腹部包块)的患者已不到10%[4]。本组研究发现,近年来我院收治的偶发肾癌的患者比例高于非偶发肾癌(57.72%vs 42.28%)。偶发肾癌往往缺乏特异性的症状和体征,肿瘤分期早、肿瘤细胞分级低。一般认为偶发肾癌并非肾癌的一种类型,而只是肾癌未出现临床表现的一个发展阶段。本组资料中偶发肾癌的肿瘤直径、临床病理分期以及肿瘤细胞的病理分级均明显低于非偶发肾癌患者(P<0.05)。此外,偶发肾癌发生远处转移低于非偶发肾癌(P<0.05),这些结果提示偶发肾癌属于临床较早发现,肾细胞癌的临床病理分期也多属早期,肿瘤细胞的分化相对较好。
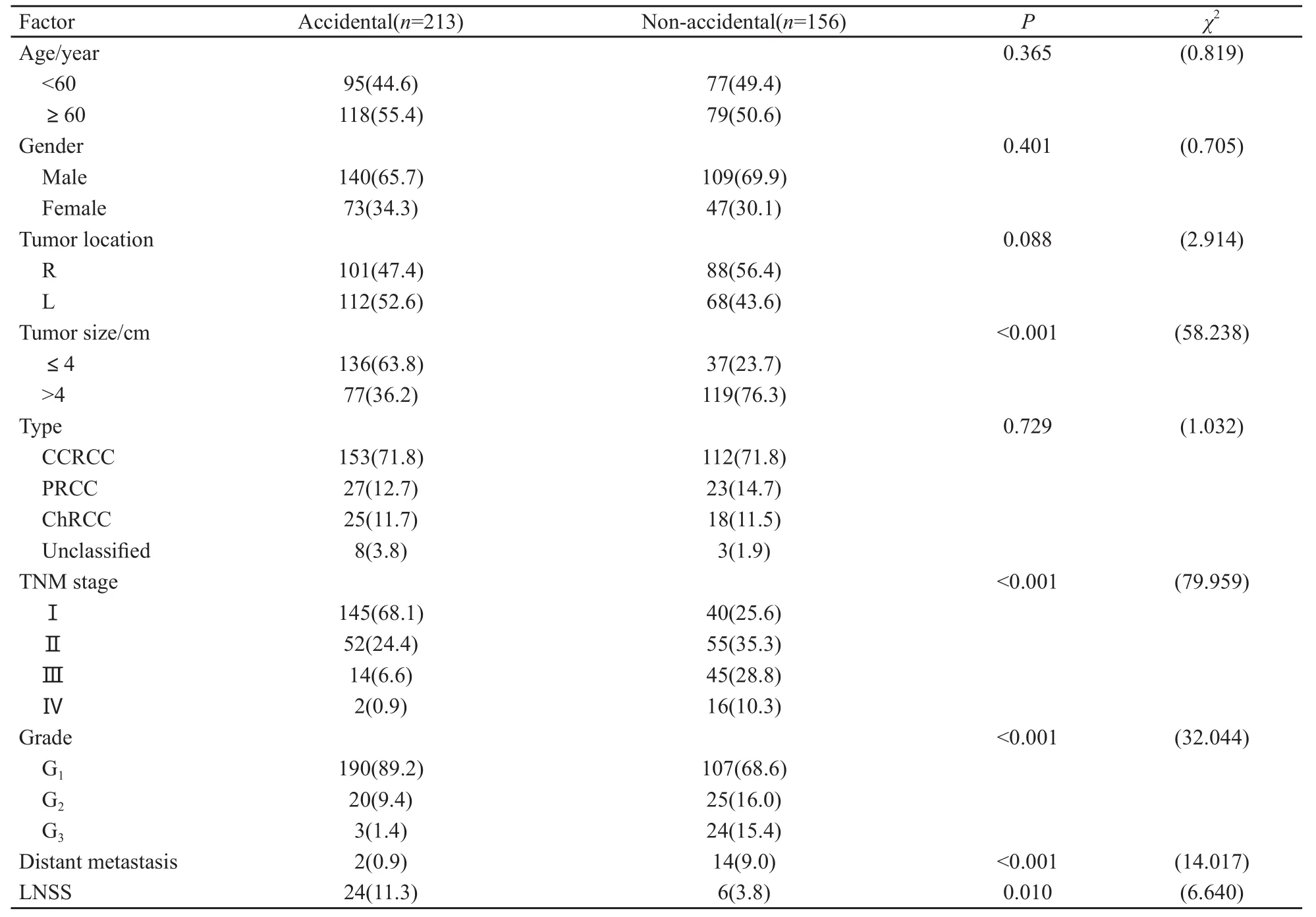
表1 两组患者的临床病理资料Tab.1 The clinical pathological data of the two groups[n(%)]
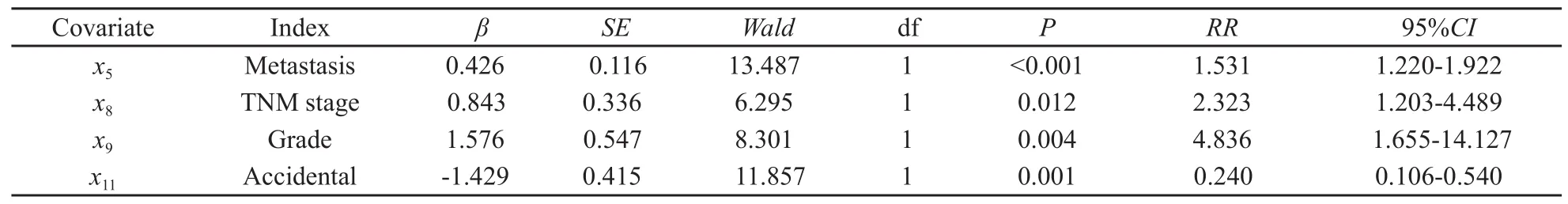
表2 影响术后肾癌患者生存的Cox模型多因素分析Tab.2 Cox regression analysis on the survival time of postoperative patients with RCC
近年来,偶发肾癌检出率呈上升趋势。有文献报道,偶发肾癌占2/3,影像学检查包括彩超、CT以及MRI[5]。彩色多普勒超声可以检出小肾癌和偶发肾癌,也有助于肾脏肿瘤的鉴别诊断。超声检查作为一种无创且相对经济的检查手段,可以作为体检及肾癌随访的常规检查方法,本组患者术前均行彩超检查。CT是诊断肾癌最有价值和精确的方法,可以显示0.5 cm以上的肿瘤,CT增强扫描准确性则更高,其早期诊断的敏感性高,对于偶发肾癌的早期确诊有重要意义,是目前肾癌最可靠的影像学诊断方法。MRI对于小肾癌的检出率不如CT,但对于诊断肾癌与组织器官是否有浸润,肾静脉和下腔静脉内有无癌栓具有明显优势,且有助于鉴别高密度肾囊肿。选择性肾动脉造影对肾癌的诊断有一定的价值,但作为一项有创操作限制了其临床应用。正电子发射断层显像/计算机断层成像(positron emission tomography/computed tomography,PET-CT)的应用对偶发肾癌早期发现也具有一定的作用[6]。
局限性肾细胞癌首选治疗方法是根治性肾切除术(radical nephrectomy,RN)或保留肾单位手术(nephron-sparing surgery,NSS)[7]。NSS治疗偶发肾癌的效果与RN一样,偶发肾癌多为小肾癌或早期肿瘤,NSS能在切除肿瘤的同时保留切除残肾的肾功能,越来越受到重视。有报道NSS术后患者生活质量高于根治性切除患者[8]。传统的肾癌根治手术治疗创伤大、并发症多。随着微创外科学技术的不断发展,尤其是腹腔镜技术的推广,目前LNSS已成为研究热点,但是肿瘤切缘的把握,肾血流阻断,肾脏热缺血再灌注损伤控制,肾实质创面出血的控制,创面的修复,术后继发性出血和尿漏等问题仍是手术的难点。本组资料中,24例偶发肾癌和6例症状性肾癌患者均成功实施了LNSS治疗,无一例出现继发性出血和尿漏并发症,无肿瘤局部复发或远处转移,疗效肯定。此外,还有激光治疗、冷冻消融及射频消融等微创治疗肾癌的新方法。对转移性肾癌尚无标准的治疗方案,应采用以内科为主的综合治疗,外科手术主要是辅助性治疗手段。由于肾细胞癌对于放、化疗均不敏感,术后辅助治疗如白介素或α-干扰素,总体反应率只有15%~20%,而不良反应率高达60%~90%,且不良反应大[9],从而影响治疗效果。由于肾脏是理想的基因治疗的靶器官,分子靶向药物将会成为最具潜力的治疗方法,生命健康质量(the health-related quality of life,HRQOL)数据可以帮助确定基因治疗的总体作用[10]。
偶发肾癌5年生存率高于非偶发肾癌。本组资料中,偶发肾癌组1、3及5年生存率分别为98.05%、85.62%及75.83%,非偶发组分别为90.02%、65.21%及60.57%,差异有统计学意义(P<0.05)。肾 细胞癌的预后受多种因素影响,而各个因素间又相互依存,相互制约,故研究影响肾细胞癌的预后因素较为复杂。Cox回归模型作为一种多因素分析方法,能定量筛选和综合分析各种预后因素的作用,克服混杂因素干扰,是确定肿瘤患者预后因素的较好方法[11]。肾细胞癌的病理分期是公认的影响预后最主要的因素,此外,有学者提出组织学亚型、有无症状、肿瘤中是否有组织坏死、一些生化指标、分子生物学指标以及患者的行为状态评分等因素也与肾癌的预后有关[12]。但是,要不断完善且优化预后预测模型还需要进一步的多中心大样本的病例研究。本组资料中,偶发肾癌分期显著低于非偶发肾癌(P<0.05)。这种差异可能是导致偶发肾癌生存率明显高于非偶发肾癌的重要原因。本资料显示TNM分期是影响预后的独立因素,比较晚期肾癌两组的平均生存时间,差异无统计学意义(P>0. 05)。另外肿瘤细胞分级、是否偶发及远处转移是影响肾癌预后的重要因素。偶发肾癌的患者由于发现较早,临床分期较早,出现局部或远处转移较少,所以有更高的生存率,更好的预后以及更低的病理分期。
[1] ISRAEL G M, SILVERMAN S G. The incidental renal mass[J]. Radiol Clin N Am, 2011, 49(2): 369-383.
[2] FLANIGAN R C, POLCARI A J, HUGEN C M. Prognostic variables and nomograms for renal cell carcinoma[J]. Int J Urol, 2011, 18(1): 20-31.
[3] JEMAL A, SIEGEL R, WARD E, et al. Cancer statistics[J].CA Cancer J Clin, 2009, 59(4): 225-249.
[4] CHEN D Y T, UZZO R G. Evaluation and management of the renal mass[J]. Med Clin N Am, 2011, 95(1): 179-189.
[5] FURNISS D, HARNDEN P, ALI N, et al. Prognostic factors for renal cell carcinoma [J]. Cancer Treat Rev, 2008, 34(5):407-426.
[6] KOCHHAR R, BROWN R K, WONG C O, et al. Role of FDG PET/CT in imaging of renal lesions[J]. J Med Imag Radiat Oncol, 2010, 54(4): 347-357.
[7] TOUIJER K, JACQMIN D, KAVOUSSI L R, et al. The expanding role of partial nephrectomy: a critical analysis of indications, results, and complications[J]. Eur Urol, 2010,57(2): 214-222.
[8] 王宗平, 李长岭. 175例局限性肾癌保留肾单位手术治疗结果分析[J]. 现代泌尿生殖肿瘤杂志, 2010, 2(2): 69-73.
[9] 赵国志, 郑少斌.肾癌的基因治疗进展[J]. 广东医学,2008, 29(4): 527-529.
[10] DAVID C. Beyond traditional outcomes: improving quality of life in patients with renal cell carcinoma[J]. Oncol, 2011,16(2): 23-31.
[11] 李有元, 胡志全, 叶章群. 肾细胞癌数据库三年临床资料COX模型分析[J]. 现代泌尿外科杂志, 2008, 13(4): 294-296.
[12] KAWATA N, NAGANE Y, YAMAGUCHI K, et al. How do symptoms have an impact on the prognosis of renal cell carcinoma? [J]. Int J Urol, 2008, 15(4): 299-303.
