α、β-微管蛋白在乳腺癌变不同阶段的表达及意义
2011-08-14应荣彪冯俊李建军瞿海江姚俊
应荣彪 冯俊 李建军 瞿海江 姚俊
台州市肿瘤医院,复旦大学附属肿瘤医院台州分院肿瘤外科,浙江 台州 317502
微管是细胞骨架的主要组成部分, 由α、β-微管蛋白异二聚体组成[1],是紫杉烷类抗肿瘤的作用靶点,微管蛋白可以通过对这一靶点的调节影响紫杉醇的抗肿瘤活性。微管在细胞分裂中具有极其重要的作用, 现已成为抗肿瘤药物研究的重要靶点之一。目前,紫杉烷类是治疗乳腺癌最重要的化疗药物之一,通过促进微管蛋白聚合,最终导致乳腺肿瘤细胞凋亡。然而紫杉烷类的耐药性常常限制了治疗效果,使病情难以长期控制。故揭示α、β-微管蛋白在乳腺癌变过程中表达水平的变化显得尤为重要,为通过改变其表达水平改善乳腺癌紫杉烷类化疗耐药性提供理论基础。
1 资料和方法
1.1 一般资料
选取台州市肿瘤医院2004年8月—2009年12月间具有完整的临床病理资料和存档的石蜡包埋组织标本,按世界卫生组织(WHO)乳腺病理组织学分类(2003年新版)标准[2],经双盲病理诊断,乳腺非典型增生(atypical ductal hyperplasia,ADH)30例,从同期病例中随机抽样,导管内癌(ductal carcinoma in situ,DCIS)30例和浸润性癌(invasive ductal carcinoma,IDC)30例,另从乳腺纤维腺瘤行区段切除术的标本中取瘤旁正常乳腺组织30例。
1.2 试剂与仪器
鼠抗人α-tubulin单克隆抗体IgG(ZM-0438),鼠抗人β-tubulin单克隆抗体IgG(sc-58880)为Santa Cruz公司产品;超敏即用型鼠二步法(非生物素)免疫组织化学检测试剂盒(PV-9002)为美国GBI公司产品;使用全自动免疫组化机(美国Biogenex AS60302)进行免疫组化实验。
免疫组织化学检测:按照免疫组织化学二步法检测试剂盒操作说明进行(一抗稀释度:α-微管蛋白1∶100,β-微管蛋白1∶100)。以PBS液代替第一抗体做阴性对照,以已知乳腺癌切片做阳性对照。
1.3 免疫组织化学结果评价标准
α、β-微管蛋白染色阳性定义为:细胞质内呈均匀着色的棕黄色颗粒,背景清晰,无非特异性着色。染色结果采用双盲法阅片判断,依据Tanaka的定量计分法[3]:选取5个有代表性的不同区域,400倍镜下计算阳性细胞百分率并评定显色强度,依照阳性细胞百分率≤5%、>5%~25%、>25%~50%、>50%~75%和>75%分别得0、1、2、3、4分;依照显色强度未着色、浅黄色、棕黄色、棕褐色分别得0、1、2、3分,两项得分相乘,并取5个高倍视野得分的平均值。按照分数分为4个等级:0~1为(-),2~4为(+),5~8为(++),9分以上为(+++)。
1.4 统计学处理
本实验免疫组化检测所得结果为等级资料,采用SPSS 13.0统计分析软件,以秩和检验、Spearman等级相关分析为统计学方法。P<0.05为差异有统计学意义。
2 结 果
2.1 α、β-微管蛋白表达和定位
可于光镜下观察到细胞质内呈均匀着色的棕黄色颗粒,细胞核、间质纤维细胞、淋巴细胞和单核吞噬细胞等均无阳性着色(图1,2),各组样本α、β-微管蛋白免疫组织化学染色评分情况(表1),正常乳腺组阳性率最低,ADH组、DCIS组至IDC组阳性率逐渐上升,其中IDC组最高。
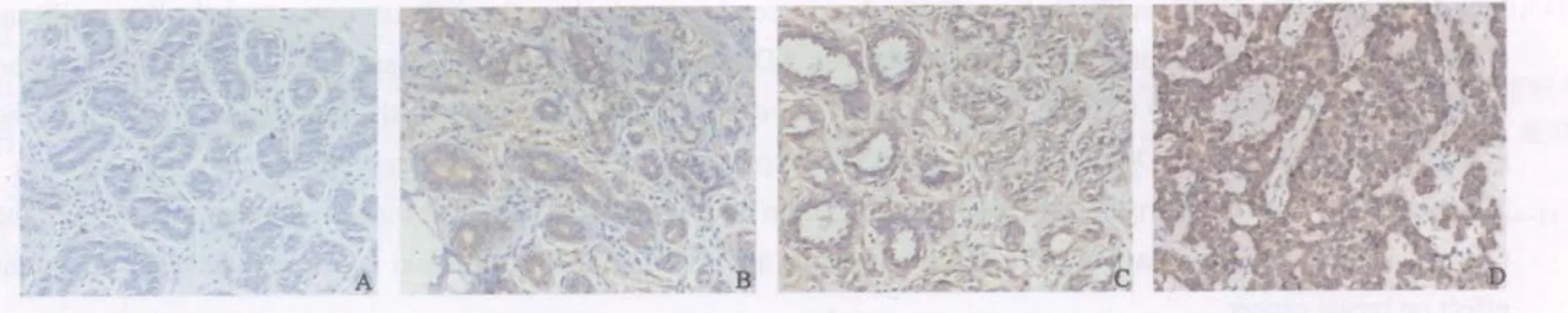
图1 α-微管蛋白分别在正常组织(A)、ADH(B)、DCIS(C)及IDC(D)中的表达Fig.1 Expression of α-tubulin in normal(A), ADH(B), DCIS(C) and IDC(D) tissue of breast(PV, ×200)
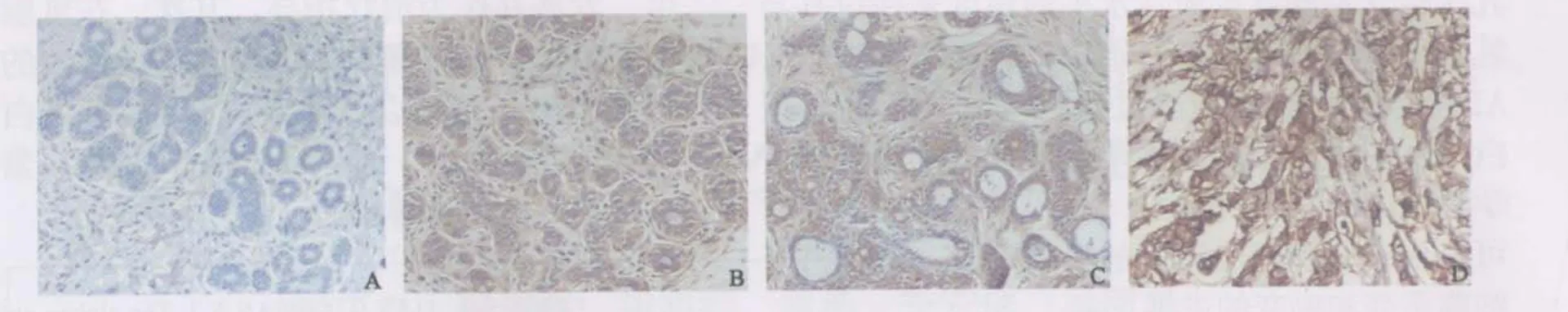
图2 β-微管蛋白分别在正常组织(A)、ADH(B)、DCIS(C)及IDC(D)中的表达Fig.2 Expression of β-tubulin in normal(A), ADH(B), DCIS(C) and IDC(D) tissue of breast(PV, ×200)
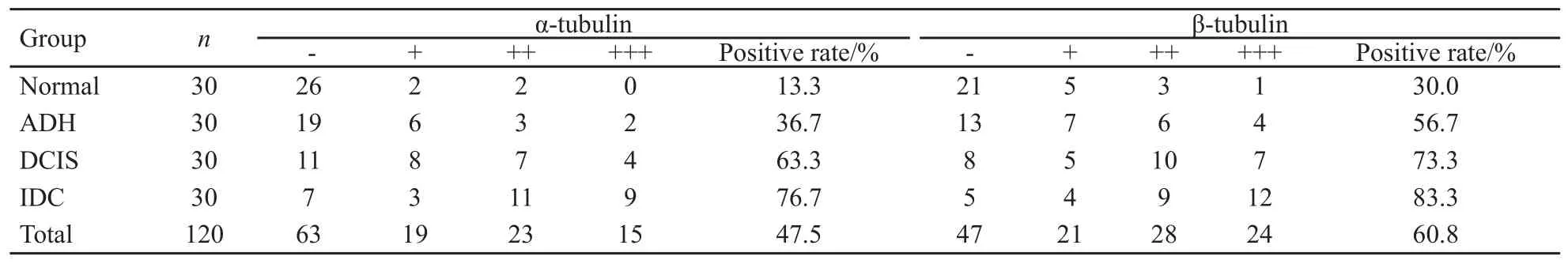
表1 α、β-微管蛋白在不同乳腺组织中的表达情况Tab.1 Expression of α, β-tubulin in different breast tissues
2.2 α、β-微管蛋白表达的组间相关性
α-微管蛋白在乳腺正常组织、ADH、DCIS及IDC病例中的表达经等级分组资料的秩和检验(Krauskal-Wallis检验),上述4组样本间表达的差异有统计学意义(χ2=32.864,P=0.000),再通过Mann-Whitney检验对各组进行两两比较:各组间差异均有统计学意义(P<0.05,表2)。
β-微管蛋白在乳腺正常组织、ADH、DCIS及IDC病例中的表达差异有统计学意义(χ2=26.28,P=0.000),各组进行两两比较:除ADH组和DCIS组间、DCIS组和IDC组间差异无统计学意义(P>0.05),其他各组间差异均有统计学意义(P<0.05,表2)。

表2 不同乳腺组织间α、β-微管蛋白表达的比较Tab.2 Comparison of α, β-tubulin expression in different breast tissues
2.3 α、β-微管蛋白表达的组内相关性
分别在各组内对α、β-微管蛋白的表达进行Spearman相关性分析,结果显示,在ADH、DCIS及IDC各组内,α、β-微管蛋白表达呈正相关(P<0.05),而正常乳腺组织则无相关性(表3)。
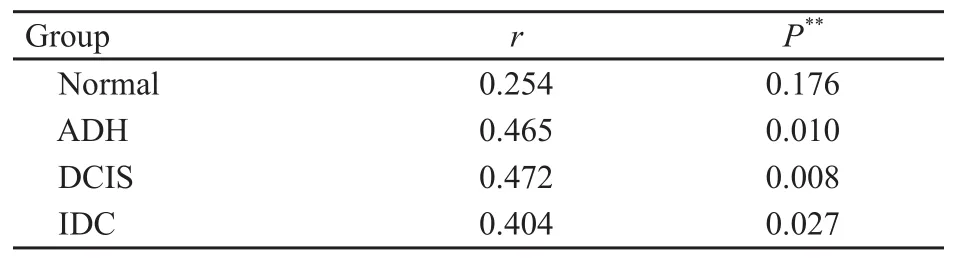
表3 α、β-微管蛋白在不同组织中表达的相关性Tab.3 Correlation of α, β-tubulin expression in different breast tissues
3 讨 论
紫杉烷类是乳腺癌最重要的化疗药物之一[4],可通过促使α、β-微管蛋白异二聚体装配成微管,并阻止其解聚而使微管束不能与微管组织中心相互连接,由此抑制纺锤体的正常形成,将细胞周期阻断于G2/M期,导致有丝分裂异常或停止,使癌细胞无法继续分裂而死亡[5]。最近的研究表明,乳腺癌患者对紫杉烷类耐药性的出现,至少部分是由乳腺肿瘤细胞中α、β-微管蛋白的表达或修饰水平发生改变所引起的。
α、β-微管蛋白表达异常与肿瘤的恶性生物学行为密切相关。Giarnieri等[6]研究发现,α、β-微管蛋白的表达与直肠癌的发生、发展有关。本实验从α、β-微管蛋白在乳腺癌变不同阶段表达水平的角度来探讨其与乳腺癌的关系。结果显示,在乳腺正常细胞、ADH、DCIS及IDC发展过程中,α、β-微管蛋白阳性表达的细胞数逐渐上升,差异具有统计学意义(P<0.05)。提示α、β-微管蛋白的异常可出现在乳腺癌浸润前的早期阶段,并促进了细胞恶变和癌变的进展。
经进一步分析发现,在ADH及DCIS中,α、β-微管蛋白标志的阳性细胞数也明显高于正常组织组,差异均有统计学意义。提示在ADH和DCIS中均已有α、β-微管蛋白的过度表达,可以推测在乳腺恶性肿瘤形成的关键性步骤中,随着α、β-微管蛋白表达量逐渐增加,解聚动力加快,与微管蛋白池交换蛋白数量增加,引起中心体拷贝数增加,多纺锤体形成。中心体异常可导致染色体组的不稳定性和非整倍体的形成,导致抑癌基因的缺失或癌基因的获得,改变细胞表型进而促进肿瘤发生、发展[7-8]。
本研究通过检测乳腺癌细胞的中心体α、β-微管蛋白的改变,阐述了乳腺癌发展的不同阶段组织中α、β-微管蛋白表达水平的变化,并对乳腺癌的发展模式进行了讨论。这些研究成果从细胞遗传学角度进一步阐明乳腺癌的发生、发展机制,提示α、β-微管蛋白可以作为乳腺癌肿瘤标志物,用于揭示乳腺癌发生、发展并作为治疗指导。其次,在乳腺癌的治疗过程中如果配合α、β-微管蛋白的表达水平检测,并辅以针对α、β-微管蛋白表达调节的联合治疗,有可能提高乳腺癌对紫杉烷类的敏感性,改善预后。
[1] LEWIS S A, TIAN G, COWAN N J. The alpha- and betatubulin folding pathways[J].Trends Cell Biol, 1997, 7(12):479-484.
[2] TAVASSOLI F A, DEVILEE P. The WHO classification of tumors of the breast and female genital organs[M]. Lyon:IARC Press, 2003: 110-112.
[3] TANAKA K, IWAMOTO S, GON G, et al. Expression of survivin and its relationship to loss of apoptosis in breast carcinomas[J]. Clin Cancer Res, 2000, 6(1): 127-134.
[4] MCGROGAN B T, GILMARTIN B, CARNEY D N, et al.Taxanes, microtubules and chemoresistant breast cancer[J].Biochim Biophys Acta, 2008, 1785(2): 96-132.
[5] EL-KAREH A W, LABES R E, SECOMB T W. Cell cycle checkpoint models for cellular pharmacology of paclitaxel and platinum drugs[J]. AAPS J, 2008, 10(1): 15-34.
[6] GIARNIERI E, DE FRANCESCO G P, CARICO E, et al. Alpha- and beta-tubulin expression in rectal cancer development[J]. Anticancer Res, 2005, 25(5): 3237-3241.
[7] STORCHOVA Z, PELLMAN D. From polyploidy to aneuploidy, genome instability and cancer[J]. Nat Rev Mol Cell Biol, 2004, 5(1): 45-54.
[8] SALISBURY J L, D'ASSORO A B, LINGLE W L. Centrosome amplification and the origin of chromosomal instability in breast cancer[J]. J Mammary Gland Biol Neoplasia, 2004,9(3): 275-283.
