基于微电极阵列的嗅球细胞网络传感器的研究
2011-08-13陈庆梅肖丽丹刘清君
陈庆梅 肖丽丹 李 蓉 张 威 刘清君 王 平*
1(浙江大学 生物传感器国家专业实验室、生物医学工程教育部重点实验室 生物医学工程系,杭州 310027)
2(江西中医学院 医疗电子学科组,南昌 330006)
引言
嗅觉引导着动物及人类的许多有意义的行为,比如对事物进行识别和分类[1]、促使记忆存储和恢复[2-3]以及影响两性的[4]、父母的[5]及社会的[6]关系等。在哺乳动物嗅觉系统中,嗅球(olfactory bulb,OB)是嗅觉通路的第一中转站,负责嗅觉信息的处理并将信息从感觉器官传递至中枢靶系统[7-9]。哺乳动物的嗅球呈片状结构,其水平切片具有清晰的层次结构。嗅球内含多种类型的细胞,如僧帽细胞(mitral cells,MCs)、丛状细胞(tufted cells,TCs)、颗粒细胞(granule cells,GCs)、球周细胞(periglomular cells,PGs)等[7,10-12]。不同的嗅球神经元表现出不同的生理功能[7,12]。僧帽细胞和丛状细胞通过突触小球内的突触传递获得来自嗅觉受体神经元(olfactory receptor neuron,ORN)的信息[10],并作为输出单元将处理后的信号传递到更高级的中枢[13-15]。而颗粒细胞和球周细胞属于中间神经元,在嗅觉信息处理中具有重要作用[15-17]。因此考察嗅球神经元不同的电生理特性,对开展嗅觉信息在嗅球内处理和传递的研究具有重要的意义。
为了便于镜下观察,基于细胞培养的嗅球神经元是主要的实验对象之一。目前对离体嗅球神经元的电信号检测主要是膜片钳记录技术。随着微电子机械加工技术(MEMS)的发展,微电极阵列(microelectrode array,MEA)、光寻址电位传感器(light addressable potentiometric sensor,LAPS)和 场效应晶体管(field effect transistor,FET)等微传感技术在生物信号检测中得到迅速发展和广泛应用。Liu等[18]曾经将嗅球神经元培养在 LAPS芯片上观察气味对僧帽细胞有无响应,作为研究嗅觉受体神经元对气味响应的实验对照。为了进一步研究嗅球神经元的电生理特性,本研究将利用MEA长时程、无损、多通道同步测量的特点,将嗅球神经元培养在MEA上,实现对嗅球神经元的多方位同步观察和分析。
1 实验与方法
1.1 器件准备
微电极阵列MEA的制作采用标准微电子制作工艺:5吋玻璃基底(厚度500 μm)经过标准清洗后在表面磁控溅射一层厚度100~500 Å的Cr或Ti-W薄膜作为中间层,然后再溅射厚度为2000~5000 Å的Au薄膜形成电极层;溅射完成后,沉积一层聚酰亚胺或光刻胶作为绝缘层,并通过反应离子刻蚀技术(reactive ionetching,RIE)刻蚀暴露出金电极阵列图形。将器件固定在PCB座上,利用点焊技术将器件上的焊点与PCB板上的焊盘用金线连通。然后用生物相容性较好的环氧树脂覆盖焊丝,粘接测试腔,室温固化,得到如图1(a)所示的器件。

图1 器件。(a)封装的器件;(b)电镀铂黑的MEA显微照片Fig.1 The instrument.(a)encapsulated instrument;(b)micrograph of MEA after being electroplated platinum black
为了降低热噪声,提高细胞胞外信号检测的信噪比,本实验对MEA金电极表面电镀铂黑颗粒,以增加电极的表面积,降低电极阻抗。电镀系统采用三电极系统与CHI660 C型电化学工作站,每个电极的电镀时间约45 s。最后得到的MEA显微图片如图1(b)所示,电极直径为30 μm。
1.2 细胞培养
嗅球细胞的培养与大多数神经元培养方法相似。将新生SD乳鼠(1~3 d)剪取鼠头,将其放入酒精中消毒1~2 min后,立即转入盛有磷酸盐缓冲液(phosphate buffer saline,PBS)的无菌培养皿中。剪开头皮,拨开颅骨,暴露全脑。轻轻剥离两侧嗅球,放于另一无菌盛有PBS的培养皿中。轻轻剥去被膜,然后将嗅球剪成1 mm3左右的组织块,加入2 mL 含 10 μg/L 神经生长因子(nerve growth factor,NGF)的 DMEM(Dulbecco's modified eagle's medium)培养液中进行吹打,制成细胞悬液,接种在MEA表面。24 h后全量换液,48 h后滴加5-氟尿嘧啶(fluorouracil,5-FU)以抑制胶质细胞的过度生长。每3 d换液一次。培养5~7 d后,可以将芯片取出进行观察和测试。
1.3 染色处理
为了更加清楚地观察嗅球神经元的形态和生长状态,信号测试结束后对细胞进行染色处理。本实验采用瑞士染色法,染液包括Ⅰ和Ⅱ两组份,由碱性染料美蓝和酸性染料伊红分别配制而成。首先将细胞培养腔内的神经测试液吸干;然后滴加适量染液Ⅰ于培养腔内,保证溶液浸没细胞;1 min后将等量的染液Ⅱ滴加入培养腔,保证染液Ⅰ、Ⅱ均匀混合;大约5 min后用清水冲洗数遍;将培养腔内溶液吸干,置于显微镜下观察。
1.4 信号采集与分析
利用多通道放大器(MEDl6,Multichannel systems,GmbH,德国),本实验可以实现 16通道的同步记录,采样频率为10 kHz。
为了评估嗅球细胞网络传感器的检测能力,选用嗅球内兴奋性神经递质谷氨酸(glutamic acid,Glu)进行了实验研究[19],观察了 Glu作用前后不同通道嗅球神经元的响应。Glu溶液由正常神经测试液配制而成,最终浓度为200 μM。
信号的统计分析图和光栅图均通过Matlab软件完成。
2 结果与讨论
2.1 嗅球细胞网络传感器的构建
嗅球细胞网络传感器是通过细胞培养技术,使嗅球神经元与MEA芯片的微电极在多个位置进行耦合,形成的一种生物-电子复合传感系统。因此,细胞培养是嗅球细胞网络传感器设计的基础,细胞的生长状态及形成的神经元网络的好坏将直接影响细胞网络传感器的检测效果。图2为嗅球细胞在MEA器件上培养7 d后经过瑞士染色处理以后的显微照片。在显微镜下可以清晰地观察到双极、三极的嗅球神经元,以及神经元的树突和轴突。图2显示嗅球细胞在MEA芯片上生长状态良好,神经元的树突和轴突按照一定的方向伸长,开始建立联系和重新形成网络,这为进一步的电生理测量奠定了基础。
在目前的细胞培养实验中还观察到一些现象,比如细胞生长不是非常均匀,有的地方细胞比较密集,有的地方细胞比较稀疏;细胞不是完全地生长在微电极上,而是更倾向于生长在MEA芯片的基底上。这些现象可能是表面处理的涂层不均匀引起的。因此,实验中需要进一步改进MEA表面处理的方法并注意操作的细节,保证细胞均匀地生长和神经元网络的形成,以提高嗅球细胞网络传感器的检测率和稳定性。

图2 MEA上培养的嗅球神经元网络Fig.2 Olfactory neuron network cultured on MEA
2.2 嗅球细胞网络传感器的实验分析
利用嗅球细胞网络传感器和多通道采集系统,可以同步观察多点的嗅球神经元电生理活动。图3为来自6个通道的嗅球神经元的自发信号和200 μM Glu作用下的诱发响应。由图可知,不同通道的嗅球神经元响应不一致,信号的幅度和频率不相同,这可能是由于各电极上生长的嗅球神经元的类型或数目不同。比较各通道Glu作用前后的响应发现,Glu使各通道神经元锋电位的发放更加频繁,对信号的幅度也有增强作用。此外,在自发信号很弱或者没有响应的通道,Glu刺激后能够产生诱发响应,有时甚至会产生比较强的反应,如通道6(Ch6)的响应。当锋电位发放频率足够大时会产生一种爆发(burst)现象,如图3中Ch3和Ch6的响应。结果表明,Glu对嗅球神经元表现出一种兴奋作用,在嗅觉信息的处理中具有放大信号的功能。此外,Glu对每个通道神经元的发放频率和信号幅度的影响也不完全一样,这可能是由于不同的嗅球神经元具有不同的生理功能,因而表现出不同的电生理响应。
取Ch3、Ch6中局部信号(方框内信号)进行放大,得到图3底部所示的波形。局部放大的信号表现出明显的振荡特征。有研究称,嗅球中僧帽细胞释放的Glu使颗粒细胞产生兴奋,而颗粒细胞释放的γ-氨基丁酸(GABA)反过来又抑制了僧帽细胞的响应[20],在僧帽细胞与颗粒细胞之间形成一种互惠连接[21-23];这种互惠作用使得嗅球神经元信号产生一种快速的同步振荡[21-22,24],在气味的识别中扮演着重要角色[9]。本研究的结果显示,Glu的作用使部分通道的信号产生了振荡,说明Glu可能是气味识别中的重要神经递质之一。
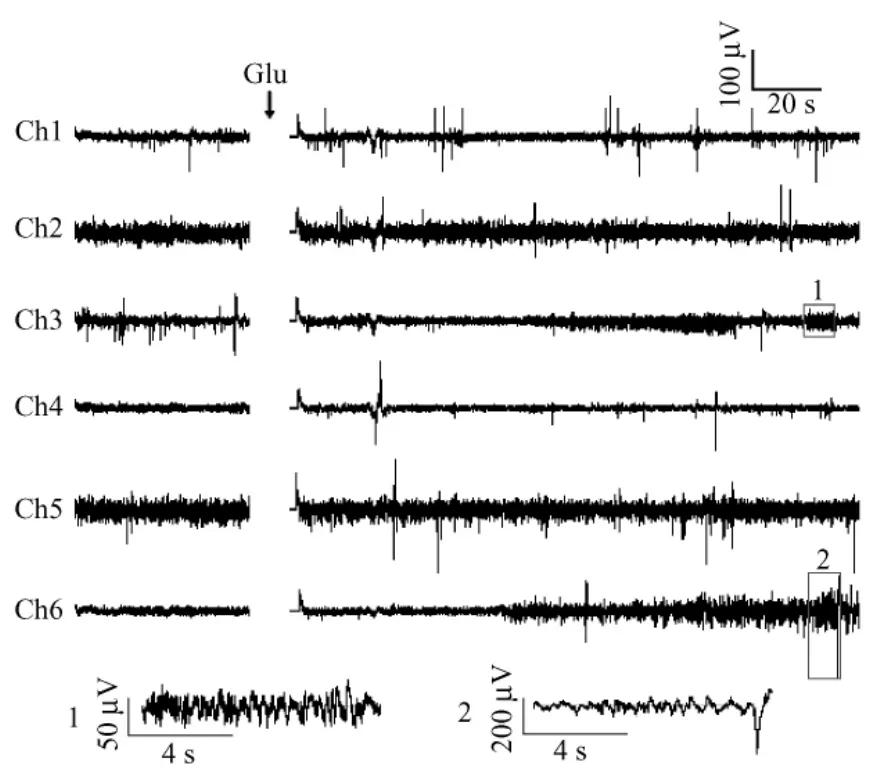
图3 Glu作用前后6个通道的嗅球神经元响应(底部为方框内信号的放大)Fig.3 Olfactory bulb neuron responses from 6 channels before and after using Glu(The signals at the bottom are the amplification of the signals in the frames)
为了更加直观地比较嗅球神经元在不同通道的发放情况,本研究利用Matlab软件对图3中的信号进行处理,得到对应的光栅图(见图4(a))和各通道神经元锋电位的平均发放率(见图4(b))。通过图4(a)可以清晰地了解每个通道信号的发放频率,并且可以判断锋电位和burst产生的时刻。由图4(a)可知,Glu作用后信号发放明显增加,并且在Ch1、Ch2和 Ch5时而出现比较密集的锋发放,在Ch3和Ch6会集中爆发锋电位。对各通道5 min内的锋电位个数进行统计,得到图4(b)所示的柱状图。自发信号的平均发放率最大可达0.5251/s(见Ch3),即每分钟发放约31.5次;Glu作用下发放率较大,最大达 1.1251/s,即每分钟发放约 67.5次。说明Glu的作用明显增强了嗅球神经元锋电位的发放,并促使了锋电位的爆发。图4(b)还显示,自发信号的发放率相对Glu作用下的偏低,而误差限相对偏大。该结果表明嗅球神经元的自发信号是随机产生的,没有一定的节律性;而200 μM Glu的作用一方面增强了嗅球神经元的电活动,另一方面对嗅球神经元的电活动具有一种调节的作用,使嗅球神经元锋电位的发放有一定的规律性。
本研究利用嗅球细胞网络传感器我们记录了不同通道的自发信号和Glu诱发的响应,并且比较分析了不同通道信号的特点、区别以及Glu对不同通道响应的影响。由于嗅球内含有多种类型的神经元细胞,并且不同类型的神经元表现出不同的生理功能[7,12]。因此,通过嗅球细胞网络传感器可以研究和探讨嗅球神经元网络中可能存在的响应模式和特征,以及嗅球神经元对嗅觉信息的处理功能和编码形式。比如,我们可以考察不同条件刺激下不同通道神经元的激活情况和响应强度,通过反复训练,找出神经元条件刺激下的响应规律,进而分析神经元的信息处理功能和嗅觉信息的编码方式。
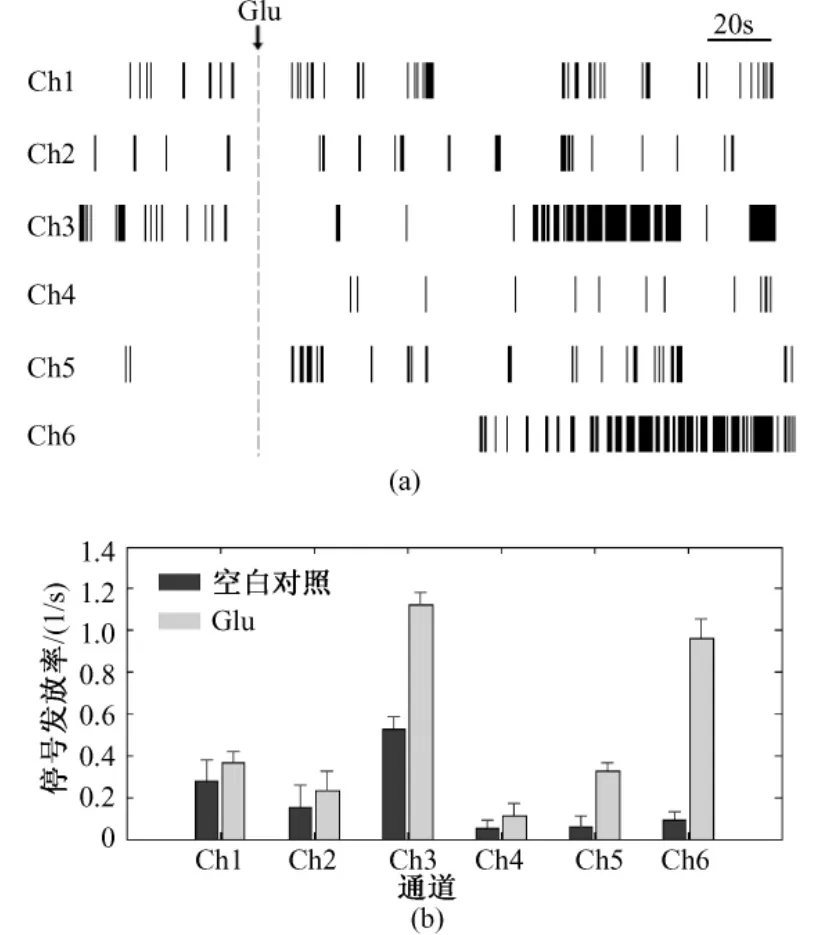
图4 图3中6通道信号的发放率分析。(a)光栅图;(b)神经元发放率统计分布图Fig.4 Firing rate analysis of signals from 6 channels in Fig.3.(a)raster plot;(b)firing rate distribution
由于受实验条件的限制,目前的研究还没有将神经元的类型与记录的信号一一对应。因此,在下一步的实验中,需要考虑电生理检测与免疫组织化学的结合,通过对嗅球神经元的特异性标记来分辨不同类型嗅球神经元的响应特点、模式和可能的信息处理功能。
3 结论
细胞形态观察和电生理的实验表明,利用细胞培养技术与MEA芯片结合,可以构造一种离体的嗅球细胞网络传感器。利用该细胞网络传感器能够对多点的嗅球神经元电生理活动实施同步监测与分析,可用于分辨不同条件下不同位置的神经元响应的区别。该研究对进一步分析嗅球神经元对嗅觉信息的处理与编码功能具有重要的意义。
目前,嗅球细胞网络传感器的研究处于起步阶段,还需要不断地改进和深入地研究。首先,通过微印章表面处理技术或改进MEA的微结构,引导细胞定向生长,进一步提高细胞网络传感器的检测效率和稳定性;利用荧光标记手段,辨别嗅球神经元的类型,便于电生理机制的探讨;与在体的实验结果进行比较分析,建立嗅球神经元网络模型。
[1]Gilbert AN, Firestein S. Dollars and scents: commercial opportunities in olfaction and taste[J].Nature Neuroscience,2002,5:1043-1045.
[2]Saar D, Grossman Y, Barkai E. Long-lasting cholinergic modulation underlies rule learning in rats[J].The Journal of Neuroscience,2001,21(4):1385-1392.
[3]Jonasson Z,Ballantyne JK,Baxter MG.Preserved anterograde and retrograde memory of rapidly acquired olfactory discrminations after neurotoxic hippocampal lesions[J].Hippocampus,2004,14(1):28-39.
[4]Kavaliers M,Choleris E,Colwell DD.Brief exposure to female odors“Emboldens” male mice by reducing predator-induced behavioral and hormonal responses[J]. Hormones and Behavior,2001,40(4):497-509.
[5]Shah NM.Nursing behavior:remembrance of things past[J].Current Biology,2006,16(19):R842-R844.
[6]Hurst JL, Beynon RJ. Scent wars: the chemobiology of competitive signallingin mice[J].BioEssays,2004,26(12):1288-1298.
[7]Sullivan SL,Dryer L.Information processing in mammalian olfactory system[J].Journal of Neurobiology,1996,30(1):20-36.
[8]Laurent G,Stopfer M,Friedrich R W,et al.Odor encoding as an active,dynamical process:experiments,computation,and theory[J].Annual Review of Neuroscience,2001,24(1):263-297.
[9]Lledo PM,Gheusi G,Vincent JD.Information processing in the mammalian olfactory system[J].Physiological Reviews,2005,85(1):281-317.
[10]Aroniadou-Anderjaska V,Ennis M,Shipley MT.Glomerular synaptic responses to olfactory nerve input in rat olfactory bulb slices[J].Neuroscience,1997,79(2):425-434.
[11]Kosaka K,Kosaka T.Organization of the main olfactory bulbs mammals:musk shrews,moles,hedgehogs,tree shrews,bats,mice,and rats[J].The Journal of Comparative Neurology,2004,472(1):1-12.
[12]Karnup SV,Hayar A,Shipley MT,et al.Spontaneous field potentials in the glomeruli of the olfactory bulb:the leading role of juxtaglomerular cells[J].Neuroscience,2006,142(1):203-221.
[13]Price JL,Powell TPS.Certain observations on the olfactory pathway[J].Journal of Anatomy,1971,110(Pt 1):105-126.
[14]Scott JW,Wellis DP,Riggott MJ,et al.Functional organization of the main olfactory bulb[J].Microscopy Research and Technique,1993,24(2):142-156.
[15]Lowe G.Electrical signaling in the olfactory bulb[J].Current Opinion in Neurobiology,2003,13(4):476-481.
[16]Isaacson JS,Strowbridge BW.Olfactory reciprocal synapses:dendritic signaling in the CNS[J].Neuron,1998,20(4):749-761.
[17]Gire DH,Schoppa NE.Control of on/off glomerular signaling by a local GABAergic microcircuit in the olfactory bulb[J].The Journal of Neuroscience,2009,29(43):13454-13464.
[18]Liu Qingjun,Cai Hua,Xu Ying,et al.Olfactory cell-based biosensor:a first step towards a neuronchip of bioelectronic nose[J].Biosensors and Bioelectronics,2006,22:318-322.
[19]Ennis M,Zhu M,Heinbockel T,et al.Olfactory nerve-evoked,metabotropic glutamate receptor-mediated synaptic responses in rat olfactory bulb mitral cells[J].Journal of Neurophysiology,2006,95:2233-2241.
[20]Yokoi M,Mori K,Nakanishi S.Refinement of odor molecule tuning by dendrodendritic synaptic inhibition in the olfactory bulb[J].PNAS,1995,92(8):3371-3375.
[21]Friedman D,Strowbridge BW.Both electrical and chemical synapses mediate fast network oscillations in the olfactory bulb[J].Journal of Neurophysiology,2003,89:2601-2610.
[22]Lagier S, Carleton A, Lledo PM. Interplay between local GABAergic interneurons and relay neurons generates gamma oscillations in the rat olfactory bulb[J]. The Journal of Neuroscience,2004,24(18):4382-4392.
[23]Schoppa NE.Synchronization of olfactory bulb mitral cells by precisely timed inhibitory inputs[J].Neuron,2006,49(2):271-283.
[24]Gire DH,Schoppa NE.Long-term enhancement of synchronized oscillations by adrenergic receptor activation in the olfactory bulb[J].Journal of Neurophysiology,2008,99:2021-2025.
