纳秒脉冲诱导肿瘤细胞缝隙连接通讯恢复的实验研究
2011-08-13姚陈果李成祥肖德友唐丽灵
姚陈果 郭 飞 李成祥 肖德友 唐丽灵
1(重庆大学输配电装备及系统安全与新技术国家重点实验室,重庆 400030)
2(重庆大学生物工程学院,重庆 400030)
引言
多细胞生物体内的正常细胞之间是相互连接、相互沟通的协同作用组织方式。细胞通讯,是指一个细胞发出的信息通过介质传递到另一个细胞产生相应反应的过程[1-3]。细胞通讯有 3种主要方式[4]:细胞间接触性依赖的通讯、化学通讯和细胞间缝隙连接通讯(gap junctional intercellular communication,GJIC),其中 GJIC是细胞间的直接通讯方式。GJIC由聚焦的通道组成[5-7],通道的直径约为3 nm,包括由相邻细胞提供的两个半通道,每个半通道(连接子)由属于连接蛋白基因家族的6个蛋白亚基组成,它的通道只允许分子量小于1×103的小分子通过,如无机盐、糖、氨基酸和维生素等,而核糖、多糖、蛋白质等大分子不能通过[8];间隙连接在代谢偶联、神经信号传输、早期胚胎发育和细胞分化中发挥了巨大的作用。细胞之间的间隙连接是凋亡信号的传输通道,能够促进细胞凋亡。与正常细胞相比,肿瘤细胞由于GJIC功能异常,所以无法产生接触抑制从而诱发凋亡[9-11]。因此,利用物理的手段恢复肿瘤细胞间隙连接,可以成为促进肿瘤细胞的凋亡的因素。
目前,电场脉冲对细胞结构和功能的影响与对生物体的治疗作用逐渐成为生物电磁技术领域的研究热点[12-13],它不仅为电气工程师、细胞生物学家和临床医师等通过强大而简洁的电场方式(类似于“探针”)研究细胞内外膜跨膜电位变化并调控生物细胞响应开辟了一条全新途径,而且也为纳秒脉冲靶向作用于细胞膜或线粒体跨膜电位从而诱导肿瘤细胞凋亡提供了可能,并展示出良好的发展前景。
长期以来,国内外同行专家们在此领域做了大量的实验和理论研究工作,取得了初步的成效和具有临床实用价值的结果。Schoenbach、Joshi等发现,不用化疗药物,采用场强为100 kV/cm左右、脉宽为10 ns级的纳秒脉冲,可以改变细胞器的跨膜电位,进而导致一系列被称为“内处理效应”(electromanipulation)的细胞反应[14-16];Nuccitelli等发现,脉宽为300 ns、场强为40 k V/cm的纳秒脉冲可以完全杀死实验鼠的皮肤瘤[17];Beebe等对纳秒脉冲诱导肿瘤细胞凋亡时的细胞膜跨膜电位变化和细胞色素C及caspase等的释放情况进行了研究[18-20];Weaver等认为,纳秒脉冲通过改变线粒体跨膜电位,进而促使线粒体的通透性转换孔不可逆开放,最终引发肿瘤细胞凋亡[21];Schoenbach等研究表明,不同脉宽的纳秒脉冲通过不同途径,诱导肿瘤细胞凋亡[22-23],Beebe进一步的研究揭示,300 ns的纳秒脉冲可以通过死亡受体途径,诱导肿瘤细胞凋亡[24]。国内的研究者对纳秒脉冲的生物电效应机制也开展了大量的研究工作,肖登明等和严萍等对纳秒脉冲的内处理效应进行了初步研究[25-26],重庆大学从2003年起,就对纳秒脉冲的生物电效应及其作用机理做了大量的研究[27-30],同时揭示了纳秒脉冲诱导肿瘤细胞凋亡的线粒体凋亡通路[31]。
虽然国内外众多学者对纳秒脉冲的生物电效应作用机制及其临床应用进行了大量的研究,但纳秒脉冲靶向诱导肿瘤细胞凋亡的机制尚不清楚,而肿瘤细胞的凋亡与其GJIC的功能变化密切相关,因此本课题对纳秒脉冲作用后肿瘤细胞的GJIC功能变化进行了研究,以期进一步深化纳秒脉冲诱导肿瘤细胞凋亡的机制研究,目前国内外尚无此方面的报道。
1 材料和方法
1.1 材料
实验用细胞系为人肝癌细胞株Hep-G2(购于中国科学院上海生物化学研究所)。以RPMI1640培养基(美国Hyclone公司)培养,培养液中含有10%标准胎牛血清(购于天津市灏洋生物制品科技有限责任公司)、100μg/mL青霉素(购于华北制药股份有限公司)、100μg/mL链霉素(购于华北制药股份有限公司),置于37℃,5%CO2饱和湿度的培养箱的常规培养。实验时,用 0.25%的胰蛋白酶和0.02%EDTA(美国 GIBCO公司)消化培养瓶内细胞,用RPMI1640培养液制成单细胞悬液,血球计数板计数,将1×105~1×106个细胞接种在自行设计的电极腔板里(见图1),培养24 h,用做实验。电极腔板以盖玻片作为底板,铂金片(宽40 mm×高10 mm×厚0.5 mm)作为电极,玻璃(宽5 mm×高10 mm×厚1 mm)作为另两面腔板。细胞悬液置于由上述三者所包围的20 mm×10 mm×5 mm的腔内,脉冲电场通过电极施加于细胞悬液。

图1 电极腔板(1—盖玻片,作为底板;2—铂金电极;3—玻璃)Fig.1 Electrode chamber(1—cover glass,as base plate;2—platinized electrodes;3—glass)
1.2 纳秒脉冲样机
样机为重庆大学输配电装备与系统安全及新技术国家重点实验室自行开发。样机参数:输出脉冲电压峰值可达5 k V,脉宽500 ns,频率为1 Hz。实验时用美国Tektronix TDS3032 B示波器,实时观察输出的脉冲波形,如图2所示。
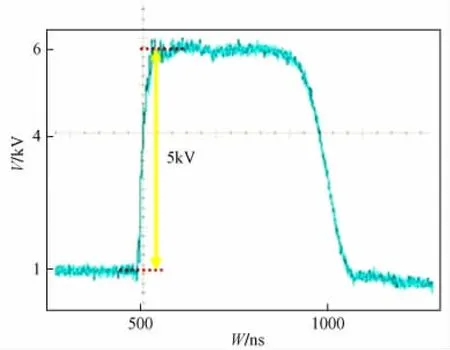
图2 脉冲电压波形Fig.2 sFull waveform of electric pulse
1.3 实验方法
1.3.1 纳秒脉冲处理
实验设置为3组:A组为对照组,不进行电刺激;B组和C组施加脉冲电场处理。实验分组及各组的详细纳秒脉冲电场参数如表1所示。所有实验重复至少3次,将细胞溶液置于电极腔板内,即可接受电刺激。
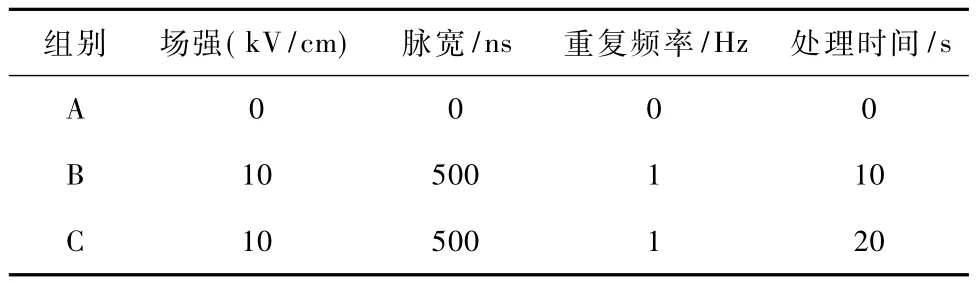
表1 纳秒脉冲电场参数Tab.1 Parameters of applied nsPEF
1.3.2 荧光漂白恢复(FRAP)技术
实验用荧光染料:5,6-羟基荧光素乙酸乙酰盐(5,6-CFDA),包括以下步骤。
步骤1:荧光负载细胞。培养好的细胞(腔板接种培养24 h,生长良好)经电刺激后,荧光染料孵育15 min,PBS清洗两次,去除环境残余,PBS浸润待用。
步骤2:测定荧光漂白恢复率。随机选择与周围其他细胞紧密相邻的细胞,荧光萃灭的激光能量强度为81%,漂白脉冲时间10 s,漂白后每5 s激光共聚焦扫描显微镜扫描摄像一次,获取扫描图像,得到漂白细胞荧光的恢复及相邻接触的未漂白细胞荧光的动态变化情况,数据用于曲线拟合。
步骤3:计算荧光漂白恢复率 Kt。Kt=(FF0)/(Fi-F0)[32]。其中,F为 t时刻萃灭细胞的荧光强度,F0为萃灭瞬间的荧光强度,Fi为萃灭前的荧光强度。
2 结果
2.1 纳秒脉冲处理后荧光强度的变化情况
在纳秒脉冲作用后,不同采样的细胞萃灭后荧光强度的变化情况如图3所示(纵坐标 If/a.u.表示荧光强度,萃灭前均为220左右,图中未显示)。对照组肿的瘤细胞萃灭后,荧光即刻降低,随着时间的推移,并未出现荧光恢复(见图3(a));脉冲处理组的B组和 C组,细胞萃灭后荧光即刻降低,且随着时间的推移,荧光强度出现上升,表明处理组肿瘤细胞间缝隙连接通讯得到恢复,与周围细胞进行物质交换。对比实验组B和C亦可发现,肿瘤细胞间缝隙连接通讯的恢复情况与电刺激时间(即施加脉冲个数)相关。
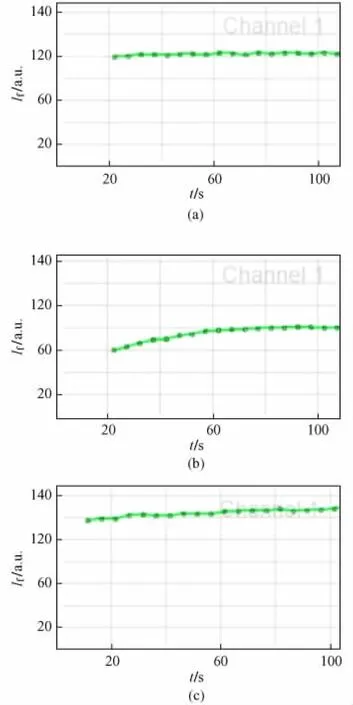
图3 不同采样的细胞萃灭后荧光强度的变化曲线。(a)对照组;(b)实验组B;(c)实验组CFig.3 Changes of fluorescence intensity before and after cancellation in tumor cells with different sampling.(a)Control group;(b)Group B;(c)Group C
2.2 纳秒脉冲处理后荧光漂白恢复率
为了更好地说明纳秒脉冲处理后肿瘤细胞间缝隙连接通讯的恢复情况,计算了Hep-G2细胞荧光漂白恢复率,结果如图4所示。与对照组相比,实验组B和C均表现出较高的荧光漂白恢复率,且C组荧光漂白恢复率明显高于B组。B组的荧光漂白恢复率随时间推移而增加,最后出现饱和。在有限的观察时间内,C组的荧光漂白恢复率一直增加,并未出现饱和。
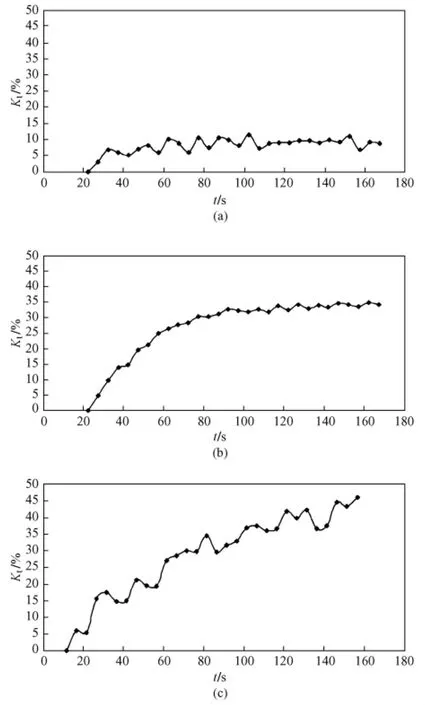
图4 Hep-G2D细胞荧光漂白恢复率。(a)对照组;(b)实验组B;(c)实验组CFig.4 Rate of fluorescence recovery after photobleaching in Hep-G2 cells.(a)Control group;(b)Group B;(c)Group C
3 讨论
Loewenstein和 Kanno在1966年首次发现GJIC的现象,Loewenstein及其同事随后发现恶变的成纤维细胞缺乏GJIC的功能。越来越多的实验结果[33]证明,几乎所有人类肿瘤都存在GJIC的缺失,而恢复GJIC可降低肿瘤形成的几率,可见GJIC与癌症的发生存在着必然的联系。因此人们认为,恢复肿瘤细胞间或肿瘤细胞和对应正常细胞间的GJIC功能,可能会使其表型正常化,并且推测在肿瘤的始发阶段防止GJIC的下调及在肿瘤发生后恢复 GJIC,是肿瘤预防与治疗潜在的靶点之一。首先,人们使用化学手段,诱导肿瘤细胞与正常细胞间恢复GJIC。一些抗癌物质(如维生素D、类胡萝卜素、类维生素A、cAMP)可以增强 GJIC,起到一定的肿瘤预防作用。化学手段诱导肿瘤细胞与正常细胞间恢复GJIC,可以在一定程度上抑制肿瘤增长及转移等,但不能清除肿瘤细胞,若应用于临床,需与化疗及周期特殊性抑癌药物联合使用[34]。随着连接蛋白基因的获得,人们将连接蛋白cDNA转入肿瘤细胞中,可使无GJIC的肿瘤细胞趋于正常化。但这种方法存在细胞选择性,难以消除肿瘤细胞。近年来的研究揭示,细胞之间的间隙连接是凋亡信号的传输通道,能够促进细胞凋亡;与正常细胞相比,肿瘤细胞由于GJIC功能异常,所以无法产生接触抑制,从而诱发凋亡。因此,利用物理的方法恢复肿瘤细胞间隙连接,可以成为促进肿瘤细胞凋亡的有效手段。而研究结果表明,纳秒脉冲可以有效促进肿瘤细胞GJIC的恢复,进而诱导肿瘤细胞凋亡,这与以往的纳秒脉冲生物电效应研究相符,也为纳秒脉冲用于GJIC障碍性疾病的治疗提供一条全新的途径。
纳秒脉冲独特的靶向诱导肿瘤细胞凋亡的生物电效应引起了国内外学者的广泛兴趣。研究者们从凋亡途径、量效关系、模型分析等角度对纳秒脉冲靶向诱导肿瘤细胞凋亡的机制进行了探讨。但由于研究角度的局限性,纳秒脉冲诱导肿瘤细胞凋亡的机制尚未完全揭示。以往的研究基于单细胞模型,从跨膜电位角度揭示纳秒脉冲诱导肿瘤细胞凋亡的机制[35]:当施加纳秒脉冲于细胞时,细胞膜或细胞器(线粒体、内质网等)膜的跨膜电位发生崩溃,进而从内源性或外源性凋亡途径诱导肿瘤细胞凋亡。上述研究从单细胞角度研究肿瘤细胞的凋亡,而未纳入多细胞生物体的细胞通讯研究,尤其是细胞间缝隙连接通讯(GJIC)在纳秒脉冲诱导肿瘤细胞凋亡中的作用。因此,从肿瘤细胞GJIC功能变化角度研究纳秒脉冲靶向诱导肿瘤细胞凋亡机制,不失为一个很好的方向。同时,本研究表明,纳秒脉冲可以有效地诱导肿瘤细胞GJIC的恢复,为纳秒脉冲诱导肿瘤细胞凋亡的机制研究提供一个全新的方向。
研究结果表明,纳秒脉冲可以促进肿瘤细胞GJIC功能的恢复,并且恢复的速率与施加的纳秒脉冲个数正相关,这在一定程度上揭示了纳秒脉冲靶向诱导肿瘤细胞凋亡与肿瘤细胞GJIC的恢复密切相关。上述研究不仅深化了纳秒脉冲诱导肿瘤细胞凋亡的机制研究,而且为GJIC障碍疾病提供了一个新的治疗途径。随着时间的推移,纳秒脉冲处理组荧光恢复率达到对照组的3倍以上,但具体两者如何联系起来以及关联程度如何却不得而知。同时,本研究采用的纳秒脉冲场强、脉宽等固定参数发生变化时,肿瘤细胞间GJIC的恢复状况是否发生改变以及如何改变,此外上述研究结果是否存在细胞特异性,当细胞状态及类型发生变化时又会是怎样的结果,这将是下一步研究工作的重点。
4 结论
将纳秒脉冲作用于人肝癌细胞(Hep-G2),通过荧光漂白恢复(FRAP)技术,检测荧光萃灭后肿瘤细胞的荧光强度变化情况。实验结果表明,纳秒脉冲作用可以促进肿瘤细胞 GJIC功能的恢复,且GJIC对纳秒脉冲作用的响应程度与施加的脉冲个数有关。
[1]White TW,Paul DL.Genetic diseases and gene knockouts reveal diverse connexin functions[J].Annual review of physiology,1999,61:283-310.
[2]Kelsell DP,Dunlop J,Hodgins MB.Human diseases:clues to cracking the connexin code[J].Trends in cell biology,2001,11(1):2-6.
[3]Willecke K, Eiberger J, Degen J, et al. Structural and functional diversity of connexin genes in the mouse and human genome[J].Biological chemistry,2002,383(5):725-737.
[4]King TJ, Fukushima LH, Hieber AD. Redued levels of connexin43 in cervical dysplasia:inducible expression in a cervical carcinoma cell line decreases neoplastic potential with implications for tumor progression [J].Carcinogenesis,2000,21(6):1097-1109.
[5]Lampe PD,Lau AF.The effects of connexin phosphorylation on gap junctional communication[J].The international journal of biochemistry& cell biology,2004,36(7):1171-1186.
[6]Lampe PD, Lau AF. Regulation of gap junctions by phosphorylation of connexins[J].Archives of biochemistry and biophysics,2000,384(2):205-215.
[7]Maeda S,Nakagawa S,Suga M,et al.Structure of the connexin 26 gap junction channel at 3.5 A resolution[J].Nature,2009,458(7238):597-602.
[8]Sehwarzmann G,Weingandt H,Rose A,et al.Diameter of the cell-to-cell junctional membrane channels as probed with neutral molecules[J].Science,1981,213(4507):551-553.
[9]Iho A,Katoh F,Kataoka TR,et al.A role for heterologous gap junctions between melanoma and endothelial cells in metastasis[J].J Clin Invest,2000,105(9):1189-1197.
[10]Yamasaki H,Krutovskikh V,Mesnil M,et al.Role of connexin(gap junction)genes in cell growth control and carcinogenesis[J].C R Acad Sci IlI,1999,322(2-3):151-159.
[11]Bruzzone R, White TW and Paul DL. Connections with connexins the molecular basis of direct intercellular signaling[J].Eur J Biochem,1996,238(1):1-27.
[12]Schoenbach KH,Hargrave B,Joshi RP,et al.Bioelectric effects of intense nanosecond pulse[J].IEEE Transactions on Dielectric and Electrical Insulation,2007,14(5):1088-1109.
[13]姚陈果,孙才新,米彦,等.陡脉冲不可逆性电击穿治疗肿瘤的研究[J].高电压技术,2007,33(2):7-13.
[14]Schoenbach KH,Katsuki S,Stark RH,et al.Bioelectrics-new applications for pulsed power technology [J]. IEEE Transactions on Plasma Science,2002,30(1):293-300.
[15]Schoenbach KH,Joshi RP.Ultrashort electrical pulses open a new gateway into biological cells[J].Proceedings of the IEEE,2004,92(7):1122-1137.
[16]Schoenbach KH,Nuccitelli R,Beebe SJ.ZAP:extreme voltage could be a surprisingly delicate tool in the fight against cancer[J].IEEE Spectrum,2006,43(8):20-26.
[17]Nuccitelli R,Pliquett U,Chen Xinhua,et al.Nanosecond pulsed electric fields cause melanomas to self-destruct[J].Biochem Biophys Res Commun,2006,343:351-360.
[18]Frey W,White JA,Price RO,et al.Plasma membrane voltage changes during nanosecond pulsed electric field exposure [J].Biophys J,2006,90:3608-3615.
[19]Beebe SJ,Blac km ore PF,White J,et al.Nanosecond pulsed electric fields modulate cell function through intracellular signal transduction mechanisms[J].Physiol Meas,2004,25:1077-1093.
[20]Beebe SJ,Fox PM,Rec LJ,et al.Nanosecond pulsed electric fields(nsPEF)effects on cells and tissues:Apoptosis induction and tumor growth inhibition [J].IEEE Trans Plasma Sci,2002,30:286-292.
[21]Weaver JC. Electroporation of biological membranes from multicellular to nano scales[J].IEEE Trans Dielectr Electr Insul,2003,10:754-768.
[22]Beebe SJ,Fox PM,Rec LJ,et al.Nanosecond,high-intensity pulsed electric fields induce apoptosis in human cells[J].The FASEB Journal,2003,17:1493-1495.
[23]Hall EH, Schoenbach KH, Beebe SJ. Nanosecond pulsed electric fields induce apoptosis in p53-wildtype and p53-null HCT116 colon carcinoma cells[J].Apoptosis,2007,12:1721-1731.
[24]Ren W, Beebe SJ. An apoptosis targeted stimulus with nanosecond pulsed electric fields(nsPEFs)in E4 squamous cell carcinoma[J].Apoptosis,2011,16:382-393.
[25]胥飞,肖登明.脉冲电场对细胞作用的模型分析和实验研究[J].高电压技术,2006,32(6):67-69.
[26]肖华娟,严萍,张适昌.纳秒脉冲细胞内电处理机理及其研究进展[J].高电压技术,2004,30(4):39-41.
[27]杨方黎,唐均英,米彦,等.纳秒级陡脉冲电场诱导人黑色素瘤细胞裸鼠皮下移植凋亡作用及机制[J].第四军医大学学报,2009,30(13):1227-1230.
[28]姚陈果,米彦,李成祥,等.纳秒级陡脉冲诱导癌细胞凋亡的实验及作用机理研究[J].中国生物医学工程学报,2008,27(5):739-744.
[29]吴晓娟,姚珍薇,唐均英,等.纳秒级陡脉冲对人卵巢癌细胞SKOV-3生长抑制及诱导凋亡作用[J].第三军医大学学报,2007,29(17):1670-1672.
[30]张仁民,姚陈果,陈新,等.ns级陡脉冲诱导肿瘤细胞凋亡的实验研究[J].高电压技术,2007,33(2):106-108.
[31]姚陈果,郭飞,王建,等.纳秒级电场脉冲诱导肿瘤细胞凋亡的线粒体通路研究[J].中国生物医学工程学报,2010,29(5):129-135.
[32]Eric AJR,Jacques JN.From fixed to FRAP:measuring protein mobility and activity in living cells[J].NATURE CELL BIOLOGY,2001,3:E145-E147.
[33]Trosko JE, Chang CC. Mechanism of up-regulated gap junctional intercellular communication during chemoprevention and chemo-therapy of cancer[J].Mutat Res,2001,480-481:219-229
[34]Timothy JK,John S.Bertram connexins as targets for cancer chemoprevention and chemotherapy[J].Biochim Biophys Acta,2005,1719(1-2):146-160.
[35]Schoenbach KH,Joshi RP,Beebe SJ,et al.A scaling law for membrane permeabilization with nanopulses[J]. IEEE Transactions on Dielectrics and Electrical Insulation,2009,16(5):1224-1235.
