下呼吸道感染革兰阴性杆菌AmpC酶的检测与耐药性分析
2011-08-13赵永新王伟秦静陈素洁张铁汉
赵永新 王伟 秦静 陈素洁 张铁汉
由于抗菌药物的广泛应用,细菌的耐药性越来越严重,特别是在医院感染中产AmpC酶的革兰阴性杆菌不断增多。为了解我院近年来产AmpC酶革兰阴性杆菌的分布及耐药性情况,我们用改良Hodge试验[1]对我院分离的978株革兰阴性杆菌进行产AmpC酶的检测,现报告如下。
1 材料与方法
1.1 菌株来源2008年1月至2010年12月,我院患者经一次性吸痰管从下呼吸道痰标本中分离出的革兰阴性杆菌978株。
1.2 试剂和仪器药敏纸片Oxoid公司;MH琼脂杭州天和微生物试剂公司产品;菌株鉴定试剂珠海迪尔生物工程有限公司。
1.3 方法
1.3.1 产AmpC酶菌株的初筛试验待测菌株用头孢西丁(FOX)检测,以抑菌环≤18 mm作为产AmpC酶的初筛试验。
1.3.2 改良Hodge试验将0.5麦氏单位大肠埃希菌(ATCC 25922)菌液均匀涂布于MH琼脂平板,在平板中央贴一FOX纸片,用接种环挑取2~3个过夜培养的待检菌落,并稍用力沿纸片边缘划向平板边缘,置35℃孵箱培养18 h,观察待检菌周围FOX抑菌圈的变化,如果抑菌圈变化≥2 mm,则提示产AmpC酶阳性。质控菌株:阴沟肠杆菌O29 m作为产AmpC酶的阳性质控菌株,大肠埃希菌ATCC25922作为阴性对照菌。
1.4 药敏试验采用K-B法测定,根据临床实验室标准化委员会CLSI 2009的标准判断药敏结果。质控菌为大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853。
2 结果
2.1 纸片扩散法初筛试验978株临床分离的革兰阴性杆菌中有456株初筛试验为AmpC酶阳性,阳性率46.63%。
2.2 改良Hodge试验确证试验456株初筛阳性的的细菌中263株阳性,阳性率为57.68%。
2.3 产AmpC酶革兰阴性杆菌的菌群分布从978株革兰阴性杆菌中共检出产酶株263株,阳性率为26.89%。263株产AmpC酶革兰阴性杆菌以大肠埃希菌(71株)、肺炎克雷伯菌(61株)、铜绿假单胞菌(50株)、阴沟肠杆菌(31株)、粘质沙雷菌(27株)、产酸克雷伯菌(23株)为主,分别占产酶株的27.0%、23.2%、19.0%、11.8%、10.3%、8.7%。
2.4 药敏结果产AmpC酶革兰阴性杆菌对21种抗菌药物的体外耐药率见表1。
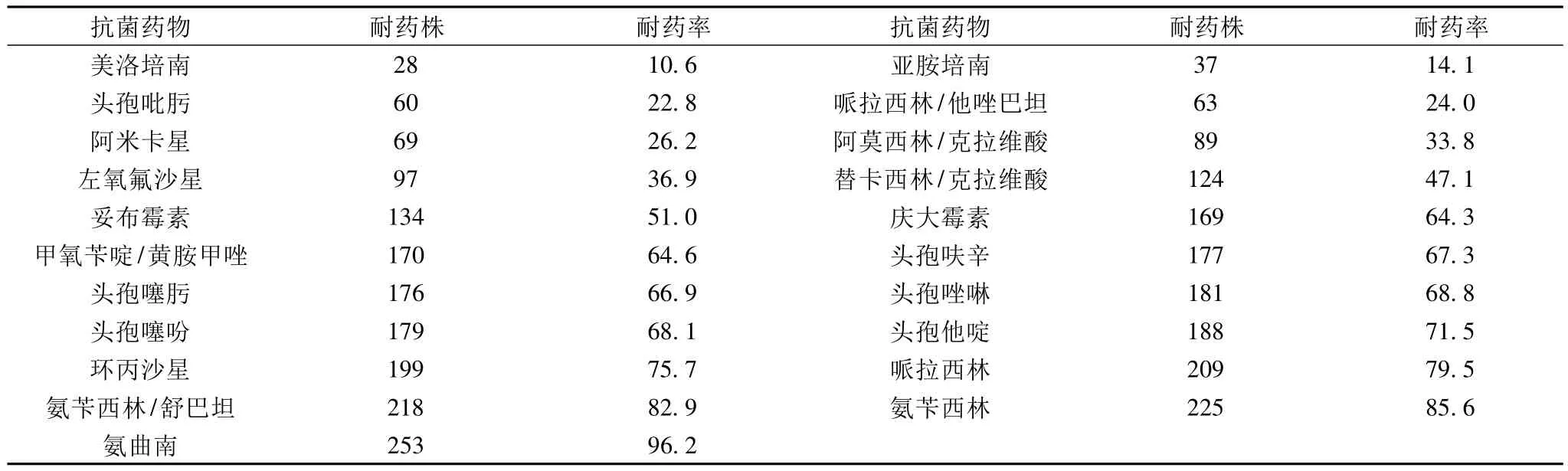
表1 263株产AmpC酶革兰阴性杆菌对21种抗菌药物的耐药率(%)
3 讨论
革兰阴性杆菌是目前医院感染中最常见的细菌之一,由于β-内酰胺类抗菌药物的过度使用,使得β-内酰胺酶介导的耐药情况越来越严重其耐药状况逐年加重[2],AmpC酶是目前被微生物学家关注的β-内酰胺酶之一,由于产持续高产AmpC酶的菌株增多,已造成临床抗感染治疗的困难。采用正确方法筛选出AmpC酶,并从药敏试验中识别其耐药机制,已成为临床微生物实验室研究的热点。
AmpC酶主要由革兰阴性杆菌的染色质或质粒编码产生。它是主要作用于头孢菌素类抗菌药物,且不被克拉维酸抑制的“丝氨酸”头孢菌素酶,特点是对头霉烯类抗菌药物高水平耐药[3]。舒巴坦、他唑巴坦等抑制剂对AmpC酶抑制作用较差,但本研究显示与抗菌药物联用时,哌拉西林耐药率79.5%,哌拉西林/他唑巴坦耐药率24.0%,氨苄西林耐药率85.6%,氨苄西林/舒巴坦耐药率82.9%。舒巴坦和他唑巴坦对AmpC酶呈现不同程度的抑制作用,可见加酶抑制剂与抗菌药物联用时,可以增强抗菌药物的杀菌作用,他唑巴坦的抗菌活性要远远强于舒巴坦。产AmpC酶菌株对碳青霉烯类耐药率在15%以下,这与碳青霉烯类抗生素如亚胺培南不被AmpC酶所水解有关。对青霉素一、二、三代头孢菌素类药物的耐药率在66%以上,说明AmpC酶能水解一、二、三代头孢菌素。四代头孢菌素耐药率22.8%,这与第四代头孢菌素较第三代头孢菌素具有更强的细胞膜穿透性,能快速通过细菌的外膜屏障,对AmpC酶的亲和力较低且具有更强的稳定性等特点有关。可见用于治疗AmpC酶细菌感染的有效药物主要是碳青霉烯类抗生素和四代头孢菌素。由该类耐药菌临床常规的药敏试验结果不能准确反应药物在体内的杀菌效力,根据常规药敏试验结果用药常常导致治疗失败。快速检测持续高产AmpC酶对临床合理用药起到至关重要的作用。改良Hodge试验检测AmpC酶快速、简便,因此符合率较高可以作为常规方法应用于临床AmpC酶的检测。我们用改良Hodge试验进行AmpC酶检测。结果中可以看出,我院产AmpC酶革兰阴性杆菌常以大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、阴沟肠杆菌、产酸克雷伯菌为主。
产AmpC酶的这些菌株可通过一些遗传学改变如:点突变、插入序列、片段缺失、转座子、整合子[4,5]等散播耐药基因,引起医院感染的暴发流行,给临床的诊治带来极大的威胁。因此临床应积极开展AmpC酶的检测工作,为临床合理使用抗菌药物提供实验依据。
[1]侯伟伟,蒋燕群.三种AmpC酶表型检测方法比较.检验医学,2010,25(2):122-125.
[2]涂婉,赵虎,方毅,等.持续高产型AmpC酶的产生与抗菌药物应用关系的研究.中华医院感染学杂志,2010,20(10):1351-1553.
[3]邵良荣,邵杰,缪宇锋,等.重症监护病房感染常见革兰阴性杆菌产AmpC酶、ESBLs及耐药性的研究.中华医院感染学杂志,2009,19(1):123.
[4]Verdet C,Benzerara Y.Emergence of DHA-1-producing Klebsiellaspp in the Parisian region:genetic organization of the ampC and ampR genes originating from Morganella morganii.Antimicrob A-gents Chemother,2006,50(2):607-617.
[5]Gonzlez Lpez JJ,Sabate M.Invivo reversion to the wildtye β-lactam resistance phenot-ype mediated by a plasmid carrying ampR and qnrA1 in Enterobacter cloacae.Ant imicrob Agents Chemother,2006,50(9):3175-3178.
