重症肌无力患者免疫治疗过程中sIL-6R的动态演变
2011-08-11刘汝宏丛志强钟孟飞王海萍陈晓辉
刘汝宏, 丛志强, 钟孟飞, 王海萍, 李 江, 陈晓辉
重症肌无力(MG)是T细胞依赖性的抗神经肌肉接头(NMJ)突触后膜上乙酰胆碱受体抗体(ACh-Rab)介导的自身免疫性疾病[1,2],而对 T 细胞的依赖性主要是通过免疫调节性细胞因子(CK)的调控实现的,许多证据表明,CK在MG发病和病情演变中起重要作用[2,3]。白细胞介素-6(IL-6)刺激静止的T细胞活化,诱导活化的B细胞终末分化,促进AChRab的产生,主要参与体液免疫应答的调节;可溶性白细胞介素6受体(sIL-6R)具有膜白细胞介素6受体(mIL-6R)的功能,不仅介导且能增强IL-6的生物学作用[4]。
本研究主要从体液免疫方面(sIL-6R、AChRab)对MG进行研究,在免疫治疗过程中,对两者进行动态同步检测,旨在揭示MG患者血清中两者含量的变化规律,探讨两者与MG发病及病情演变的相互关系、两者反映MG免疫治疗的效应状况、以及可能的治疗价值,从而为进一步阐明MG的免疫发病机制及为MG的免疫治疗提供依据。
1 资料和方法
1.1 资料
1.1.1 病例组(MG组) 所有研究对象系1999年3月~2010年12月间北京航天总医院神经内科、青岛大学医学院附属医院神经内科及山东省胜利油田中心医院神经内科门诊就诊和住院的患者。根据典型临床表现、疲劳试验和新斯的明试验阳性确诊。76例均为初诊患者或已停用免疫抑制剂6个月以上的复发者。其中男性37例、女性39例,年龄6 ~67(37.8 ±13.2)岁,病程最短15d,最长10年,平均1.9±0.34年。按改良的Osserman分类标准分为Ⅰ型20例、Ⅱa型19例、Ⅱb型13例、Ⅲ型11例、Ⅳ型13例。MG患者肌无力严重程度采用许氏绝对评分法[5]量化,并按首次取标本时的绝对评分分成轻(≤15分)、中(16~30分)、重(31~45分)、极重度(46~60分)4组。按纵隔CT检查结果分为胸腺正常组25例、胸腺增生组39例、胸腺瘤组12例。按所用免疫抑制剂不同分为单用类固醇组、及类固醇并用环磷酰胺组,类固醇的应用按我院神经内科常用的渐减法或渐增法,用2~3w后,若无效或加重,并用CTX(15mg/kg/次/w),免疫抑制剂治疗6w后留取标本,并同时对病情进行评分。
1.1.2 正常对照组(NC组) 系同期健康查体者,共48例,其中男性22例、女性26例,年龄12~69(34.2±16.1)岁。与病例组年龄、性别构成基本一致,两组年龄之间经t检验无明显差异(P>0.05)。所有研究对象均无自身免疫性疾病(除MG外)史,无肿瘤病史及肾脏病史,近期内无感染病史,6个月内未使用肾上腺皮质激素等影响免疫功能的药物。无高血压、糖尿病、溃疡病等类固醇激素的禁忌证。
1.2 方法
1.2.1 标本的采集 所有研究对象均在早晨7时~8时,采肘静脉血6ml,经离心分离血清,分装在3个冻存管内,-70℃保存待测。
1.2.2 血清sIL-6R含量的测定 sIL-6R试剂盆由深圳晶美生物用品公司提供美国Genzyme公司产品。原理:应用ELISA双抗体夹心法。抗人sIL-6R单抗包被于酶标板条上,结合标准品及标本中的sIL-6R,加入生物素化的抗人sIL-6R,加入酶联物显色,应用Σ960型酶标仪测其光密度值及sIL-6R浓度。
1.2.3 MG患者血清AChRab测定 试剂盒由上海太阳生物制品公司提供。采用ELISA法进行测定。
2 结果
2.1 MG组、NC组血清sIL-6R水平的比较MG患者血清 sIL-6R 水平(48.5±12.6ng/ml)明显高于健康对照组(38.2±11.3ng/ml),两者之间的差别具有高度显著性意义(P<0.01)。
2.2 MG患者不同临床类型血清sIL-6R水平MG患者不同性别间、不同年龄阶段间、以及在血清抗体阳性(SPMG)和抗体阴性(SNMG)组间血清sIL-6R水平的差别无显著性意义(P>0.05);病程>1年组患者血清sIL-6R水平明显高于病程<6个月组(P<0.05);Osserman分型Ⅲ型及Ⅳ型组患者血清sIL-6R水平均高于Ⅰ型组(P<0.05);胸腺增生组患者血清sIL-6R水平明显高于胸腺正常组(P<0.05)(见表1)。
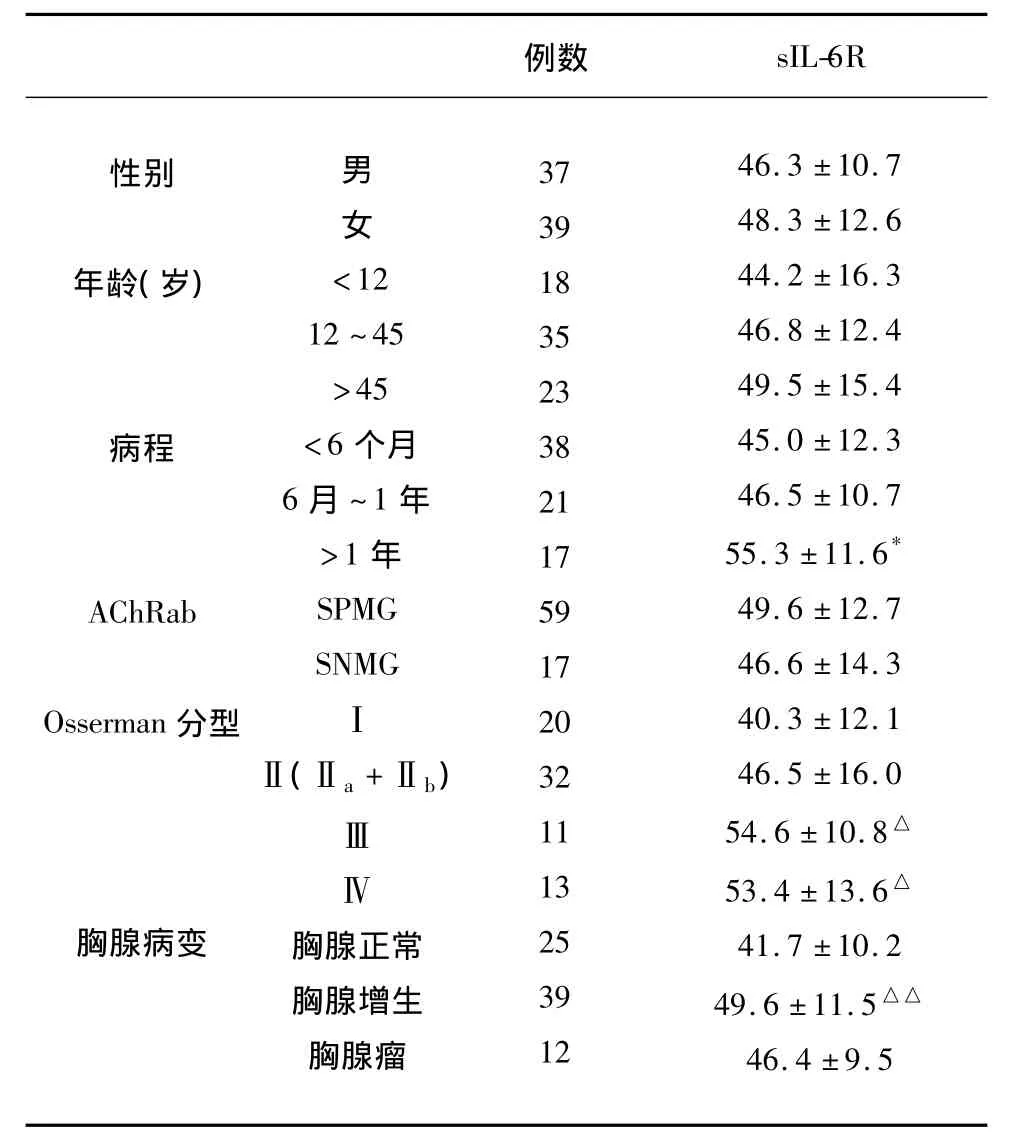
表1 MG患者不同临床组别清血sIL-6R(ng/ml)水平
2.3 MG患者免疫抑制治疗前后血清sIL-6R水平变化 在免疫抑制剂治疗前,极重组患者血清sIL-6R水平明显高于轻度组,两组间差别具有高度显著性意义(P<0.01),重度组患者血清sIL-6R水平明显高于轻度组患者(P<0.05);免疫抑制治疗6w后,轻、中度组患者评分明显低于治疗前评分,两者的差别具有高度显著性意义(P<0.01及P<0.02),上述两组患者血清sIL-6R水平在免疫抑制治疗后明显低于治疗前(P<0.05)(见表2)。
2.4 MG患者不同免疫抑制剂治疗组血清sIL-6R水平 单用皮质类固醇组(单用组)患者治疗6w后病情绝对评分低于治疗前评分(P<0.05),该组患者血清sIL-6R水平在治疗6w后明显低于治疗前水平(P<0.05);皮质类固醇+环磷酰胺(治疗时间为3~4w)组(并用组)在治疗前后评分及sIL-6R水平的差别无显著性意义(P>0.05)(见表3)。
2.5 不同病程MG患者免疫抑制治疗前后血清sIL-6R水平 病程<6月组患者血清sIL-6R水平在免疫抑制治疗6w后明显低于免疫治疗前,两者间差别具有显著性意义(P<0.05),余各病程组在免疫治疗前后各项水平的差别无显著性意义(P>0.05)(见表 4)。
2.6 MG患者病情与血清sIL-6R的关系 许氏绝对评分法是对MG患者肌无力严重程度的量化评定。对MG患者血清sIL-6R水平与绝对评分所得绝对计分值进行对数曲线回归检验,血清sIL-6R水平与MG患者病情明显相关(R2=0.513)。

表2 MG患者免疫治疗前后血清sIL-6R(ng/ml)水平

表3 MG患者不同免疫抑制剂治疗组血清sIL-6R(ng/ml)水平

表4 不同病程MG患者免疫抑制治疗前后血清sIL-6R(ng/ml)水平
3 讨论
近年来研究发现T细胞依赖机制在MG发病、发展过程中起重要作用,尤其是辅助性T细胞(Th)在调节AChRab的产生过程中作用更为突出[6~8],活化的 Th可以释放多种 CK,Th1主要分泌 IL-2、IFNγ、TNF;Th2 主要分泌 IL-4、IL-5、IL-6、IL-10、TNFα,这些CK通过旁分泌或自分泌途径,通过与相应受体结合,进一步使T、B细胞活化/分化、增殖,产生大量自身抗体(主要是AChRab)而致肌无力的产生[1,9]。sIL-6R 是由于蛋白酶的作用使 IL-6R 胞外区从细胞上脱落下来形成的,或在mRNA水平上缺失编码跨膜区的碱基对而只形成胞外区域形成的。sIL-6R缺失了IL-6R细胞内域和跨膜区,其结合并增强配基IL-6的作用与其它可溶性细胞因子受体(sCKR)不同,它非但不是mIL-6R的拮抗剂,反而是mIL-6R的激动剂,主要参与机体的体液免疫应答及免疫调节过程[4,7]。
Cohen-Kaminsky等[10]发现,MG 患者胸腺上皮细胞异常表达IL-6,其IL-6mRNA表达量及IL-6含量均显著增高,外源性信号如脂多糖(LPS)、IL-1、TNFα刺激能加强其表达。Matusevicius等[11]将MG患者外周血单个核细胞(MNC)与AChR短期培养,发现MNC IL-6mRNA表达水平较对照组显著升高。Bongioanni等[12]证实MG患者外周血Th细胞IL-6R数量较对照组显著增多,与IL-6结合的能力也增强,并认为Th细胞结合能力增强是由于Th细胞具有更多的IL-6R。这些均说明IL-6及IL-6R在MG发病中起促进作用。
sIL-6R主要参与机体体液免疫应答及免疫调节过程,有人研究自身免疫性疾病的典型动物模型MRL/Lpr小鼠时发现,随着小鼠的成长,血清中sIL-6R和IL-6水平显著升高,二者呈正相关[11]。本研究显示MG患者血清sIL-6R水平明显高于健康对照组(P <0.01),结合 Rapoport[13]等的研究,IL-6 系统参与了MG的发病,即IL-6刺激B细胞产生AChRab是MG发病环节之一,IL-6水平升高,机体“试图”通过负向调节IL-6R起到自我免疫保护作用,结果导致sIL-6R水平上升,由于sIL-6R的特殊性,sIL-6R不仅不能阻碍IL-6的免疫损伤,反而增强其作用,因此,在无其它因素影响下,IL-6/IL-6R/sIL-6R自分泌环是一恶性循环[14],sIL-6R水平升高本是机体免疫保护调节的结果,但却可能反映着免疫损伤的程度。从不同临床组别的比较研究中发现,病程1年以上的MG患者血清sIL-6R水平明显高于病程6个月以下者(P<0.05),后者经免疫抑制剂治疗6w后,血清sIL-6R水平明显下降,反应病程长者(>1年),sIL-6R水平高,免疫损伤程度重,免疫治疗效应比病程短者(<6月)差;在Osserman分型中可见,病程相对长的、病情相对重的Ⅲ、Ⅳ型患者血清sIL-6R水平更高,提示血清sIL-6R水平与MG病情可能相关;在本研究中,胸腺增生组血清IL-6R水平明显高于胸腺正常组(P<0.05),胸腺瘤组MG患者血清sIL-6R水平与胸腺正常组差别不明显(P>0.05),提示两者发病过程可能不同,胸腺增生的MG患者可能较胸腺瘤者的Th2细胞免疫功能紊乱明显[15],而IL-6主要由Th2细胞分泌,因此出现胸腺增生组患者sIL-6R水平更高的现象。经原位杂交和免疫组化研究发现[16],胸腺内增生小叶周围有高度表达的IL-6mRNA,在胸腺瘤患者中却未见到类似改变。
为了更明确MG患者病情与血清sIL-6R水平的关系,用MG患者病情许氏评分法计分结果与sIL-6R水平进行相关研究发现,绝对评分≥31患者血清sIL-6R水平高于轻度组患者(P<0.01或 P<0.05),且评分越高者-极重组与轻度组患者差别更明显(P<0.01),说明MG患者病情与血清 sIL-6R水平可能存在相关性,对两者进行对数曲线回归检验证实,两者明显相关,即MG患者病情越重,血清sIL-6R水平越高。研究同时提示病情较轻的患者(评分≤30)经免疫治疗后病情改善明显(P<0.05),而且,这些患者血清sIL-6R水平在治疗后也明显降低(P<0.05),这一方面对上述观点再次进行了证实,即同一患者在治疗过程中随着病情演变血清sIL-6R水平也相应变化,即病情与sIL-6R水平明显相关;同时为MG患者病情演变(疗效)的观察提供了一个监测指标;也提示MG患者体液免疫紊乱程度(或病情)与免疫治疗效应间可能存在相关性[13]。
sIL-6R的研究在MG临床治疗上具有潜在意义,通过构建sIL-6R的突变体,寻找到一种能与IL-6结合,但不能与gP130结合的分子,作为IL-6的拮抗物与 IL-6R 竞争结合 IL-6[11,14],应用于 IL-6 相关疾病(如MG)的治疗。
[1]Jung C,Stoeckle C,Wiesmuller KH,et al.Complementary strategies to elucidate T helper cell epitopes in myasthenia gravis[J].J Neuroimmunol,2008,41:201-202.
[2]Zhang XG,Navikas V,Link H.Cytokines and the pathogenesis of myasthenia gravis[J].Muscle Nerve,1997,20:543-548.
[3]Yi Q,Pirskanen R,Lerfvert AK,et al.Human muscle acetylcholine receptor reactive T and B lymphocyte in the peripheral blood of patients with myasthenia gravis[J].J Neuroimmunol,2003,53:205-212.
[4]Bemelmans MHA,Xiao BG,Bakhiet M,et al.Both interleukin-6 and its receptor in SCID mice[J].J Immunol,2004,161:3127-3131
[5]王秀云,许贤豪,孙 宏,等.重症肌无力病人的临床绝对评分法和相对评分法[J].中华神经科杂志,1997,30:87-90
[6]Milani M,Ostlie N,Wu H,et al.CD4+T and B cells cooperate in the immunoregulation of experimental autoimmune myasthenia gravis[J].J Neuroimmunol,2006,179(1 ~2):152-62.
[7]Aricha R,Feferman T,Fuchs S,et al.Ex vivo generated regulatory T cells modulate experimental autoimmune myasthenia gravis[J].J Immnnol,2008,180(4):2132-2139.
[8]国 红,孙 宏,许贤象,等.重症肌无力特异性细胞免疫应答[J].免疫学杂志,2000,16:114-118
[9]Hohlfeld R,Kalies I,Kohleisen B,et al.Myasthenia gravis:stimulation antireceptor autoantibodies by autoreactive T cell lines[J].Neurology,1996,47:629-631.
[10]Cohen-Kaminsky S,Comelie E,Anttzi W,et al.Interleukin-6 overproduction by culture thymic epithelial cells from patients with myasthenia gravis is potentially involved in thymic hyperplasia[J].Eur Cytokine Netw,2003,14:120-126.
[11]Matusevicius D,Navikas V,Link H,et al.TNFα,lymphotoxin,IL-6,IL-10 and perforin mRNA expression in mononuclear cells in response to acetylcholine receptor is augmented in myasthenia gravis[J].J Neuroimmunol,2007,82:191-198.
[12]Bongioanni P,Harcourt N,Linga S,et al.T-cell interleukin-6 receptor binding in patients with myasthenia gravis[J].J Neurol Sci,2009,169:215-221
[13]Rapoport B,Portolano S,Mclanchlan SM,et al.Combinatorial libraries:new insight into organ-specific autoantibodies[J].Immunol Today,2005,25:43.
[14]Lust JA,Novick D,Schooltink W,et al.The system of interleukin-6[J].Cytokine,1994,6:107-115.
[15]刘广志,许贤豪,侯世芳,等.重症肌无力患者胸腺及血清白细胞介素和干扰素-r分泌细胞的检测[J].中华神经科杂志,2000,33:339-341
[16]Utsugisawa K,Yamagata M,Saitho K,et al.In sistu expressions of IL-1β,IL-2,IL-6m RNA in thymus from patients with myasthenia gravis[J].J Clin Immunol,2004,21:267-276.
