Nogo基因和雌激素受体基因多态性与多发性硬化发病易感性的关系
2011-08-11杨昆胜肖建新叶荣苹黄智慧
李 晟, 刘 伟, 杨昆胜, 方 瑾, 肖建新, 叶荣苹, 黄智慧
多发性硬化(Multiple sclerosis,MS)是一种临床常见的以中枢神经系统白质脱髓鞘为主要病理特点的自身免疫性疾病。目前普遍认为,多发性硬化是环境和遗传共同作用的多基因遗传性疾病,其确切病因尚未完全查清。其中遗传因素在多发性硬化的发病中起十分重要的作用,本研究以多发性硬化患者和非多发性硬化对照组为研究对象,采用病例-对照研究方法,应用PCR技术对60例多发性硬化患者和120例非多发性硬化患者的Nogo(Neurite Outgrowth inhibitor)基因、雌激素受体(Estrogen receptor,ER)α基因2个基因3个位点的多态性进行了检测和分析。
1 对象与方法
1.1 对象 (1)多发性硬化组:患者系2007年3月~2010年3月本院及其他合作医院的门诊或住院患者,共60例,主要来源于浙江省,部分来源于云南省,男15例,女45例,均为汉族,年龄17~53岁,平均 (39.22±6.87)岁。病程1个月 ~25年,平均4.07年。全部病例入选标准按照 McDonald(2001)多发性硬化诊断标准。(2)正常对照组:来自本院门诊健康体检者,共120例,男38例,女82例,均为汉族,年龄18~55岁,平均(41.87±7.38)岁。性别和年龄与多发性硬化组匹配。两组均排除免疫性疾病、其它神经系统疾病、代谢性疾病、严重心血管疾病、肾病、糖尿病、肝病、肿瘤等。两组研究对象均为无血缘关系的散发人群,所有患者均充分了解研究方案并签署知情同意书。两组的性别、年龄差异无统计学意义(P>0.05),表明两组资料齐同,具有可比性。
1.2 方法
1.2.1 DNA提取 所有受检者均晨起抽取静脉血3ml,采用DNA试剂盒提取人类白细胞基因组DNA。将提取好的DNA置于-20℃冰箱保存备用。
1.2.2 试剂配制及来源 DNA提取试剂盒(上海华舜生物工程有限公司)。PCR所需试剂:Taq酶混合PCR试剂(北京天根生化),D2000分子量标准(北京天根生化)。Nogo基因引物采用Gregorio等文献中的引物[1]。上游引物为:5’-TCA ACA TGA AAT GCC ACA CAA-3’;下游引物为:5’-CAG TCA GTC TGT GCA ATG AAA-3’(引物由昆明晨绿生物技术有限公司合成)。雌激素受体α基因引物采用李薇等文献中的引物。上游引物:5’-CTG CCA CCC TAT CTG TAT CTT TTC CTA TTC TCC-3’;下游引物:5’-TCT TTC TCT GCC ACC CTG GCG TCG ATT ATC TGA-3’。凝胶电泳试剂:30%丙烯酰胺、10×TBE、5 ×TBE、过硫酸铵、TEMED(台湾生工),DNA Maker(北京天根生化),6 ×loading buffer(北京天根生化)。
1.2.3 Nogo基因PCR反应体系、反应条件及电泳分析 样本基因组DNA首先通过PCR扩增。PCR反应体系为:反应总体积为25μl,其中内含50ng基因组 DNA,Taq酶 PCR 混合试剂 12.5μl,引物(10pmol/L)上下游引物各 0.5μl,最后补充去离子水至终体积25μl。PCR反应:采用两步法,反应条件:94℃预变性5min→94℃变性45s→59℃退火及复性40s,共35个循环。PCR产物电泳分析:PCR产物经12%聚丙烯酰胺凝胶电泳,以5V/cm(1~8V/cm)的电压进行电泳。溴乙啶室温染色40min,水洗,UV灯下观察并照相。按照3种等位基因特异性片段的不同,在电泳图谱上鉴定Nogo基因3’端未编码区CAA插入/缺失突变不同的基因型。Nogo基因基因型:电泳图呈63bp(等位基因Ins,为CAA插入)或60bp(等位基因Del为CAA缺失)条带,有3种基因型,即Del/Del型、Ins/Del型、Ins/Ins型。
1.2.4 雌激素受体α基因PCR反应体系、反应条件及电泳分析 PCR反应体系为:反应总体积为30μl,其中内含100ng基因组 DNA,Taq酶 PCR混合试剂15μl,引物(10pmol/L)上下游引物各0.5 μl,最后补充去离子水至终体积30μl。因 PvuⅡ、XbaⅠ均位于ER-α的第1内含子上,且其Tm值接近,故两个基因多态性位点的扩增可采用同一引物,并可在同一条件下进行。PCR反应条件:94℃预变性5min→94℃变性50s→63℃退火及复性60s,共35个循环→末次延伸,72℃10min。PCR产物分别进行PvuⅡ和XbaⅠ限制性内切酶进行酶切,在电泳图谱上鉴定不同的基因型。ER-α基因基因型:PCR特异性扩增片段为1300bp,经琼脂糖凝胶电泳鉴定ER-α的PvuⅡ和Xba I基因多态性。ER-α基因使用PvuⅡ内切酶进行酶切反应可区分出3种基因型:即基因型(终产物为1300bp的单一条带),pp基因型(终产物为 1300bp、850bp、450bp的3条带),pp基因型(终产物为850bp、450bp的两条带);用Xba I内切酶进行酶切反应可区分出3种基因型:Xx基因型(终产物为1300bP的单一条带),Xx基因型(终产物为 1300bp、910bp、390bp 的 3 条带),xx基因型(终产物为910bp、390bp的两条带)。
1.3 统计分析 采用SPSS17.0软件分析等位基因和基因型频率与MS的关联性。以χ2检验比较基因突变在研究组与对照组之间的差异。检验水准:α=0.05。采用Logistic回归通过优势比及其95%可信区间(95%confidence interval,95%CI)分析各等位基因相对危险度。
2 结果
2.1 MS组和对照组Nogo基因多态性基因型频率和等位基因频率 结果显示经χ2检验基因型频率在两组间Nogo基因型分布差异无统计学意义=7.91,P=0.019 >0.05);MS 组和对照组 Del型等位基因频率分别为53.33%和36.67%,经χ2检验两组间等位基因在两组间分布差异有统计学意义(χb2=9.11,P=0.003 <0.01)(见表1)。
2.2 MS组和对照组雌激素受体α PvuⅡ基因多态性基因型频率和PvuⅡ等位基因频率 经χ2检验基因型频率在两组间PvuⅡ基因型分布差异有统计学意义(χa2=15.66,P=0.000 <0.01);MS 组和对照组 P型等位基因频率分别为49.17%和28.33%,经χ2检验两组间等位基因在两组间分布差异有统计学意义(χb2=15.21,P=0.001 <0.01)(见表2)。
2.3 MS组和对照组雌激素受体α XbaⅠ基因多态性基因型频率和XbaⅠ等位基因频率 结果显示经χ2检验基因型频率在两组间XbaⅠ基因型分布差异无统计学意义(χa2=4.43,P=0.109 >0.05);MS组和对照组X型等位基因频率分别为26.67%和20.00%,经χ2检验两组间等位基因在两组间分布差异无统计学意义(χb2=2.06,P=0.151 >0.05)(见表3)。
2.4 单因素分析 采用单因素非条件Logistic回归分析考查2个基因3个位点与MS发病的关系。在纳入多因素年龄、发病年龄、性别、饮酒史、吸烟史、家族史及2个基因3个位点的情况下,与MS发病相关的有2个因素,即Nogo基因 Del/Del型(OR 为 1.970,95%CI为 1.151 ~ 3.372;P=0.013)和 PvuⅡ基因 PP 型(OR 为 2.664,95%CI为1.412 ~5.024;P=0.002),都是多发性硬化的独立危险因素。其他基因位点的多态性及因素与多发性硬化发病无关(OR 为0.663~1.585;95%CI为0.364 ~3.006,均 P >0.05)。
2.5 多因素分析 将单因素分析筛选出的可能危险因素进一步进行多因素Logistic回归分析,采用似然比检验,通过后退法进行模型拟合,最终进入模型的因素有2个(见表4)。

表1 MS患者与对照组Nogo基因多态性基因型分布和等位基因频率分布
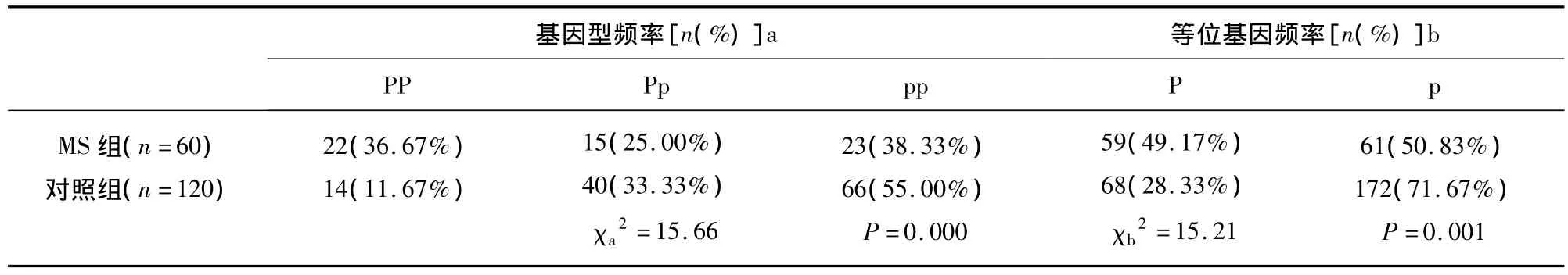
表2 MS患者与对照组雌激素受体PvuⅡ基因多态性基因型频率和PvuⅡ等位基因频率分布
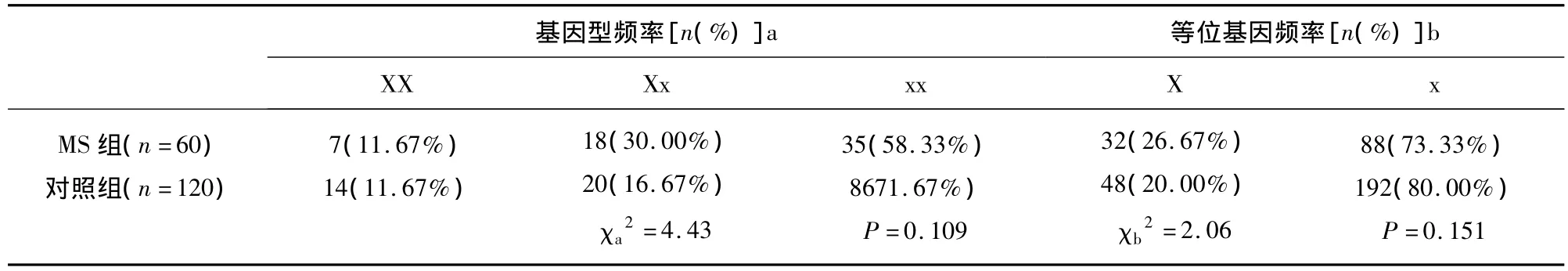
表3 MS患者与对照组雌激素受体XbaⅠ基因多态性基因型频率和XbaⅠ等位基因频率分布
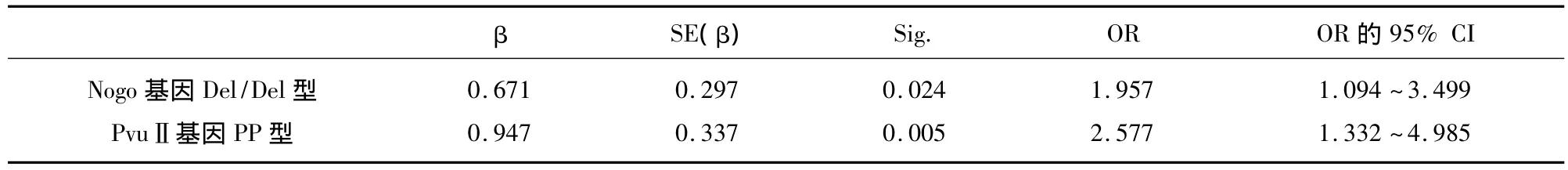
表4 MS易感基因多态性的多因素非条件logistic回归分析
3 讨论
多发性硬化是由环境与遗传等多因素共同作用所致,且目前认为多发性硬化是一种多基因疾病。迄今为止,关于多发性硬化的发病机制还远未阐明。大量流行病学调查和研究证明,遗传因素与多发性硬化发病密切相关。且国内外均有关于基因多态性与多发性硬化的研究,如国内崔玉真、肖波等[2,3]证实中国南方汉族人群CD24基因及ICOS基因多态性与MS相关,可能是MS的易感基因。本研究所涉及的基因为:Nogo基因和雌激素受体α基因。
Nogo基因定位于染色体2p12-14,长约75kb,包括14个外显子(外显子的长度从47bp到2400bp)及8个内显子(碱基长度19bp-37kb)。在bases 4386-4388有一段CAA序列结构,这个碱基片段的插入和缺失就形成了Nogo基因的两种等位基因型:插入型(Ins)和缺失型(Del)。通过MS组和对照组Nogo基因多态性分布比较,本研究结果提示Nogo基因多态性突变是多发性硬化发病的独立危险因素。推测其发生机制为当Nogo基因3’端未编码区有CAA序列插入时,即Ins型等位基因,在一定程度上降低了Nogo基因的转录速度,使Nogo-A蛋白产生减少。Del型等位基因中因为缺乏此序列,转录速度相对较高。故推测这两个等位基因(Ins/Del)有一定的协同作用。也有可能是Nogo基因中片段的插入序列本身改变了mRNA前体剪接步骤,导致不同的cDNA的拼接情况,插入片段的部分序列会保存在成熟的cDNA中,影响Nogo-cDNA稳定性,影响Nogo-A的产生。目前国内外对Nogo基因多态性相关的研究不多,Gregorio等[1]研究结果认为Nogo基因3’端未编码区CAA Ins/Del(插入/缺失)突变基因型与抑郁症发病无相关性。Zhou等[4]就Nogo基因3’未编码区TATC和CAA插入/缺失突变与扩张型心肌病的关系进行分析,研究发现TATC插入/缺失突变与扩张性心肌病有相关性。本研究前期小样本研究[5]证实Nogo基因与多发性硬化有相关性,但是国内外目前就Nogo基因多态性与多发性硬化的相关研究尚缺乏。
人类的ER基因定位于染色体6q24-27,总共有超过14万的碱基对,编码蛋白由595个氨基酸组成,包括8个外显子和7个内含子,相对分子量为66000人类ER基因已被研究证明有3种多态性,即PvuⅡ、Xba l和BstU I。本研究通过MS组和对照组雌激素受体α基因多态性分布比较,结果提示PvuⅡ基因是多发性硬化发病的独立危险因素。MS与ER基因多态性的关系国内外均进行了研究。Niino等[6]对日本人群的研究表明,PvuⅡ酶切多态性与MS的发生有关,而XbaⅠ酶切多态性与MS的发病年龄有关。而意大利的一项研究表明ER基因 PvuⅡ和XbaⅠ酶切多态性与MS的发病无关[7]。本研究结果与国内孙庆利[8]等对中国北方人群的研究结果相似,PvuⅡ酶切多态性与MS的发病有相关性,而XbaⅠ与疾病无关。这可能是由于不同种族间基因背景不同所致。ER的基因多态性在不同种族间的分布存在差异性,我国与日本人群的分布较为接近[9],而与瑞典、美国人群中分布差异较大[10,11]本文的结果与刘浩等人的报告相似。自身免疫性疾病有一种复杂的遗传模式,其中易感基因的相互作用时有发生。本实验未发现Xba I基因与MS患病有显著联系,表明Xba I基因在MS发病中与Nogo基因及PvuⅡ基因无联合作用。
综上所述,本研究多发性硬化组与正常对照组Nogo基因和ER基因的基因型及等位基因频率分布符合Handy-Weinberg平衡,达到遗传平衡,具有群体代表性。用logistic回归分析对多发性硬化3个基因位点以及临床资料进行分析,结果显示Nogo基因的等位基因频率和PvuⅡ基因的基因型及等位基因频率与MS患病的相关性,两基因位点可能与MS易感基因相关,但这一结论有待于更大样本的分析加以验证。MS患者多合并情感精神障碍及生活质量下降,且研究中发现多发性硬化患者的健康相关生活质量、抑郁焦虑障碍评分等与相关临床资料及基因型呈趋势相关,但因样本量仍较小,也有待更大样本的分析加以验证。
[1]Gregoório SP,Mury FB,Ojopi EB,et al.Nogo CAA 3’UTR insertion polymorphism is not associated with Schizophrenia nor with bipolar disorder[J].Schizophr Res,2005,75(1):5-9.
[2]崔玉珍,罗成宏,苏斌儒,等.ICOS基因多态性与中国南方汉族人群多发性硬化的相关性[J].中风与神经疾病杂志,2010,27(7):599-603.
[3]崔玉真,肖 波,罗成宏,等.CD24基因多态性与多发性硬化患病易感性研究[J].中风与神经疾病杂志,2006,23(2):155-157.
[4]Zhou B,Rao L,Li Y,et al.The association between dilated cardiomyopathy and RTN4 3'UTR insertion/deletion polymorphisms[J].Clin Chim Acta,2009,400(1 ~2):21-24.
[5]李 晟,刘 伟,肖建新,等.Nogo基因3'端未编码区CAA插入/缺失突变与多发性硬化发病关系[J/CD].中华临床医师杂志,电子版,2011,5(1):212-214.
[6]Niino M,Kiruchi S,Fukazama T,et al.Estrogen receptor gene polymorphism in Japanese patients with multiple sclerosis[J].J Neurol Sci,2000,179(1 ~2):70-75.
[7]Savettieri G,Cittadella R,Valentino P,et al.Lack of association between estrogen receptor 1 gene polymorphisma and multiple sclerosis in southern Italy in humans[J].Neurosci Lett,2002,327(2):115-118.
[8]孙庆利,谢汝萍,王荫华.雌激素受体基因多态性与多发性硬化[J].中国神经免疫学和神经病学杂志,2004,11(5):249-252.
[9]Ushiyama T,Ueyama H,Inoue K,et al.Estrogen receptor gene polymorphism and generalized osteoarthritis[J].J Rhenmatol,1998,25(1):134-137.
[10]Carling T,Rastad J,Kindmark A,et al.Estrogen receptor gene polymorphism in postmenopausal primary hyperparathyroidism[J].Surgery,1997,122(6):1101-1105.
[11]Hill SM,Fuqua SA,Chamness GC,et al.Estrogen receptor expression in human breast cancer-associated with an estrogen receptor restriction fragment length polymorphism[J].Cancer Res,1989,49(1):145-148.
