人参总皂苷和枸杞多糖的溶解特性与脂质体包封率的关系研究
2011-08-10郭伟英辽宁医学院药学院锦州市121001
郭伟英,吴 迪(辽宁医学院药学院,锦州市 121001)
人参总皂苷为人参的主要有效组分之一,是人参根的主要生理活性物质。人参总皂苷有抗皮肤衰老、改善记忆、抑制细胞凋亡、抑制肿瘤生长和降糖降脂等药理活性[1,2]。
枸杞属植物枸杞Lycium barbarumL.为多棘刺落叶小灌木,抗旱能力很强,其浆果枸杞子在《神农本草经》中引为上品。枸杞多糖对机体具有非特异性免疫调解功能[3],可调节机体免疫力,抑制肿瘤生长和细胞突变,延缓衰老,提高适应能力,并具有抗疲劳和加速消除疲劳作用[4]。
脂质体作为靶向给药的载体已被广泛研究。人参总皂苷和枸杞多糖制成脂质体有利于其药理活性及生物利用度的提高。在脂质体的制备中,影响包封率的因素有原料的种类和用量、制备方法以及药物性质等,其中药物性质中溶解特性最为重要,因为它决定药物是否适合制成脂质体。本研究在其他因素固定的条件下,制备2种不同性质的药物以期找出药物的溶解性质对脂质体包封率的影响,这方面在国内研究得较少。本研究可为人参总皂苷和枸杞多糖是否适合制成具有高包封率的脂质体提供试验数据,并为在试验前判断其他药物是否适合制备成脂质体提供参考依据。
1 仪器与试药
RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);JY96-I1型超声波细胞粉碎仪(宁波新芝科学仪器研究所);XS205DV型电子天平(瑞士梅特勒-托利多公司);UV-2450型紫外分光光度仪(日本岛津公司);G-50葡聚糖凝胶柱(上海保曼生物科技有限公司)。
人参皂苷Rbl对照品(中国药品生物制品检定所,批号:110704-200820);人参总皂苷原料药(辽宁鑫泰药业有限公司,人参总皂苷含量≥80%,批号:20081120);枸杞多糖原料药(西安易杨生物技术有限公司,批号:20080610);葡萄糖标准品(上海楚柏试验室有限公司,含量≥98%);大豆磷脂(上海金伴药业有限公司,批号:20080904);胆固醇(天津东方试剂厂);G-50葡聚糖凝胶(上海化学试剂厂);乙醇(天津市科密欧化学试剂有限公司);水为双蒸水,其他试剂均为分析纯。
2 方法与结果
2.1 药物基本理化性质的考察
2.1.1 溶解度的考察 按2010年版《中国药典》(二部)凡例项下规定操作,取药物适量,于(25±2)℃一定量溶剂中,每隔5 min强力振摇30 s,观察30 min内的溶解情况,在看不到溶质颗粒时,即认为已完全溶解。考察药物在常用溶剂水、甲醇、乙醇、氯仿、丙酮、乙醚中的溶解情况,详见表1。
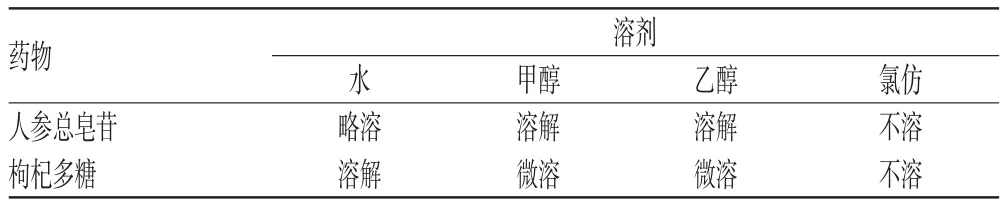
表1 药物在常用溶剂中的溶解情况Tab1 Dissolution of drugs in common solvents
2.1.2 油水分配系数(P)的测定 将溶有定量药物的饱和溶液和经水饱和过的正辛醇溶液各10 mL,装入三角瓶中,在一定强度下涡旋振荡24 h,静置15 min后两相分层,分离出水相,将水相以3 000 r·min-1离心10 min,用高效液相色谱(HPLC)法分别测定人参总皂苷和枸杞多糖浓度(CW)。将水相中原来药物浓度定为C0,则分配后油相中药物浓度为C0-CW,P=(C0-CW)/CW。结果,LogP人参总皂苷=0.45(正辛醇-水,n=3)、LogP枸杞多糖=0.98(正辛醇-水,n=3),表明人参总皂苷的P为0.45,枸杞多糖的P为0.98。
2.2 处方优化
选取对水溶性药物包封率影响较大的4个因素,即大豆磷脂与胆固醇重量比(A)、超声时间(B)、温度(C)、药液浓度(D)为考察对象。每个因素各取3个水平,用L9(34)正交表安排试验,每组重复3次。因素水平见表2。

表2 因素水平Tab2 Factors and levels
2.3 制备工艺
采用逆相蒸发法制备。按表1中的比例将大豆卵磷脂和胆固醇溶于氯仿后,转移到圆底烧瓶中;在不同温度下进行减压旋转蒸发,使瓶内壁形成一层脂质薄膜,加入6 mL乙醚薄膜溶解,再加入2 mL水相,超声乳化,置于旋转蒸发仪上旋转蒸发并负压抽吸至乙醚挥发尽,即得到脂质体悬液。人参总皂苷脂质体和枸杞多糖脂质体均按此法制备。
2.4 包封率的测定
2.4.1 标准曲线的制备 (1)人参总皂苷的标准曲线:精密称取已干燥至恒重的人参皂苷Rb1对照品6.4 mg,置于50 mL容量瓶中,将蒸馏水加至刻度,制成人参皂苷Rb1贮备液。分别从此贮备液中吸出6、7、8、9、10 mL,分别定容至10 mL。用紫外分光光度计于232 nm波长处,以蒸馏水为空白,测定各吸光度。以吸光度(A)为纵坐标,人参皂苷Rb1检测浓度(c)为横坐标,制备标准曲线,得回归方程为A=1.084 2c-0.050 1(r=0.986 6,n=5)。结果表明,人参总皂苷Rb1检测浓度在0.076 8~0.128 0 mg·mL-1范围内与吸光度呈良好的线性关系。(2)枸杞多糖的标准曲线:采用苯酚-浓硫酸显色法。精密称取已干燥至恒重的葡萄糖标准品50 mg,置于50 mL容量瓶中,加水至刻度。吸出0.5、1.0、1.5、2.0、2.5 mL,置于25 mL容量瓶中,加水至刻度,各取1 mL置于10 mL试管中,加5%苯酚1 mL,迅速加入5 mL浓硫酸,冷水浴冷却至室温;水同法为空白,在450~500 nm波长范围内测定吸光度。以吸光度(A)为纵坐标,枸杞多糖检测浓度(c)为横坐标,制备标准曲线,得回归方程为A=0.871 9c-0.012 1(r=0.998 8,n=5)。结果表明,枸杞多糖检测浓度在0.01~0.12 mg·mL-1范围内与吸光度呈良好的线性关系。
2.4.2 不同药物的脂质体紫外吸收结果 (1)取适量人参皂苷Rb1对照品、人参总皂苷脂质体和空白脂质体,将人参皂苷脂质体和空白脂质体用无水乙醇破乳后,在200~400 nm波长范围内进行光谱扫描。由波谱图可知,人参皂苷Rb1对照品、人参总皂苷脂质体在232 nm波长处均有吸收,故选择232 nm为检测波长。(2)取适量枸杞多糖标准品、枸杞多糖脂质体和空白脂质体,将枸杞多糖脂质体和空白脂质体用无水乙醇破乳后,在300~700 nm波长范围内进行光谱扫描。由波谱图可知,枸杞多糖标准品、枸杞多糖脂质体均在485 nm波长处有吸收,故选择485 nm为检测波长。
2.4.3 包封率的测定 取同批脂质体共2份,每份1 mL,一份置25 mL量瓶中,用乙醇破乳;另一份上G-50葡聚糖凝胶柱,流速为1 mg·min-1,收集洗脱液,将分离得到的脂质体置于25 mL量瓶中,用乙醇破乳,2份样品用乙醇定容。然后分别测定2份样品的吸光度,计算出药物总量(W总)和包进脂质体内的药物量(W包),按下式计算包封率:包封率(%)=W总/W包×100%。
2.5 正交试验结果
按表2中各因素水平进行试验,以包封率为评价指标,优选工艺。人参总皂苷脂质体的正交试验结果见表3;人参总皂苷脂质体的方差分析结果见表4;枸杞多糖脂质体的正交试验结果见表5;枸杞多糖脂质体的方差分析结果见表6。
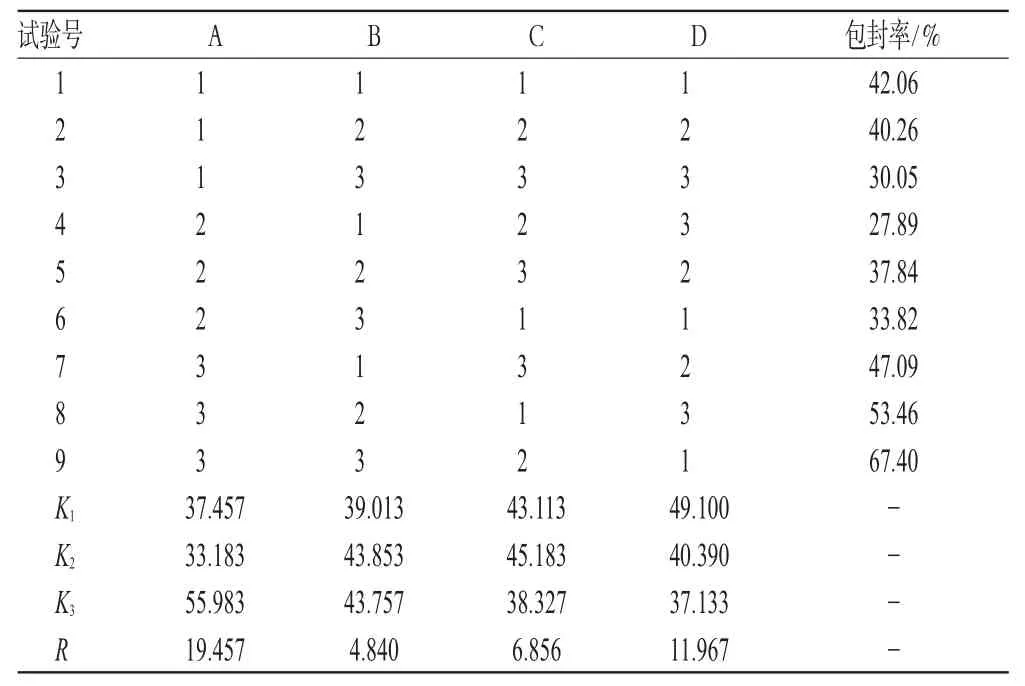
表3 人参总皂苷脂质体的正交试验结果Tab3 Results of orthogonal experiment of ginsenoside
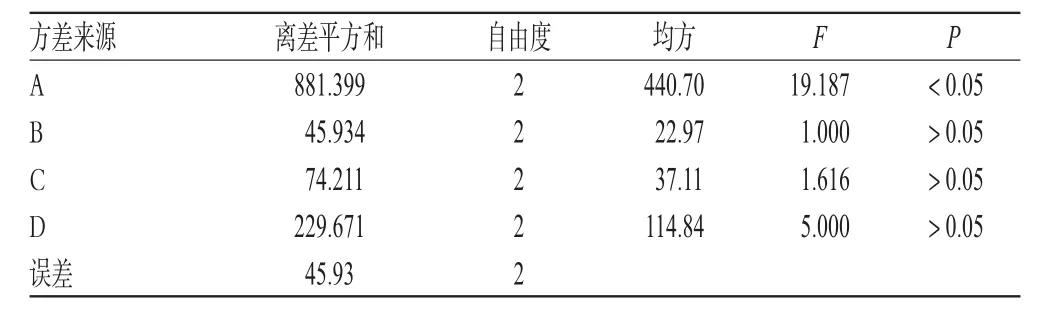
表4 人参总皂苷脂质体的方差分析结果Tab4 Analysis of variance of ginsenoside liposome
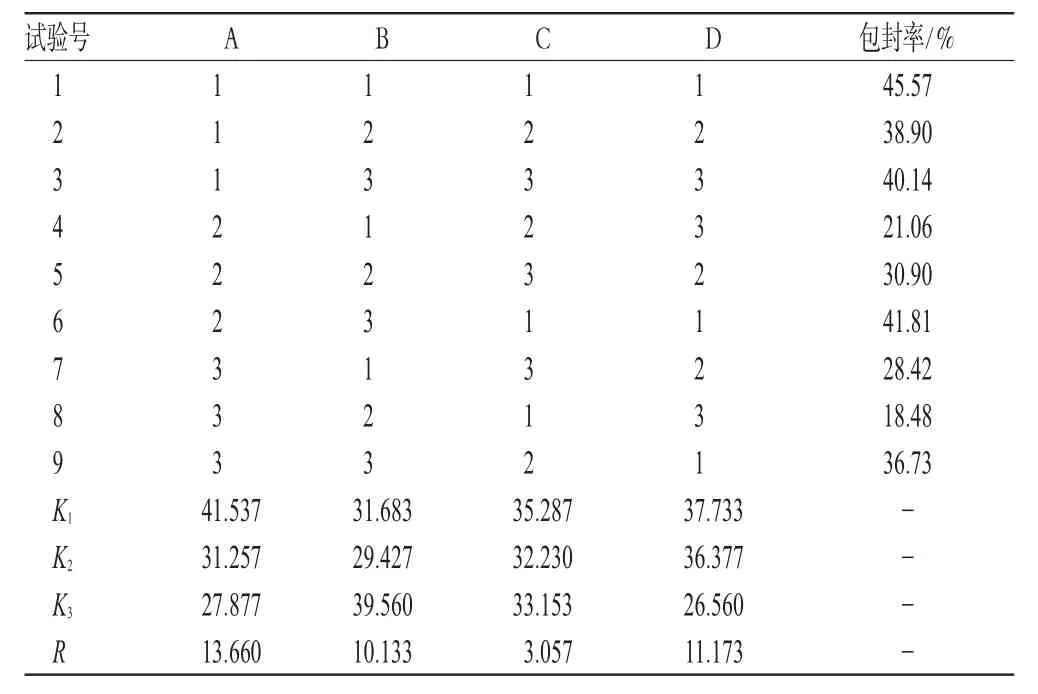
表5 枸杞多糖脂质体的正交试验结果Tab5 Results of orthogonal experiment of LBPliposome
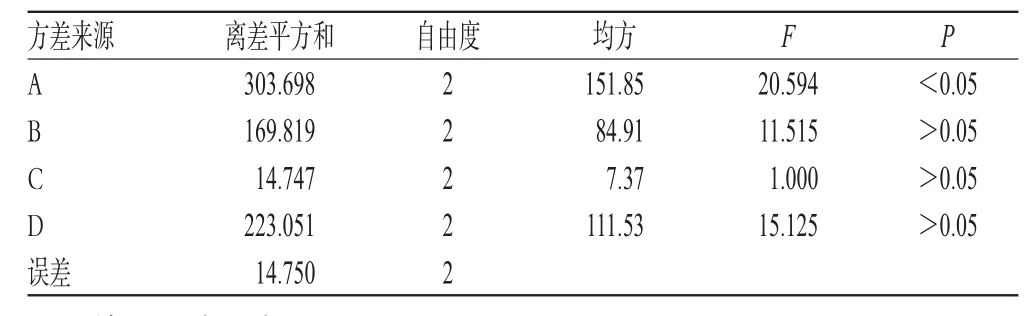
表6 枸杞多糖脂质体的方差分析结果Tab6 Analysis of variance of LBPliposome
由表3、表4可知,大豆磷脂与胆固醇重量比对人参总皂苷脂质体包封率的影响显著,其次是药液浓度、超声温度,反应时间影响较小;最优工艺为A3B2C2D1,即大豆磷脂与胆固醇重量比是1∶3,超声时间8 min,反应温度35℃,药液浓度6 g·L-1。
由表5、表6可知,大豆磷脂与胆固醇重量比对枸杞多糖脂质体包封率的影响显著,药液浓度、超声时间、反应温度影响较小;最优工艺为A1B3C1D1,即大豆磷脂与胆固醇重量比是1∶1,超声时间10 min,反应温度25 ℃,药液浓度6 g·L-1。
2.6 统计学分析
按优化的工艺分别制备3批人参总皂苷脂质体和枸杞多糖脂质体,按“2.4”项下方法测定包封率,结果见表7。
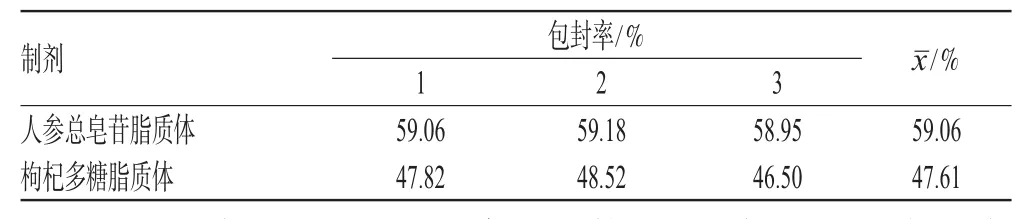
表7 包封率测定结果Tab7 Results of entrapment efficiency
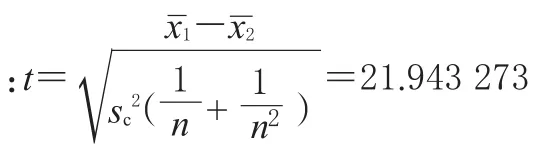
3 讨论
本研究是对制备脂质体条件的探讨,而人参总皂苷含量测定只是作为规律探索的一个中间指标,并不作为定量测定项,故只用了人参皂苷Rb1为对照测定含量。
本研究采用了相同的辅料和方法(经典的逆向蒸发法)制备2种药物的脂质体。结果,人参总皂苷脂质体包封率为59.06%,枸杞多糖脂质体包封率为47.61%,因此可知2种药物脂质体的包封率存在明显差异。由于2种药物的制备方法、试验试剂用品和实验室条件及人员等其他条件完全相同,因此这种差异是由药物本身性质引起的。首先人参总皂苷在水中略溶,在甲醇和乙醇中溶解,且在甲醇中的溶解度大于在乙醇中溶解度,人参总皂苷在水相和油相中均具有一定溶解度。枸杞多糖在甲醇和乙醇中微溶,溶解度比人参总皂苷低。溶解度对微粒载药量、包封率的影响显著,药物溶解度越高,其脂质体包封率就越高[5]。
文献报道[6],脂质体的包封率与该药物的P有密切关系。若脂溶性特别好或水溶性特别好,一般使用药物在正辛醇-水相中的LogP来表示这种性质,只有LogP>4.5的脂溶性药物或者LogP<0.3的水溶性药物才能包封成具有较高包封率且稳定的脂质体;而对于LogP具有中间值(0.3<LogP<4.5)的药物,即使包封脂质体后,药物也会迅速渗漏[7]。其原因是亲脂性或亲水性强的药物分布在脂质体的油相或水相,容易得到高的包封率;而两亲性的药物,由于在脂质体的油相和水相都有一定的溶解度,故容易穿膜而发生泄漏。人参总皂苷和枸杞多糖都属于两亲性药物,包封率都不高,然而人参总皂苷LogP更接近于临界值0.3,处于边界处,因此人参总皂苷脂质体的包封率比枸杞多糖脂质体的包封率略高。因而,药物的溶解性质对脂质体的包封率具有重要影响,而药物的其他性质对包封率的影响也值得进一步的研究。
[1]李泰平.人参皂苷药理活性的研究进展[J].生物学教学,2003,28(4):1.
[2]王红丽,吴 铁,吴志华,等.人参皂苷抗皮肤衰老作用试验研究[J].广东药学院学报,2003,19(1):26.
[3]张意静.食品分析[M].北京:中国轻工业出版社,2002:181-183.
[4]方建国,丁水平,田庚元.枸杞多糖药理作用与临床应用[J].医药导报,2004,23(7):484.
[5]吴俊珠,王成军,金 拓.赖诺普利微粒载药量与包封率影响因素研究[J].大理学院学报,2010,9(2):6.
[6]邓英杰,史淑芬,顾学裘.油酸多相脂质体(139)注射液包封率测定方法的研究[J].药学学报,1988,23(7):539.
[7]陈新梅,朱家壁.人参皂苷Rg1的溶解特性与脂质体包封率关系的研究[J].中国药房,2007,18(1):41.
