头风宁滴丸中菊花的精制工艺研究Δ
2011-08-10朱怡洁何伟伍振峰广东药学院药物研究所广东省药物新剂型重点实验室广州市510006江西中医学院现代中药制剂教育部重点实验室南昌市330004
朱怡洁,何伟,伍振峰(1.广东药学院药物研究所/广东省药物新剂型重点实验室,广州市510006;.江西中医学院现代中药制剂教育部重点实验室,南昌市 330004)
头风宁滴丸处方由菊花、川芎、白芷等药味组成,具有平肝活血、通络止痛之功效,用于治疗偏头痛肝风挟瘀证。菊花为方中君药,取其药性升浮、轻清、清香之气,升发清阳直达颠顶,使浊气自降而头痛自解[1]。原方以煎剂为用,后根据临床用药的特点和药物理化性质、药理作用,研制成滴丸,由于滴丸载药量较小,须对处方药物进行提取纯化后方能成型。菊花中主要成分为绿原酸、黄酮类和挥发油等化合物[2]。本试验以绿原酸比吸附量、洗脱率为评价指标,采用大孔吸附树脂对菊花提取液进行精制,考察了树脂种类、上样量、上样浓度、洗脱溶剂种类与用量等精制工艺参数。
1 仪器与试药
ultimate 3000高效液相色谱(HPLC)仪(美国Dionex公司);AB-8、X-5、NKA-9型大孔树脂(天津南开大学化工厂);HPD100、HPD400、HPD600、HPD200A、D101型大孔树脂(沧州宝恩吸附材料科技有限公司)。
菊花购自广州致信药业有限公司,经广东药学院生药学教研室刘基柱副教授鉴定为菊科植物菊ChrysanthemummorifaliumRamat.的干燥头状花序;绿原酸对照品(中国药品生物制品检定所,批号:0753-200111);甲醇、乙腈为色谱纯,水为屈臣氏蒸馏水,其他试剂均为分析纯。
2 方法与结果
2.1 绿原酸含量测定
2.1.1 对照品溶液的制备 精密称取绿原酸对照品0.010 06 g,置10 mL量瓶中,加乙醇溶解并定容,作为对照品贮备液。吸取对照品贮备液1 mL,置10 mL量瓶中,加乙醇溶解并定容,制成每1 mL含绿原酸0.100 6 mg的溶液,作为对照品溶液。
2.1.2 供试品溶液的制备 精密吸取样品溶液20 mL,水浴蒸干,残渣加50%乙醇使溶解,并定容至10 mL量瓶中,作为供试品溶液。
2.1.3 色谱条件色谱柱:DIONEXAcclaim 120 C18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.4%磷酸溶液(12∶88);检测波长:328 nm;流速:1.0 mL·min-1。在此条件下,供试品中绿原酸与其他组分峰能达到基线分离,保留时间为8.3 min。
2.1.4 标准曲线的制备 分别精密吸取对照品溶液1、3、5、10、15、20 μL,注入液相色谱仪中,测定绿原酸色谱峰面积。以绿原酸峰面积积分值(Y)为纵坐标,进样量(X)为横坐标,进行线性回归,得回归方程为Y=46.282 7X+0.892 8(r=0.999 9)。结果表明,绿原酸进样量在0.100 6~2.012 μg范围内与峰面积积分值呈良好线性关系。
2.1.5 含量测定 分别吸取对照品溶液、供试品溶液各10 μL,注入液相色谱仪中,照“2.1.3”项下色谱条件测定绿原酸色谱峰面积,计算绿原酸含量。
2.2 大孔吸附树脂精制工艺考察
2.2.1 样品溶液的制备 取菊花药材150 g,加8倍量水回流提取3次,每次1 h,合并提取液,滤过,减压回收,离心处理(5 000 r·min-1)20 min,定容至1 000 mL,作为样品溶液(每1 g生药含绿原酸2.244 mg)。
2.2.2 树脂种类的筛选 以绿原酸比吸附量、洗脱率为指标,对HPD100、HPD200A、HPD400、D101、X-5、HPD600、NKA-9、AB-8型大孔吸附树脂进行选择。
分别量取处理后的各型大孔吸附树脂各10 mL,湿法装柱(内径1 cm,长10 cm,下述装柱条件均与此相同),水洗至无醇味。取样品溶液200 mL上柱,使其超载,用水90 mL洗至流出液近无色,流出液定容至100 mL,作为样品溶液Ⅰ。再用70%乙醇90 mL洗脱,洗脱液定容至100 mL,作为样品溶液Ⅱ。分别吸取样品溶液Ⅰ、Ⅱ,按“2.1.2”项下方法制备供试品溶液,照“2.1.5”项下方法测定绿原酸含量,按下式计算绿原酸比吸附量、洗脱率:比吸附量=(上柱前药液中总量-吸附残液中含量)(mg)/树脂体积(mL);洗脱率=醇洗脱液中含量/(上柱前药液中总量-吸附残液中含量)×100%。结果,HPD600型大孔吸附树脂比吸附量为2.86 mg/mL树脂,洗脱率为90.5%,均高于其他树脂,故选择HPD600型大孔吸附树脂。树脂优选比吸附量、洗脱率结果见表1。
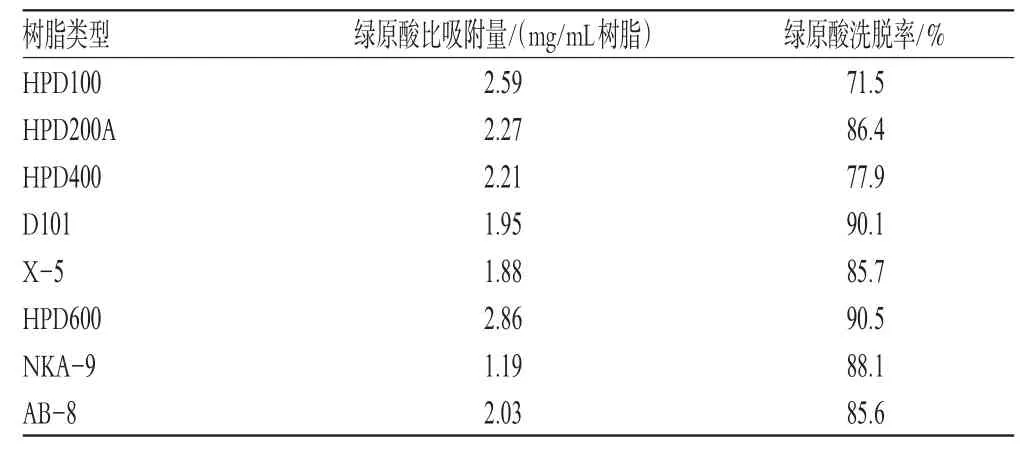
表1 树脂优选比吸附量、洗脱率结果Tab1 Adsorption quantity and elution rate of chlorogenic acid with different macroporous adsorption resin
2.2.3 大孔吸附树脂吸附条件考察 (1)泄露曲线考察:精密量取样品溶液100 mL,通过大孔吸附树脂柱,水洗至近无色,分段收集流出液,每次10 mL,按“2.1.2”项下方法制备供试品溶液Ⅰ~Ⅹ,照“2.1.5”项下方法测定绿原酸色谱峰面积,计算绿原酸含量,以供试品编号为横坐标,绿原酸质量(mg)为纵坐标,绘制泄漏曲线(见图1)。结果显示,当通过树脂柱的样品溶液达80 mL时,大孔吸附树脂对绿原酸的吸附基本达到饱和。为使绿原酸保留完全,以80 mL作为最大上样量,即为1.2 g(生药)/mL树脂。(2)样品溶液浓度考察:精密量取样品溶液适量,分别调节其浓度以菊花药材计0.15、0.075、0.037 5 g·mL-1,各精密量取100、200、400 mL通过大孔吸附树脂柱,水洗至流出液近无色,收集流出液,定容,作为样品溶液Ⅰ-1、Ⅰ-2、Ⅰ-3;继以70%乙醇100 mL洗至洗脱液近无色,收集洗脱液,定容,作为样品溶液Ⅱ-1、Ⅱ-2、Ⅱ-3。分别取上述样品溶液,按“2.1.2”项下方法制备供试品溶液,照“2.1.5”项下方法测定绿原酸色谱峰面积,计算绿原酸含量、比吸附量和洗脱率。结果,上样浓度为0.075 mg·mL-1时,比吸附量和洗脱率最高。样品溶液浓度考察结果见表2。
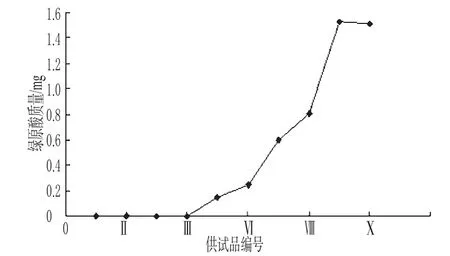
图1 绿原酸泄漏曲线Fig1 Leaking curve of chlorogenic acid
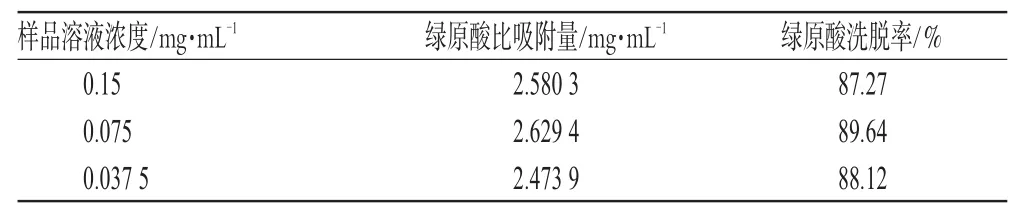
表2 样品溶液浓度考察结果Tab2 The investigation result of the concentration of physic liquor
2.2.4 大孔吸附树脂洗脱条件考察 (1)洗脱剂浓度选择:精密量取0.075 mg·mL-1样品溶液80 mL通过树脂柱,水洗至近无色,分别以2倍柱体积的30%、50%、70%、90%乙醇洗脱同一树脂柱,收集洗脱液,每20 mL为1份,按“2.1.2”项下方法制备供试品溶液,照“2.1.5”项下方法测定绿原酸色谱峰面积,计算绿原酸含量。结果,70%乙醇洗脱效果较佳,可洗脱99%以上的绿原酸,故确定以70%乙醇为洗脱剂。(2)洗脱剂用量考察:按上述优选条件,精密量取样品溶液通过树脂柱,水洗至近无色,用70%乙醇洗脱,洗脱液以20 mL为单位收集,按“2.1.2”项下方法制备供试品溶液,照“2.1.5”项下方法测定测定绿原酸含量。结果,4倍树脂体积的洗脱剂洗脱率可达97%以上,故洗脱剂用量确定为4倍树脂体积。
经以上试验确定,大孔树脂精制工艺条件为菊花提取液离心预处理(5 000 r·min-1)20 min后的药液作为样品溶液,调节样品溶液浓度为0.075 g·mL-1(以菊花药材计),最大上样量为1.2 g(生药)/mL树脂,通过HPD600型大孔吸附树脂,水洗至流出液近无色,继以70%乙醇4倍树脂体积洗脱,收集洗脱液。
以优选工艺条件进行中试放大试验,大孔吸附树脂精制后10批样品中绿原酸的平均洗脱率为86.85%,证实所选工艺合理可行。
3 讨论
由于提取液中所含杂质会阻塞大孔吸附树脂,降低其吸附作用,故在过柱前要进行药液的预处理。笔者考察了滤过法、离心法(5 000 r·min-1,20 min)和醇沉法(ρ=1.05,醇浓度50%),结果显示,离心法绿原酸损失最小,药液澄明度好,故选择离心法进行药液预处理。
试验中还考察了药液pH值和盐浓度对绿原酸比吸附量和洗脱率的影响。结果显示,在一定pH范围内,不同pH样品溶液的比吸附量、洗脱率没有明显差异;其比吸附量、洗脱率随盐浓度的增加而减少,故选择原液上样。
大孔吸附树脂纯化效果受树脂结构、吸附或洗脱条件及被分离物质结构等因素的影响,树脂纯化中可能发生活性成分的质与量的变化。因此,笔者分析比较了大孔吸附树脂纯化前后提取物的HPLC图谱,并通过分析各组分峰的紫外吸收曲线考察纯化效果。结果显示,树脂纯化前后图谱中相关活性成分峰的紫外吸收行为一致。
综上所述,优选工艺似能较好地纯化富集绿原酸,达到“去粗存精”的纯化效果。
[1]吴凡伟,叶春燕.加味散偏汤联合酚咖片治疗偏头痛30例[J].吉林中医药,2010,30(6):495.
[2]于红宇,李艳卿,陈历雄.杭白菊药液大孔树脂精制工艺研究[J].中药材,2009,32(7):1 125.
