重金属铬胁迫对土壤微生物数量及酶活性的影响1)
2011-08-09魏远
魏 远
(中国林业科学研究院林业研究所,北京,100091)
郑施雯 朱建林 江泽平 陈 江
(宁波市环境保护科学研究设计院) (宁波大学) (中国林业科学研究院林业研究所) (宁波大学)
当今,随着现代工农业的迅速发展,“三废”排放的日益增加,环境问题日趋严重,特别是重金属污染已引起国内外专家的极大关注。我国是世界皮革的加工中心和制革大国,制革行业每年约产生140万t皮革废弃物,其大部分被随意丢弃,其中所含的重金属Cr对土壤环境造成了严重污染[1]。重金属Cr具有易积累、难排除的特性,不仅危害土壤质量、地下水安全、作物产量品质,而且会随着食物链潜在威胁人畜健康。微生物本身仅占土壤有机质的很小部分,但土壤微生物在C、N、S和其他元素循环中起着关键作用[2]。土壤微生物功能群的研究意义不仅关系到农业生产,而且关系到环境污染治理和恢复生态学领域[3-4]。土壤中一切生物化学过程都离不开土壤中各类酶的参与,同时土壤酶活性是衡量土壤生物学活性和土壤生产力的重要指标[5],其活性的大小能反映土壤的潜在肥力水平,可较敏感地反映土壤中生化反应的方向和深度,是探讨重金属污染生态效应的有效指标之一[6],在重金属生态毒理、污染监测评价及修复等方面研究中,土壤酶是国内外关注的主要课题之一。近年来,国内外相关研究先后提出了脲酶、转化酶、过氧化氢酶等重金属污染指标[7-8]。目前,关于重金属Cr对土壤微生物及酶的影响报道不多,但关于工业产生的一些含Cr废水对土壤微生物及酶的影响却鲜见报道[9-13],而制革等行业都会产生较高质量浓度的含Cr废水。本研究旨在研究重金属Cr对土壤微生物及脲酶和过氧化氢酶活性的影响,从而间接明确重金属Cr对土壤肥力状况的影响。
1 材料与方法
1.1 供试材料
2008年在宁波大学内建造面积约为140 m2的实验温室大棚,进行土培Cr胁迫试验。根据课题实施计划从浙江宁波奉化苗圃购入柏木(Cupressus funebris Endl.)、侧柏(Platycladus orientalis(Linn.)Franco)、刺柏(Juniperusformosana Hayata)、女贞(Ligustrum lucidum Ait.)、桂花(Osmanthus fragrans(Thunb.)Lour.)、夹竹桃(Nerium indicum Mill.)、四季竹(Oligostachyum lubricum(Wen)Keng f.)、银 杏 (Ginkgo biloba Linn.)、杜鹃(Rhododendron simsii Planch.)、山茶(Camellia japonica Linn.)、臭椿(Ailanthus altissima(Mill.)Swingle)、棕榈(Trachycarpus fortunei(Hook.)H.Wendl.)、广玉兰(Magnolia grandiflora Linn.)、樟 树 (Cinnamomum camphora(L.)Presl)、大花美人蕉(Canna generalis Bailey)和爬山虎(Parthenocissus tricuspidata(Sieb.et Zucc.)Planch.)共 16 种植物作为试验植物种质,试供土壤为奉化苗圃土,土壤pH值6.5,有机质质量分数为3.27%。
1.2 重金属处理
将买回的植物种入上直径为36 cm,高为30 cm的陶瓷盆内,向土壤中加入不同质量浓度的Cr作为处理,Cr以CrCl3·6H2O形态溶于水箱的水中,通过ZQDF型蒸汽电磁阀和HT-12K微电脑多功能控制器将处理过的水定时定量通过滴灌系统注入每盆试供植物的土壤中,对于部分滴水效果不太理想的进行人工浇灌已知质量浓度的Cr溶液,来保证不同处理水平达到试验预定的Cr质量浓度要求。共设置对照组(CK,不加Cr)和7、14、21 mg·L-1(以Cr3+计)3个处理水平(分别定义为处理1、处理2和处理3),每个水平每种植物设置5个平行。2008年6月,将买入的试供植物种入盆内,稳定生长5个月,从2008年12开始运行,除去寒假实验室停电装置暂停运行一个月外,至2009年8月共运行9个月。
1.3 采样方法
土样于2009年9月采集,根据常规取样方法,在各处理水平下分别对栽种每种植物的5个盆进行采样,采集5~20 cm的土壤层,混合均匀不同样点土样及植物幼根,装入无菌袋内,放入冰盒带回实验室,供测定研究使用。
1.4 测定方法
土壤主要化学性质测定:土壤pH值(H2O)的测定采用电位法,使用pHs-25型pH计(雷磁)测定。土壤有机质质量分数的测定采用重铬酸钾容量法测定。
土壤重金属测定:土壤中重金属含量测定采用微波消解—原子吸收分光光度法。精确称取土壤样品0.400 0 g于ETHOS1/A微波消解仪(MDS)消解罐中,加8 mL HNO3和2 mL H2O2,运用消解仪设定的消解程序进行消解,结束后开罐赶酸,用超纯水将消解液转入50mL容量瓶中定容,过滤去除杂质,待测。待测溶液视测定条件酌情适当稀释。分析过程分别加入国家标准土壤样品(GSS-1)和国家标准植物样品(GSV-3)进行分析质量控制。待测溶液通过TAS-990原子吸收分光光度计(北京普析)进行测定。
土壤样品微生物测定:微生物数量的测定采用菌落平板计数法。不同类群的微生物使用不同的培养基,细菌的培养基为牛肉膏蛋白胨培养基,放线菌为高氏1号培养基,真菌为萨布(Sabouraud’s)培养基[14]。28~30 ℃培养,定时观察、计数(Shineso全自动菌落计数仪AS1)。
土壤酶活性测定:土壤脲酶活性的测定采用苯酚—次氯酸钠比色法,其活性以24 h后1.0 g土壤中NH3-N的毫克数表示;土壤过氧化氢酶活性的测定采用容量法[15]。
数据相关分析、回归分析及绘图工作由 Origin8.0、SPSS13.0和MATLAB7.0等分析软件完成。
2 结果与分析
2.1 Cr胁迫对土壤的基本理化性质的影响
从奉化苗圃运回的供试土壤pH值6.5,有机质质量分数为3.27%。经过9个月的土培试验后,土壤的基本理化性质见表1。从表1可以看出:土壤pH均呈一定的酸性,且在一定程度上有所降低,不同植物生长的土壤pH也有所不同(具体数据未列出);土壤中有机质质量分数均较低,该土属于低肥土,有机质的质量分数也有所降低,不同植物生长的土壤有机质也有所不同(具体数据未列出)。这可能是由于滴灌系统用水pH呈弱酸性,未对土壤进行施肥,盆栽试验植物生长以及土壤中Cr3+的加入等的综合作用的结果。
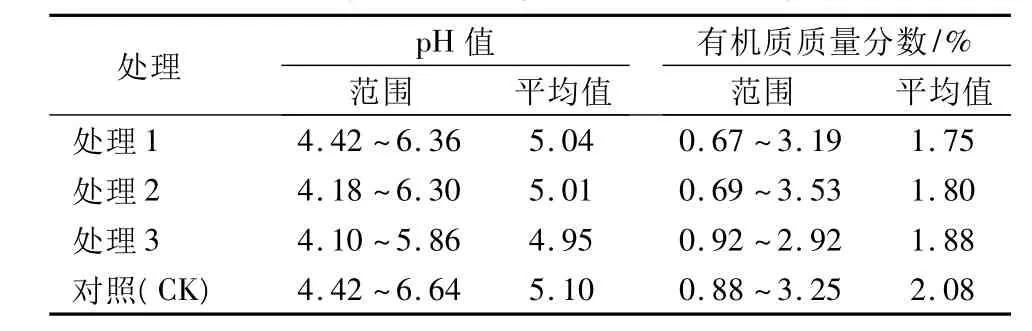
表1 土培Cr胁迫试验后土壤基本理化性质
从奉化苗圃运回的供试土壤的Cu、Pb、Zn、Cr质量分数分别为 45.31、63.19、95.24、180.46 mg·kg-1,其质量分数均大于全国的土壤背景值,但均在土壤环境质量二级标准(GB15618—1995)以内,可认为供试土壤是无重金属污染土壤。经过9个月的土培试验后,土壤重金属质量分数测定结果见表2。3个处理水平及对照组土壤的4种重金属(Cu、Pb、Zn、Cr)的质量分数均大于全国的土壤背景值。其中经过处理后的土壤Cr质量分数很高,是全国背景值的7~13倍。从土壤环境质量二级标准(GB15618—1995)来看,经过处理后的土壤Cr质量分数已经超过污染警戒值,是二级标准的1.7~3.6倍,可能是由于试验时间还不够长,对试验结果基本不产生影响。土培试验结束后经处理后的土壤Cu、Pb、Zn质量分数以及对照组的Cu、Pb、Zn、Cr质量分数均在二级标准以内,较供试土壤的原始质量分数有所降低,但降低的程度很小。
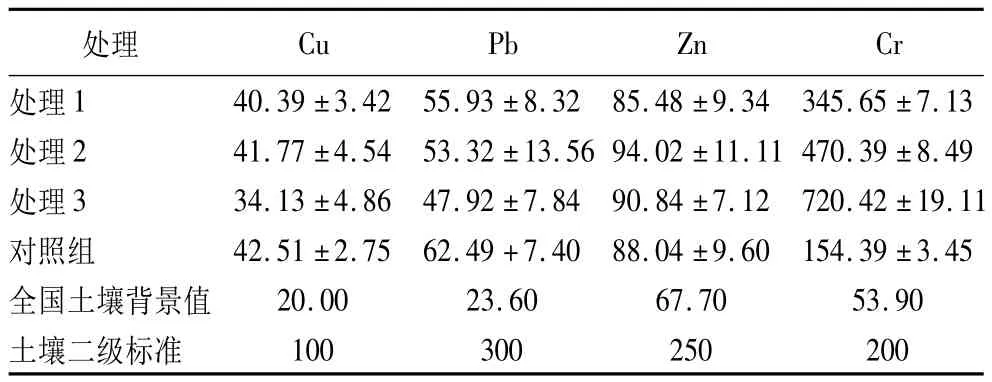
表2 不同土培试验下土壤重金属质量分数 mg·kg-1
2.2 Cr胁迫对土壤微生物数量的影响
土壤微生物是决定土壤生物化学特性的重要组成部分,其数量的多少直接影响土壤的物理、生物和化学性质,决定着土壤养分的组成与转化,同时也是评价土壤肥力的重要指标之一。目前,采用微生物学指标来表征土壤重金属污染越来越受到人们的普遍关注。龙健等[16]研究发现,铜矿区重金属污染对土壤环境质量微生物学指标有较大的影响。土壤微生物对重金属的胁迫要比同一环境中的动物和植物敏感得多,被认为是最有潜力的评价土壤环境质量的指标[17]。从表3中可以看出:对于同一个处理下的土壤,3大类微生物的数量呈现出相似的变化特点,即:细菌>放线菌>真菌。细菌的营养类型多样,呼吸机制复杂,代谢旺盛,繁殖快,所以各处理水平中的细菌的数量最多。土壤中的放线菌主要以链霉菌为主,大部分放线菌属好氧腐生菌,对纤维素、几丁质、固醇类等结构复杂的难降解天然有机物有较强的利用能力。一般来说,土壤中的真菌数量总是小于细菌和放线菌的数量,但由于其孢子、菌核和菌索的忍耐力较强,因此,可广泛分布于各种类型的土壤中。对于对照组(CK)及3个不同Cr处理的土壤,对照组中的细菌、放线菌和真菌,其数量均为最大,随着处理质量浓度的不断增大,土壤中的细菌、放线菌和真菌均有不同程度的降低。
2.3 Cr胁迫对土壤脲酶活性的影响
土壤脲酶在土壤系统氮素循环过程中起着重要作用,人们常用土壤的脲酶活性表征土壤的氮素状况[18]。在研究重金属对土壤污染时,通常将土壤对土壤脲酶的影响作为一个主要内容。国内外学者对重金属污染条件下的酶活性进行了大量的研究,对于土壤脲酶,重金属对其活性的影响与重金属种类和浓度以及土壤理化性质有关[19-20]。杨志新等[21]通过回归正交试验发现,重金属对土壤酶活性的抑制效应顺次为Cd>Zn>Pb;同时,Cd、Zn、Pb复合污染对土壤脲酶表现出协同抑制负效应的特征,在过氧化氢酶、脲酶、磷酸酶、转化酶中,脲酶受重金属的抑制作用最为敏感。有关土壤中的Cr对脲酶的影响方面的研究较少,蔡少华等[22]采用室内模拟方法较为系统地研究了六价水溶态铬和总铬对土壤脲酶活性的影响,结果表明六价铬抑制土壤脲酶活性,其活性与六价水溶态铬达到极显著负相关,揭示脲酶活性可作为土壤Cr污染程度的指标之一;对于低肥土,土壤中六价总铬质量浓度增加,脲酶活性持续递减。对于三价铬对土壤脲酶活性的研究少之甚少,因此笔者研究了不同Cr3+处理水平下土壤总Cr质量浓度对土壤脲酶活性的影响。结果表明,不同样点土壤脲酶活性存在一定程度的差异性,其变化范围:处理1为0.301~0.721 mg·(g·d)-1;处理2 为0.214~0.404 mg·(g·d)-1;处理3 为0.101~0.389 mg·(g·d)-1;对照组(CK)为0.503~0.861 mg·(g·d)-1。从相关系数来看,脲酶活性的变化幅度较大。总体来说,Cr的加入抑制了土壤脲酶的活性。从图1中可知,脲酶活性与土壤Cr质量分数呈显著的负相关(相关系数r=-0.862,p<0.01),揭示Cr可明显抑制土壤脲酶活性。
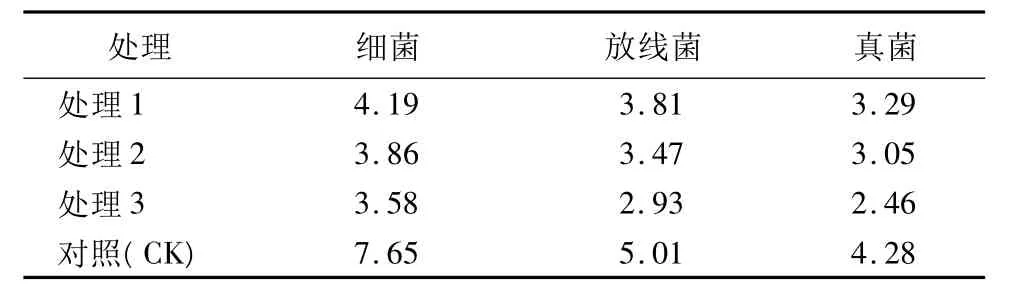
表3 不同水平Cr胁迫下土壤中微生物数量 ×105

图1 脲酶活性与土壤的Cr金属质量分数回归分析
2.4 Cr胁迫对土壤过氧化氢酶活性的影响
过氧化氢酶广泛存在于土壤中和生物体内,其活性在一定程度上反映了土壤微生物学过程的强度,也可表征土壤总的生物学活性和肥力状况。由于土壤中一些酶的活性能较稳定、敏感地反映重金属对土壤的污染程度,人们开始注重探讨用土壤酶活性作为判定土壤污染程度的生化指标。目前已经有人发现用脲酶、过氧化氢酶活性可作为判断土壤中全量Cd、Pb 污染程度的主要生化指标[10,23-24]。Naseby 等[25]研究发现,Cd、Zn、Pb共存时,其对过氧化氢酶表现出一定的拮抗作用或屏蔽作用,尤其Pb质量浓度较高时,屏蔽作用较为明显。罗虹等[26]采用回归正交设计方案,研究了 Cd、Cu、Ni复合污染对6种土壤酶(脲酶、转化酶、蛋白酶、磷酸酶、过氧化氢酶、脱氢酶)活性的影响,结果表明:6种土壤酶活性与Cd、Cu、Ni复合污染之间均呈显著或极显著的相关性,但对酶活性的影响存在明显的差异,Cd、Cu对其活性的影响多表现为抑制性,而Ni则多表现为激活作用。但对于土壤中重金属Cr对土壤过氧化氢酶活性影响方面的研究很少。本研究结果表明,不同样点土壤过氧化氢酶活性存在一定程度的差异性,其变化范围:处理1 为3.468~13.176 mL·(g·h)-1;处理2 为3.402~12.405 mL·(g·h)-1;处理3 为1.527~11.90 mL·(g·h)-1;对照组(CK)为 5.235~15.549 mL·(g·h)-1。从相关系数来看,过氧化氢酶活性的变化幅度一般。总体来说,Cr的加入抑制了土壤过氧化氢酶的活性。从图2中可知,过氧化氢酶活性与土壤Cr质量分数呈显著的负相关(相关系数 r=-0.650,p<0.01),揭示 Cr可抑制土壤过氧化氢酶活性。
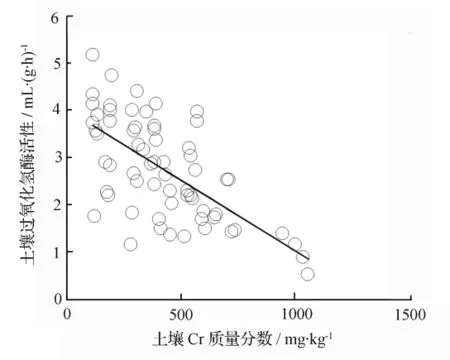
图2 过氧化氢酶活性与土壤Cr金属含量回归分析
3 结束语
在土培Cr胁迫试验中,处理水平下土壤中微生物数量为细菌>放线菌>真菌,土壤中重金属Cr质量浓度的增加在一定程度上抑制微生物的生长,最终导致土壤中的细菌、放线菌和真菌数量的减少。土壤脲酶活性与土壤Cr质量分数呈显著的负相关(r=-0.862),揭示Cr可明显抑制土壤脲酶活性,机理可能是由于Cr与土壤脲酶活性中心或与酶分子的巯基、氨基和羧基结合,影响了土壤酶与底物的结合[25],最终导致酶活性降低,表明土壤脲酶活性在一定程度上可监测土壤受三价铬污染程度。过氧化氢酶活性与土壤Cr质量分数呈显著的负相关(r=-0.650),揭示Cr可抑制土壤过氧化氢酶活性,但其抑制效应低于Cr对土壤脲酶活性的抑制,表明其活性在一定程度上也可表征土壤受三价Cr污染程度。
[1]周加祥,刘铮.铬污染土壤修复技术研究进展[J].环境污染治理技术与设备,2000,1(4):52-56.
[2]李阜隶,喻子牛,何绍江.农业微生物学实验技术[M].北京:中国农业出版社,1996.
[3]于寿娜,廖敏,黄昌勇.镉、汞复合污染对土壤脲酶和酸性磷酸酶活性的影响[J].应用生态学报,2008,19(8):1841-1847.
[4]赵萌,李敏,王淼焱,等.西瓜连作对土壤微生物主要类群和土壤酶活性的影响[J].微生物学通报,2008,35(8):1251-1254.
[5]周礼恺.土壤酶学[M].北京:科学出版社,1987.
[6]王新,周启星.土壤重金属污染生态过程、效应及修复[J].生态科学,2004,23(3):278-281.
[7]尹君,高如泰,刘文菊,等.土壤酶活性与土壤Cd污染评价指标[J].农业环境保护,1999,18(3):130-132.
[8]李博文,刘树庆.潮褐土镉、锌、铅复合污染与土壤酶活性的关系[J].吉林农业科学,2000,25(1):38-41.
[9]蔡少华,和文祥,呼蕾,等.六价铬对土壤脱氢酶活性的影响[J].西北农业学报,2008,17(5):208-214.
[10]周礼恺,张志明,曹承绵,等.土壤的重金属污染与土壤酶活性[J].环境科学学报,1985,5(2):176-184.
[11]Grigorydn K V,Galstyan A S.Effect of irrigation water polluted with industrial waste on the enzymatic activity of soils[J].Soviet Soil Science,1979,11(2):220-228.
[12]和文祥,陈会明,冯贵颖,等.汞铬砷元素污染土壤的酶监测研究[J].环境科学学报,2000,20(3):338-343.
[13]Renella G,Origoza A L R,Landi L,et al.Additive effects of copper an zinc on cadmium toxicity on phosphatase activities an ATP content of soil as eatimated by the ecological dose(ED50)[J].Soil Biology & Biochemistry,2003(35):1203-1210.
[14]黄秀梨.微生物学实验指导[M].北京:高等教育出版社,2001.
[15]关松荫.土壤酶及其研究法[M].北京:中国农业出版社,1986.
[16]龙健,黄昌勇,縢应,等.矿区重金属污染对土壤环境质量微生物学指标的影响[J].农业环境科学学报,2003,22(1):60-63.
[17]孙波,赵其国,张桃林,等.土壤质量与持续环境Ⅲ:土壤质量评价的生物学指标[J].土壤,1997,29(5):225-234.
[18]和文祥,朱铭莪,张一平.土壤酶与重金属关系的研究现状[J].土壤与环境,2000,9(2):139-142.
[19]滕应,骆永明,李振高.土壤重金属复合污染对脲酶、磷酸酶及脱氢酶的影响[J].中国环境科学,2008,28(2):147-152.
[20]孙兆海,郑春荣,周东美,等.土壤铅污染对青菜和蕹菜生长及脲酶活性的影响[J].农村生态环境,2005,21(1):38-43.
[21]杨志新,刘树庆.重金属Cd、Zn、Pb复合污染对土壤酶活性的影响[J].环境科学学报,2001,21(1):60-63.
[22]蔡少华,和文祥,梁艳茹,等.六价铬污染土壤后形态变化及其对土壤脲酶活性的影响[J].农业环境科学学报,2009,28(2):251-255.
[23]史长青.重金属污染对水稻土酶活性的影响[J].土壤通报,1995,26(1):34-35.
[24]刘树庆.保定市污灌区土壤的Pb、Cd污染与土壤酶活性关系研究[J].土壤学报,1996,33(2):175-182.
[25]Naseby D C,Lynch JM.Rhizosphere soil enzymesasindicators of perturbations caused by enzyme substrate addition and inocubation of a genetically modifled strain of Pseudomonas fluoresces as wheat seeds[J].Soil Biol Biochem,1997,29:1353-1362.
[26]罗虹,刘鹏,宋小敏.重金属镉、铜、镍复合污染对土壤酶活性的影响[J].水土保持学报,2006,20(2):94-96,121.
