银杏细胞微管免疫荧光观察体系的优化1)
2011-08-09孙宇涵杨妮娜袁存权胡瑞阳
孙宇涵 杨妮娜 袁存权 胡瑞阳 李 云 王 谦
(林木育种国家工程实验室(北京林业大学),北京,100083) (北京林业大学)
微管是由α、β微管蛋白异源二聚体及少量微管结合蛋白聚合而成的亚稳定动态结构,具有广泛的生物学功能和独特的细胞动力学特性[1],它是细胞骨架的主要组成部分,细胞中的细胞器如纺锤体和中心粒等都是由微管参与组成的,它在维持细胞形态、支持细胞分裂、协助细胞内的物质运输和能量转换等方面有着重要作用。
间接免疫荧光法是以一抗抗体作为媒介,使抗原间接与有荧光素标记的二抗抗体结合,通过检测二抗抗体上的荧光信号间接进行抗原检测的技术。由于该方法具有特异性强和灵敏度高的特点,目前已广泛应用于生物大分子结构定位和细胞形态研究中[2-3]。利用间接免疫荧光法定位微管,在动物上研究较多,在植物上的研究大都集中在水稻、小麦和白菜等作物上[4-6],在观赏用百合科植物上也曾有报道[7],但在木本植物尤其是裸子植物领域的研究中报道较少。本研究以银杏(Ginkgo biloba L.)雄株生殖细胞为材料,对传统免疫荧光染色法的前期制片方式以及酶解等步骤进行了优化,将其与Bednara等[8]提出的PEG包埋切片法相结合,建立了适用于银杏细胞微管的最佳免疫荧光观察体系,并对银杏雄株生殖细胞减数分裂时期的微管及染色体的变化情况进行了研究,为今后裸子植物的微管骨架研究奠定基础。
1 材料与方法
主要试剂与仪器:多聚甲醛,MBS(Sigma公司生产,编号M2786),PEG4000,PEG1500,anti- α -tubulin(Sigma公司生产,编号 T-9026),anti-mouse IgG FITC conjugated(Sigma公司生产,编号F-0257),PI(碘化丙啶),ATF(抗荧光衰减封片剂),莱卡 TCS-SP2激光共聚焦扫描显微镜和莱卡RM2235型石蜡切片机等。
观察材料的选备:银杏材料取自北京林业大学鹫峰林场的30年生银杏雄株。银杏雄株经切枝后将枝条立即放入温室中20~30℃水培催芽,每2天定时换水,并对其生殖细胞发育状态进行跟踪观察,当其发育即将进入减数分裂时,取银杏小孢子囊,按6 h间隔进行取样,直至减数分裂结束。
材料的固定及包埋:①材料固定。用微管固定剂(含4%多聚甲醛,10%DMSO,0.01%MBS,1%TritonX-100,50 mmol/L Pipes,5 mmol/L EGTA,2 mmol/L MgSO4,4% 蔗糖,pH值6.9)对样品进行定期固定,固定时间为60 min。②冲洗。将材料从固定液中取出,用PEMS冲洗液(含10%DMSO,0.01%MBS,1%TritonX-100,50 mmol/L Pipes,5 mmol/L EGTA,2 mmol/L MgSO4,4%蔗糖,pH 值 6.9)仔细清洗 3次,每次 5 min;再用 PEM 缓冲液(50 mmol/L Pipes,5 mmol/L EGTA,2 mmol/L MgSO4,pH 值6.9)仔细清洗3次,每次5 min;最后用蒸馏水仔细清洗3次,每次5 min。③脱水。将清洗后的材料分别用 10% 、20% 、30% 、40% 、50% 、60% 、70% 、80% 、90% 的乙醇溶液依次脱水处理,每次脱水时间均为30 min,最后用无水乙醇脱水3次。第1次在室温下进行,处理20 min;第2次在恒温箱内(55℃)进行,处理20 min;第3次直接使用预先加热到55℃的无水乙醇在恒温箱内55℃进行,处理20 min。④渗透。将脱水处理后的材料转入1号渗透剂(V(PEG混合液)∶V(无水乙醇)=1∶2)中并放入恒温箱内55℃保温30 min,然后转入2号渗透剂(V(PEG混合液)∶V(无水乙醇)=1∶1)中继续55℃保温30 min,再转入3号渗透剂(V(PEG混合液)∶V(无水乙醇)=2∶1)中持续55℃保温30 min,最后转入PEG混合液(V(PEG4000)∶V(PEG1500)=1∶3)中持续55℃保温60 min;更换一次纯PEG混合液,继续55℃保温60 min。⑤切片。先将PEG混合液加入包埋管中,然后加入已经渗透完全的包埋材料,55℃静置1 h后在室温下聚合,当聚合完成包埋管内的PEG混合液充分凝固后,取出PEG凝固块,进行切片。
粘片:将所得PEG凝固块切片采用2种不同的粘片方式固定于玻璃载片上,一种是采用蛋清黏合剂(100 mL蛋清黏合剂中含有50 mL蛋清,50 mL甘油和1 g麝香草酚)将所得PEG凝固块切片粘于玻璃载玻片上;另一种是采用朱洪亮等[9]最新发明的真空粘片法将所得PEG凝固块切片先置于预先滴有少量蒸馏水的载玻片上,然后将载片移入真空泵中干燥处理30 min。采用2种方法同步制片,并进行后期的相关处理。
细胞壁的酶解处理:为验证无酶解处理对本文所述研究方法的影响情况,研究中对所制部分样片采用酶解液(100 mL酶解液中含1.0 g果胶酶和2.0 g纤维素酶)在30℃下酶解30 min,作为无酶解处理观察的对照。
免疫荧光标记:①抗体标记前的预处理。将制好的样片用蒸馏水缓速冲洗5次,每次5 min,然后用PBS缓冲液(0.137 mol/L NaCl,2.7 mmol/L KCl,1.47 mmol/L KH2PO4,8.1 mmol/L,Na2HPO4,pH 值7.2)继续缓速冲洗3 次,每次5 min,随后在洗掉PEG的材料玻片上滴加适量的0.1 mol/L NH4Cl处理3 min,处理后用PBS缓冲液继续缓速冲洗3次,每次5 min,然后滴加适量0.1%Tween 20处理20 min,最后用1%BSA处理15 min。②一抗抗体标记染色。向预处理过的样片滴加一抗标记染液(将anti-α-tubulin抗体用PBS缓冲液稀释100倍),在37℃下温育60 min,然后将经一抗标记的材料玻片用PBS缓冲液冲洗3次,每次5 min。③二抗抗体标记染色。向清洗过的一抗标记样片滴加二抗标记染液(将antimouse IgG FITCconjugated抗体用PBS缓冲液稀释200倍),并继续在37℃下温育60 min,此时样片要放置于能保持潮湿的染色盒内,防止干燥。处理完成后用PBS缓冲液冲洗3次,每次5 min。④复染。将免疫标记后的样片用质量浓度为1 mg/L的PI染色液染色1 min,随后立即用PBS缓冲液将PI染液洗去,防止染色过量。⑤封片保存。将全部染色完成后的样片用ATF溶液封片,-20℃保存。⑥观察拍照。经过免疫标记的样片在激光共聚焦扫描显微镜下以494、535 nm分别检测FITC和PI的激发荧光,并扫描观察拍照。
2 结果与分析
2.1 FITC与PI荧光相互影响情况
利用激光共聚焦显微镜对经PI复染后的银杏小孢子母细胞的微管及染色体进行观察,结果如图1。通过图1a和图1c对比,发现经PI复染后的免疫荧光标记样片中的FITC荧光仍然能够清晰观察到,并未发生PI过度染色干扰FITC荧光或误染细胞壁等情况。这说明在进行银杏小孢子母细胞减数分裂观察时,可以同步对FITC标记的微管蛋白和PI染色的染色体进行对比,同时观察银杏微管骨架和染色体在减数分裂进程中的变化及相互影响情况,由此在保证研究质量的前提下,相对降低了研究的工作量。
另外,由于PI激发波长与FITC激发波长接近(FITC激发波长为494 nm,PI激发波长为535 nm),大大减少了后期激光激发观察所导致的荧光猝灭反应,可有效保证图像的质量。
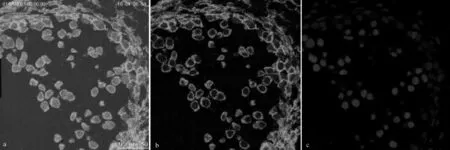
图1 激光共聚焦显微镜下的银杏小孢子母细胞FITC和PI荧光图
2.2 PEG包埋对银杏细胞免疫活性的影响
将经PEG包埋1 a后抗体标记的银杏小孢子母细胞的微管结构与对照组(固定后立即抗体标记)银杏小孢子母细胞的微管结构进行对比,结果如图2。由图2可见,经过1 a的常温保存,经PEG包埋的银杏小孢子母细胞材料内的微管结构仍然清晰完整,与标记后立即观察的结果相比无明显的荧光亮度减弱现象出现。说明通过PEG包埋可以很好地保存细胞内微管蛋白的免疫活性,长时间的包埋保存不会对其产生影响,为后续大批量研究观察赢得了充足的时间。同时,由于PEG材料遇水可溶解,省去了石蜡包埋时所需的后期脱蜡步骤,包埋操作简单,而且由于PEG材料的熔点较低,在包埋过程中所需温度不高,大大降低了材料处理过程中温度对银杏细胞微管结构的影响,保证了后期免疫标记能够取得较好的效果。
2.3 不同粘片法的效果对比
对比2种粘片法所制样片,发现经真空粘片法所制的样片出现了大量的样品脱片情况(如图3b和表1所示);而经蛋清黏合剂粘的样品未出现明显的脱片情况(如图3a和表1所示)。

图2 固定后立即标记与PEG包埋1 a后标记的银杏小孢子母细胞荧光对比图

表1 不同粘片法所制样片脱片情况对比
通过在免疫荧光检测观察后发现,经真空粘片法所制的样片中,其银杏小孢子母细胞的数量明显偏少,部分样片中只有小孢子囊结构存在,本应存在其中的银杏小孢子母细胞因粘合不牢出现大量丢失现象(图3d);而在经蛋清黏合剂粘的样片中,可以清晰地看到在小孢子囊结构中有着数量众多的银杏小孢子母细胞存在(图3c)。

图3 蛋清粘合法和真空粘片法所制的银杏小孢子母细胞切片荧光对比图
2.4 酶解对后期免疫染色的影响
通过免疫荧光标记染色,对比无酶解处理和酶解处理后的样品切片(图4)。由图4可见,经酶解处理后样品中的微管结构清晰明亮(图4a箭头所示);同样,未经酶解处理的样品中的微管结构也依然完整,且荧光的亮度也没有明显降低(图4b箭头所示)。这说明在本试验中由于前期的样品处理步骤,银杏的细胞壁已经不会阻碍荧光标记抗体进入其细胞中发生免疫反应,此时有无酶解处理都不会对最终观察结果产生影响。所以,完全可以将免疫标记前的酶解步骤省去,从而降低试验的成本,简化操作步骤。

图4 细胞壁经酶解和未经酶解的银杏小孢子母细胞荧光对比图
2.5 传统压片法与PEG包埋切片法的差异
将研究中所采用的PEG包埋切片法与传统压片法相比较后发现,采用传统的压片法制片时,样片中银杏细胞非常凌乱,很难将发育中银杏小孢子母细胞和银杏体细胞进行区分,并且采用传统压片法时样片上会存在大量的其它组织残留,还会伴随有细胞大量重复叠加的现象出现,这对后期的观察研究影响较大。而采用PEG包埋切片法时,其样片中的银杏细胞排列有序,PEG包埋切片完整地保持了银杏细胞的组织结构,能够清晰分辨出各个细胞的种类与形态,并且没有多余的组织残留和细胞大量重复叠加的现象存在,可以对每个细胞进行清晰地观察和研究。
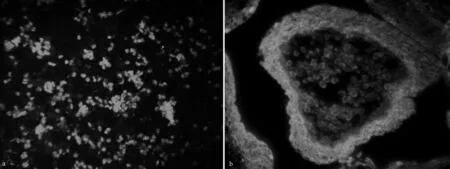
图5 传统压片法和PEG包埋切片法所制样片荧光图像对比
2.6 银杏小孢子母细胞减数分裂时微管及染色体变化情况
在银杏小孢子母细胞进入减数分裂前,其细胞核较大,占整个细胞的80%以上,其微管结构呈放射网状覆盖于细胞核外围四周(图6A);当减数分裂进程处于细线期至终变期阶段,细胞核内的染色体开始变粗变短(图6B),此时的微管骨架结构开始逐渐聚集于染色体四周,并开始逐渐形成早期的纺锤体(图6C);当减数分裂进入中期I时,各对同源染色体移向细胞中央的赤道板,着丝点成对排列在赤道板2侧,微管聚集在生殖细胞的两极区域,并在细胞质中形成了成熟的纺锤体,开始将处于中间赤道地区的染色体组向两极牵拉(图6D);当减数分裂进入后期I时,由于纺锤丝的牵引,使成对的同源染色体各自发生分离,并分别移向两极,此时微管结构以细胞两极的极点为中心成散射状向四周分布,在细胞两极各自形成了一个“伞帽”(图6E);末期I阶段,由于微管的聚集,在细胞中部开始逐渐形成成膜体,细胞器逐渐聚集于成膜体的2侧,中间区域的微管结构逐渐消失,最终形成一条明显的中间条带(图6F)。
在减数分裂的第二次分裂时,中期Ⅱ时细胞两侧的染色体开始逐渐聚集在两侧部分的中间区域,两侧各自形成了如中期I阶段那样的纺锤体结构(图6G);在后期Ⅱ阶段,每条染色体的着丝点分离,两条姊妹染色单体也随之分开,成为2条染色体。在纺锤丝的牵引下,这2条染色体分别移向细胞的两极;进入末期Ⅱ阶段后,第2条成膜体逐渐形成,2条交叉的条带将4组染色体分割于四分体的4个角落(图6H),最后形成分别由微管骨架结构包裹的四分体(图6I)。
3 结论与讨论
自 1963 年 Ledbetter[10]和 Slautherback[11]等分别在植物和动物细胞中发现微管以来,微管在细胞生物学中一直是一个非常重要的研究领域。与动物和其它植物相比,有关木本植物微管的研究报道较少,而银杏的微管研究目前只有Brown和Lemmon[12]曾成功采用免疫抗体标记了银杏细胞微管组成中含量最少的γ微管蛋白,并对其在减数分裂时期的分布情况进行了跟踪观察,但此方法存在适用性单一、所用标记抗体昂贵、操作步骤繁琐、样品保存时间较短等缺点。所以,急需建立一个适用于包括银杏在内的木本植物细胞微管观察的研究方法和体系,而目前公认的最好的微管观察方法之一就是免疫荧光组织化学染色法。本研究的结果表明,采用PEG包埋切片法,并用蛋清黏合剂粘合制片,无需酶解处理,经预处理后进行FITC免疫标记及PI复染的方法,可以获得银杏小孢子母细胞微管和染色体极佳的荧光图像。与传统压片法相比,此种免疫染色方式操作简单,所得图像中细胞形态结构清晰完整,没有细胞层间的相互干扰叠加现象,并且节省了传统的酶解处理步骤,从而在保证标记抗体和细胞充分接触的同时,减少了酶解处理对样品细胞形态和微管结构的破坏,获得了较好的银杏细胞微管及染色体荧光观察结果。
由于微管在植物细胞内有着重要的作用,所以本研究确立的最佳体系和方法可以为今后的木本植物染色体加倍、细胞内染色体迁移、细胞壁构建和细胞内信号传导等方面的研究提供重要的技术参考。随着免疫标记染色技术和分子生物学研究领域的不断深入,以后的微管研究必将从静态的观察发展为对微管蛋白聚合—解聚这一过程的动态研究,而本文中所获研究方法将为该方面的深入研究提供支持。
[1]王亚茹,邓高松,李云,等.秋水仙碱对微管蛋白的作用机制及其细胞效应研究进展[J].西北植物学报,2010,30(12):2570-2576.
[2]刘天麟,王强.大鼠切牙发育中釉蛋白的免疫荧光定位[J].上海口腔医学,2010,19(4):419-422.
[3]计淑霞,盖国琛,戴绍军,等.应用改进的免疫荧光组织化学染色法对水稻根尖细胞微管结构的观察[J].山东农业科学,2010(4):40-42,55.
[4]Zhu Hongliang,Liu Xiangdong,Lu Yonggen,et al.Changes of microtubule pattern during the megasporogenesis of polyembryonic rice strain AP Ⅳ[J].Chinese JRice Sci,2002,16(2):134-140.
[5]刘刚,王冬梅.小麦叶肉细胞原生质体中微管骨架的排列格局与[Ca2+]cyt的关系[J].实验生物学报,2005,38(4):331-339.
[6]张静宜,侯喜林,史公军,等.白菜组织细胞微管间接免疫荧光检测体系的优化[J].园艺学报,2007,34(6):1551-1554.
[7]Casino C D,Bohdanowicz J,Lewandowska B,et al.The organization of microtubules during generative-cell division in Convallaria majalis[J].Protoplasma,1999,207:147-153.
[8]Bednara J,van Lammeren A A M,Willemse M T M.Microtubular configurations during meiosis and megasporogenesis in Gasteria verrucosa and Chamaenerion angustifolium[J].Sex Plant Reprod,1988,1:164-172.
[9]朱洪亮,刘向东,卢永根,等.研究植物胚囊中微管的PEG切片法的改进[J].华南农业大学学报,2001,22(4):52-54.
[10]Ledbetter M C,Porter K R.A“microtubule”in plant cell fine structure[J].J Cell Biol,1963,19:239-250.
[11]Slautterback D B.Cytoplasmic microtubulesⅠ:Hydra[J].JCell Biol,1963,18(2):376-388.
[12]Brown R C,Lemmon B E.γ-Tubulin and microtubule organization during microsporogenesis in Ginkgo biloba[J].JPlant Res,2005,118:121-128.
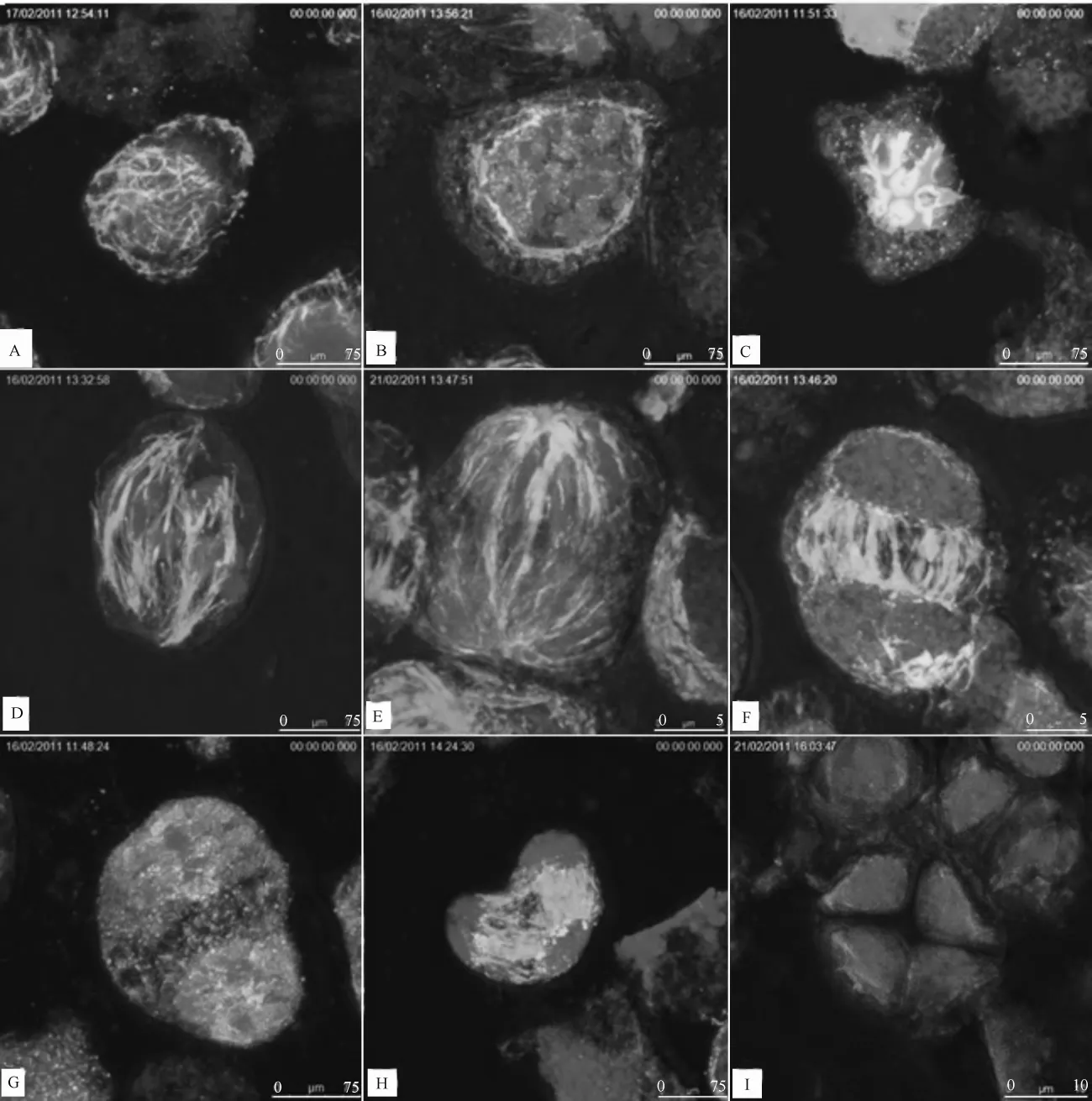
图6 银杏小孢子母细胞减数分裂时期微管及染色体变化免疫荧光图
