雷帕霉素对前脂肪3T3-L1细胞脂质稳态和分泌功能的影响
2011-08-09李金红刘迎九张国娟尹洪超陶建瓴
李金红,刘迎九,张国娟,尹洪超,陶建瓴,李 航
1中国医学科学院 北京协和医学院 北京协和医院肾内科,北京 100730
2北京同仁医院肾内科,北京 100730
3中国医学科学院 北京协和医学院 基础医学研究所病理系,北京 100005
雷帕霉素在脏器移植术后抗排斥治疗[1-6]、肿瘤治疗[7]及预防冠脉支架形成术后再狭窄[2,8]等方面的有效作用使之已成功地应用于临床。高脂血症是雷帕霉素最主要的副作用,主要表现为高胆固醇血症和高三酰甘油血症[9-11]。雷帕霉素在脂质代谢上表现出双面性:抗动脉粥样硬化和引起高脂血症这两个相矛盾的作用同时发生在雷帕霉素用药过程中。雷帕霉素可通过抑制血管平滑肌细胞增殖和迁移、减少前炎症因子的表达、减少动脉单核细胞趋化因子-1的表达发挥抗动脉粥样硬化作用,但雷帕霉素引起高脂血症的机制,目前尚不十分清楚。脂肪细胞的分化成熟及其储脂功能受人雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)调控,阻断mTOR能阻断脂肪细胞分化。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR) 家 族是动物糖脂代谢的主要核调节受体,其中PPARγ被认为是调节脂肪组织分化、抑制ob基因下调瘦素表达的主要核受体因子。3T3-L1前脂肪细胞系是较常用于研究脂肪分化及脂质代谢的细胞模型,它能在胰岛素诱导下分化成为成熟的脂肪细胞,成熟后的3T3-L1具有储存脂质及分泌瘦素、脂联素的功能。本研究通过观察雷帕霉素对3T3-L1前脂肪细胞分化、脂质蓄积的影响和与PPARγ表达变化之间的关系探讨雷帕霉素引起高脂血症的可能机制。
材料和方法
材料 小鼠3T3-L1前脂肪细胞株由中国医学科学院基础医学研究所病理系惠赠,雷帕霉素由华北制药厂惠赠,胆固醇标准溶液和内标物豆甾醇由北京医院老年病研究所惠赠。胎牛血清、小牛血清和DMEM F12培养基购自HyClone公司,抗PPARγ抗体购自Abcam公司,二抗购自北京中杉金桥公司,瘦素、脂联素Elisa试剂盒购自R&D公司,牛胰岛素、3-异丁基-l-甲基黄嘌呤和地塞米松购自Sigma公司,逆转录试剂盒购自Promega公司,实时荧光定量PCR试剂购自TOYOBO公司,引物由上海生物工程有限公司合成。其余化学试剂均为国产分析纯产品。
前脂肪细胞3T3-L1的培养 用含10%小牛血清DMEM F12细胞培养液在37℃、含5%CO2的孵箱中进行细胞培养传代,3T3-L1前脂肪细胞的分化采用传统的鸡尾酒法:细胞培养至融合状态2 d后,用10%胎牛血清的培养基培养2 d,再先后用脂肪细胞分化液Ⅰ (含地塞米松 1 μmol/L、3-异丁基-l-甲基黄嘌呤11 ng/ml、胰岛素10μg/ml的10%胎牛血清DMEM F12培养液)、Ⅱ (含胰岛素10μg/ml的10%胎牛血清DMEM F12培养液)培养2 d,去除分化液后再用含10%胎牛血清的DMEM F12细胞培养液培养细胞,至其成熟。以加分化液Ⅰ起,标记脂肪细胞为分化0 d,以此类推,分化8 d时3T3-L1细胞已基本达成熟状态。
油红O染色观察细胞内脂滴变化 将细胞培养于6孔板,细胞培养至分化4 d时,加入含不同浓度的雷帕霉素 (0、50、100、200 nmol/L)的10% 胎牛血清DMEM F12培养液,每2天换1次含药物的培养液,分化8 d时用于做油红O染色,显微镜下观察、照相。
高效液相色谱分析细胞内胆固醇的变化 分化8 d时细胞成熟,用0.1 mol/L NaOH 200 μl反复冻融裂解细胞,平均分成2份,移入2支玻璃安珀内,分别用于总胆固醇和游离胆固醇检测,按照北京医院老年病研究所胆固醇检测方法[12]对样品进行预处理,上样于高效液相色谱仪,进样30 μl,流动相为乙腈∶异丙醇 (90∶10),流速1 ml/min,紫外250 nm检测。将标准溶液浓度对胆固醇/内标峰面积比进行线性回归,得回归方程。样品/内标峰面积比代入方程计算浓度,用蛋白浓度校正,单位为mg/g蛋白。以各组与对照组胆固醇浓度的比值进行统计学分析。
3T3-L1前脂肪细胞分泌功能的检测 细胞培养在24孔板中,到分化8 d时收集细胞培养上清液600 μl,-80℃冻存。按照脂联素、瘦素的ELISA试剂盒说明书进行样本处理,酶标仪450 nm波长处检测,用630 nm纠正;绘制标准曲线,以浓度的对数为横坐标,光密度值/标准浓度光密度值为纵坐标,在对数坐标轴上绘制一条标准曲线,根据标准曲线得出各个样品的脂联素或瘦素的浓度,再进行统计学分析。
实时荧光定量PCR法分析3T3-L1细胞PPARγ mRNA的表达 至分化8 d时细胞成熟,收集细胞提取RNA,逆转录后做实时荧光定量PCR检测,酶激活95℃ 3 min,扩增反应:95℃ 15 s变性,退火60℃ 15 s,延伸72℃ 15 s,40个循环。引物序列为PPARγ:正 义 链 5'-CCCTACCCACTTCCATTCCC-3'反义链 5'-CGATATTCACGATCACGGCTT-3';β-actin:正义链 5'-CATGTACGTTGCTATCCAGGC-3',反 义 链 5'-CTCCTTAATGTCACGCACGAT-3'。
Western blot方法分析3T3-L1细胞PPARγ的蛋白表达 至分化8 d时细胞成熟,收集细胞提取总蛋白30μg进行聚丙烯酰胺凝胶电泳,将电泳分离后蛋白转移至硝酸纤维素膜上,经封闭后加入PPARγ(1∶500)兔抗鼠多克隆抗体,用 β-actin(1∶1000)抗体做内参,4℃孵育过夜,洗膜后用二抗 (1∶4000)室温孵育1 h,电化学发光法显影,用Image-Pro Plus图像分析软件分析蛋白条带的积分光密度值 (integrated optical density,IOD),IOD=平均光密度值×面积,以PPARγ IOD/β-actin IOD的比值反映蛋白相对表达水平。
阻断或激活PPARγ对3T3-L1细胞PPARγ表达的影响 将细胞培养于6孔板,细胞培养至分化4 d时,分为雷帕霉素100 nmol/L、PPARγ阻断剂GW966210 μmol/L、PPARγ 增敏剂曲格列酮 (troglitazone,TZD)10 μmol/L处理组,用Western blot方法和实时荧光定量PCR方法测定细胞内PPARγ蛋白和mRNA的表达,高效液相色谱法定量分析各组胆固醇浓度,ELISA法分析各组上清液中瘦素表达量变化。
统计学处理 用SPSS 17.0统计软件进行统计分析,各组实验独立重复3次,所有数据以均数±标准差表示,差异显著性检验采用单因素方差分析,两组间比较用t检验。P<0.05为差异具有统计学意义。
结 果
细胞内脂滴变化 雷帕霉素0、50、100、200 nmol/L处理3T3-L1细胞4 d后做油红0染色,显示雷帕霉素在50~200 nmol/L浓度内均能抑制3T3-L1细胞内脂质的形成 (图1)。

图1 油红O染色显示不同浓度雷帕霉素处理细胞成熟后蓄积脂滴的变化 (×400)Fig 1 Oil red O staining shows the changes of cholesterol accumulation after treatment with different concentration of rapamycin(×400)
胆固醇含量 对照组、雷帕霉素50、100、200 nmol/L组细胞内游离胆固醇含量分别为 (12.89±0.16)、(9.84±0.45)、(9.39±0.46)和(8.61±0.34)mg/ml,与对照组相比,雷帕霉素50、100、200 nmol/L细胞内游离胆固醇蓄积减少 (P<0.05),细胞内总胆固醇含量分别为 (12.91±0.50)、(9.94±0.96)、(10.45±2.51)和 (9.53±0.63)mg/ml,与对照组相比,雷帕霉素50、100、200 nmol/L组细胞内总胆固醇蓄积减少 (P<0.05),50、200 nmol/L组差异亦有统计学意义 (P<0.05)。
瘦素、脂联素的分泌 对照组、雷帕霉素50、100、200 nmol/L组瘦素分泌量分别为 (19.02±0.52)、(16.98±0.11)、(15.62±0.01)、(13.84±0.66)ng/ml,与对照组相比,雷帕霉素能减少成熟后3T3-L1脂肪细胞瘦素的分泌水平 (P<0.05);对照组、雷帕霉素50、100、200 nmol/L组脂联素分泌量分别为 (0.093±0.003)、(0.088±0.031)、(0.078±0.005)、 (0.078±0.016)ng/ml,与对照组相比,雷帕霉素未影响脂联素分泌水平 (P>0.05)。
PPARγ mRNA的表达 在作用3T3-L1细胞96 h后,雷帕霉素50、100及200 nmol/L组PPARγ mRNA表达量分别为对照组的 (0.93±0.14)、(0.62±0.10)和 (0.47±0.19)倍,均较对照组降低 (P<0.05),其中200 nmol/L作用最明显。
PPARγ蛋白的表达 在作用3T3-L1细胞96 h后,雷帕霉素50、100及200 nmol/L组PPARγ蛋白表达量分别为对照组的 (0.80±0.12)、(0.74±0.11)和 (0.61±0.10)倍,均较对照组降低 (P<0.05)(图2)。
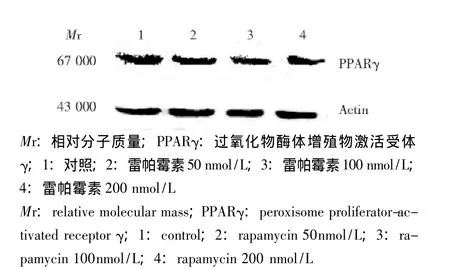
图2 Western blot分析不同浓度雷帕霉素处理组3T3-L1细胞内PPARγ的蛋白表达Fig 2 Western blot shows the protein expression of PPARγ in 3T3-L1 cells after treatment with different concentrations of rapamycin
阻断或激活PPARγ对3T3-L1细胞PPARγ表达的影响 雷帕霉素100 nmol/L、PPARγ阻断剂GW966210 μmol/L、PPARγ 增敏剂 TZD 10 μmol/L 分别处理细胞96 h,检测PPARγ mRNA的表达,分别为对照组的(0.60±0.14)、(0.67±0.03)和 (1.30±0.14)倍,与对照组相比,差异具有统计学意义 (P<0.05)。各处理组PPARγ蛋白表达与 mRNA的表达变化趋势相似,雷帕霉素 100 nmol/L、PPARγ阻断剂GW966210 μmol/L、PPARγ 增敏剂 TZD 10 μmol/L处理组细胞内PPARγ蛋白表达,分别为对照组的(0.74±0.11)、(0.57±0.23)和 (1.91±0.12)倍,与对照组相比,差异具有统计学意义 (P<0.05)(图 3)。
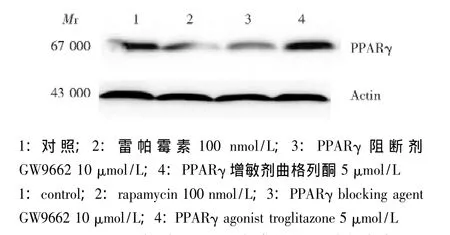
图3 Western blot检测PPARγ阻断或激活后蛋白的表达Fig 3 Western blot shows the PPARγ protein expression after 3T3-L1 is treated with PPARγ agonist or blocking agent
阻断或激活PPARγ对3T3-L1细胞脂质蓄积量的影响 对照组、雷帕霉素100 nmol/L、PPARγ阻断剂GW966210 μmol/L、PPARγ 增敏剂 TZD 10 μmol/L 分别处理细胞96 h,高效液相色谱测定各组总胆固醇量分别为 (12.91±0.50)、(10.45±2.52)、(11.88±0.55)和 (13.27±0.71)mg/ml,游离胆固醇量分别为 (12.89±0.16)、 (9.39±0.46)、 (11.09±0.11)和 (11.83±0.47)mg/ml,与对照组相比,差异具有统计学意义 (P<0.05)。
阻断或激活PPARγ对3T3-L1细胞分泌瘦素的影响 对照组、雷帕霉素100 nmol/L、PPARγ阻断剂 GW966210 μmol/L、PPARγ 增敏剂 TZD 10 μmol/L分别处理细胞96 h,ELISA检测各处理组瘦素表达量分别为 (19.02±0.52)、(15.62±0.10)、(14.45±1.01)和 (18.07±0.66)ng/ml,与对照组相比,差异具有统计学意义 (P<0.05)。
讨 论
经雷帕霉素的Ⅱ期临床试验验证,雷帕霉素在联合环孢素或者激素类使用时能发挥有效的免疫抑制效应,而且肾毒性、神经毒性小,服用雷帕霉素的患者也不易有糖尿病倾向。然而,高脂血症是雷帕霉素的严重的副作用,大约40%接受雷帕霉素治疗的肾移植患者出现高脂血症,主要表现为胆固醇、三酰甘油在用药期间明显上升,同时伴有载脂蛋白Apo-B100、ApoC-Ⅲ的升高,高血脂一般在患者用药2~3个月后达顶峰,而且具有剂量和浓度依赖性,当患者三酰甘油或胆固醇分别升到0.3或0.2 mg/L时需要利用药物进行控制[13]。雷帕霉素显著延迟血液中低密度、中密度、极低密度脂蛋白的清除,还可以加重神经钙调蛋白抑制剂和类固醇激素诱发的高三酰甘油血症,它使慢性肾脏疾病患者的血脂代谢障碍变得更难处理。有关雷帕霉素引起高脂血症机制的研究尚未深入。
脂肪组织是体内最大的胆固醇储存库,脂肪组织的数目以及脂肪细胞内所含的三酰甘油的量决定了细胞内胆固醇的含量[14]。脂肪细胞内胆固醇的平衡又直接影响到整个机体的胆固醇稳态[15-16],在某些病理状态下脂肪组织细胞数目减少、储存脂质能力降低将造成体内血脂含量的上升。脂肪组织合成多种载脂蛋白、脂蛋白受体,也是脂蛋白脂酶合成的主要部位,是血脂代谢调控的重要枢纽。细胞水平研究显示,雷帕霉素能减少原代培养脂肪细胞内脂滴数量[17]。本研究显示,雷帕霉素能抑制3T3-L1前脂肪细胞分化成熟,雷帕霉素处理组细胞内脂滴变小,脂质总蓄积量减少;定量检测细胞内胆固醇蓄积量显示,游离胆固醇的剂量依赖性地减少,表明雷帕霉素能抑制脂肪细胞脂质蓄积,减少细胞内游离胆固醇含量。
脂肪组织不仅参与能量、脂质代谢,同时是重要的分泌器官,成熟的脂肪细胞可以通过自分泌、旁分泌和内分泌的方式分泌瘦素、脂联素及抵抗素、肿瘤坏死因子、白介素-6、等重要的脂质代谢调节因子。瘦素是成熟脂肪细胞分泌的一种重要激素,通过作用于下丘脑厌食中枢负向调节机体摄食和能量消耗,促进脂肪水解降低体内的血脂水平[18]。瘦素水平与空腹胰岛素水平及体重指数正相关,是1型糖尿病和肥胖的重要生理指标之一,其与ApoB/A1比例有明显相关性,而后者是腹型肥胖及儿童代谢综合征的独立危险因素。瘦素的分泌受磷脂酰肌醇-3激酶信号途径和哺乳动物雷帕霉素靶蛋白复合体-1调控,而雷帕霉素作为mTOR抑制剂,多数作用均是通过抑制mTOR及其下游的p70S6K和4EBP1蛋白实现的。本研究显示,雷帕霉素能剂量依赖性地抑制瘦素的分泌水平。脂联素也是成熟脂肪细胞分泌的调节糖脂代谢的重要激素,脂联素的分泌水平不同于脂肪组织分泌的其他激素,肥胖的患者血清脂联素水平降低,体重减轻后脂联素分泌水平增加。脂联素增加内脏脂肪组织体积与腹型肥胖相关,是代谢综合征的一个重要分子标志物,同时脂联素又有增加胰岛素敏感性、抗动脉粥样硬化及抗炎症的作用。但本研究脂联素的表达水平并未受雷帕霉素的影响,推测脂联素的分泌可能不依赖于mTOR 激酶活性。Blümer等[19]认为脂联素的分泌受磷脂酰肌醇-3激酶活性及酸性溶酶体pH值调节,推测可能脂联素的分泌并不受mTOR信号通路影响。
PPARγ是脂肪细胞分化成熟的关键因子,和转录调节因子 (C/EBP-α)形成正反馈环激活维持脂肪细胞功能的各种酶类直到其分化成熟。本研究在用PPARγ阻断剂GW9662部分阻断 PPARγ的表达后,3T3-L1细胞内蓄积的胆固醇、分泌的瘦素量均减少;而用曲格列酮激动PPARγ脂质的蓄积量和瘦素的表达均有所上升。表明PPARγ影响3T3-L1前脂肪细胞分化成熟及分泌功能。雷帕霉素能剂量依赖性地抑制3T3-L1前脂肪细胞内PPARγmRNA和蛋白的表达且对3T3-L1前脂肪细胞的分化成熟和分泌。
功能的影响与GW9662的作用相似,推测雷帕霉素能通过抑制PPARγ从而减少3T3-L1脂肪细胞内的脂质蓄积及瘦素分泌,而脂肪细胞蓄积脂质减少和分泌瘦素减少均能影响体内血脂平衡,这也为雷帕霉素引起的高脂血症提供一个可能的解释。
[1]Sehgal SN.Rapamune(RAPA,rapamycin,sirolimus):mechanism of action immunosuppressive effect results from blockade of signal transduction and inhibition of cell cycle progression [J].Clin Biochem,1998,31(5):335-340.
[2]Marx SO,Marks AR.Bench to bedside:the development of rapamycin and its application to stent restenosis [J].Circulation,2001,104(8):852-855.
[3]Flechner SM,Goldfarb D,Modlin C,et al.Kidney transplantation without calcineurin inhibitor drugs:a prospective,randomized trial of sirolimus versus cyclosporine [J].Transplantation,2002,74(8):1070-1076.
[4]Keogh A,Richardson M,Ruygrok P,et al.Sirolimus in de novo heart transplant recipients reduces acute rejection and prevents coronary artery disease at 2 years:a randomized clinical trial [J].Circulation,2004,110(17):2694-2700.
[5]Trotter JF,Wachs M,Bak T,et al.Liver transplantation using sirolimus and minimal corticosteroids(3-day taper)[J].Liver Transpl,2001,7(4):343-351.
[6]Shitrit D,Rahamimov R,Gidon S,et al.Use of sirolimus and low-dose calcineurin inhibitor in lung transplant recipients with renal impairment:results of a controlled pilot study[J].Kidney Int,2005,67(4):1471-1475.
[7]Guertin DA,Sabatini DM.An expanding role for mTOR in cancer [J].Trends Mol Med,2005,11(8):353-361.
[8]Fajadet J,Morice MC,Bode C,et al.Maintenance of longterm clinical benefit with sirolimus-eluting coronary stents:three-year results of the ravel trial[J].Circulation,2005,111(8):1040-1044.
[9]Almalla M,Schröder J,Deserno V,et al.Long-term clinical outcome of sirolimus-eluting stent implantation in metabolic syndrome and diabetes [J].J Invasive Cardiol,2010,22(7):317-321.
[10]Fernandez-Bussy S,Akindipe O,Baz M,et al.Sirolimusinduced severe hypertriglyceridemia in a lung transplant recipient[J].Transplantation,2010,89(4):481-482.
[11]Morales JM,Hartmann A,Walker R,et al.Similar lipid profile but improved long-term outcomes with sirolimus after cyclosporine withdrawal compared to sirolimus with continuous cyclosporine [J].Transplant Proc,2009,41(6):2339-2344.
[12]刘蕾,周伟燕,孙春华,等.同位素稀释液相色谱串联质谱法测定血清总胆固醇 [J].中华检验医学杂志,2007,30(3):250-254.
[13]Morrisett JD,Ghada AF,Ron H,et al.Effects of sirolimus on plasma lipids,lipoprotein levels,and fatty acid metabolism in renal transplant patients[J].J Lip Res,2002,43(8):1170-1180.
[14]Brown MS,Goldstein JL.The SREBP pathway:regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor [J].Cell,1997,89(5):331-340.
[15]Dugail I,Le Lay S,Varret M,et al.New insights into how adipocytes sense their triglyceride stores.Is cholesterol a signal[J]?Horm Metab Res,2003,35(4):204-210.
[16]Wu YY,Chiu YS,Chen WY,et al.Long-term administration of rapamycin reduces adiposity,but impairs glucose tolerance in high-fat diet-fed KK/HlJ mice [J].Basic Clin Pharmacol Toxicol,2009,105(3):188-198.
[17]Magun R,Gagnon A,Yaraghi Z,et al.Expression and regulation of neuronal apoptosis inhibitory protein during adipocyte differentiation [J].Diabetes,1998,47(12):1948-1952.
[18]Minokoshi Y,Shiuchi T,Lee S,et al.Role of hypothalamic AMP-kinase in food intake regulation [J].Nutrition,2008,24(9):786-790.
[19]Blümer RM,van Roomen CP,Meijer AJ,et al.Regulation of adiponectin secretion by insulin and amino acids in 3T3-L1 adipocytes[J].Metabolism,2008,57(12):1655-1662.
