咪达唑仑对新生大鼠离体脊髓运动神经元的作用
2011-08-07宦才娟汪萌芽
宦才娟,汪萌芽
(皖南医学院 细胞电生理研究室,安徽 芜湖 241002)
咪达唑仑(Midazolam)是当前临床使用的唯一水溶性苯二氮艹卓(BZ)类药,依剂量的不同而具有镇静、催眠、抗焦虑、抗惊厥、抗癫痫及中枢肌松等作用[1]。咪达唑仑具有起效快、苏醒快,对呼吸和循环功能干扰少,安全有效等特点,是较理想的静脉麻醉药,有广泛的应用前景[2]。尽管临床观察发现静脉注射咪达唑仑显示镇痛作用[3],但有关咪达唑仑镇痛作用中是否涉及对脊髓运动神经元(motoneuron,MN)的影响,目前国内外尚未见研究报道。本文应用细胞内记录技术,观察咪达唑仑对新生大鼠脊髓切片MN的作用。
1 材料与方法
1.1 新生大鼠脊髓切片的制备 取8~14 d龄新生SD大鼠(雌雄不拘,由南京青龙山动物养殖场提供),参照报道方法[4],经乙醚麻醉后行椎板切除术,分离出含腰骶膨大的脊髓节段后,将脊髓用胶水(crazy glue)固定在琼脂块上,再将琼脂块固定于振荡切片机(Vibratome)的冰浴载物浴碟内,用剃须刀片横向切取厚度为400~500 μm的脊髓切片若干,在室温下置于用混合气体(95%O2+5%CO2)饱和的人工脑脊液(ACSF)中孵育、备用。在制备脊髓切片过程中,用0~4℃并经混合气体饱和的ACSF浸浴离体的脊髓节段,整个过程控制在15 min以内。ACSF 的成分为(mmol/L):NaCl 127.0,KCl 1.9,KH2PO41.2,CaCl22.4,MgSO4·7H2O 1.3,NaHCO326.0,Glucose·H2O 10.0,pH 7.4。
1.2 新生大鼠脊髓MN的细胞内记录 新生大鼠脊髓切片于室温下孵育40~60 min后,用吸管移入自制的全浸式记录浴槽,用上、下两个丝网相夹固定,持续灌流经混合气体饱和的ACSF,浴槽中灌流液的温度为室温(22~25℃)。用P-97程控微电极拉制仪(Sutter Instrument Co.,USA)拉制含纤维玻璃微电极,内充3 mol/L乙酸钾,固定于微操纵仪(MP-1,Narishige,Japan)上,将探头(headstage)上的银丝插入电极尾端内,用于胞内电流注入及电位记录。选用尖端阻抗为70~120 MΩ的微电极,在体视显微镜下经微操纵仪对脊髓切片中腹角MN区域进行细胞穿刺。缓慢手动推进微电极,当微电极压在细胞膜上时,通过 Axoclamp-2B微电极放大器(Axon Instrument Inc.,USA)的附设遥控 装置(Buzz)进行触发,引发电极尖端的电磁振荡可使微电极刺入细胞内。记录到的膜电位信号经微电极放大器用桥平衡模式进行放大,桥平衡模式可经同一电极同时进行膜电位记录和电流注入。放大的膜电位信号经Digidata 1200接口(Axon Instrument Inc.,USA)输入计算机,用pClamp 7.0软件(Axon Instruments Inc.,USA)进行采样、记录并保存。
1.3 电刺激方法 细胞内电流注射:在微机内由pClamp 7.0 软件(Axon Instruments Inc.,USA)程序设定,由微机触发,信号经Digidata 1200联机接口输入微电极放大器后,刺激电流由探头输出经微电极注入细胞内。
腹外侧索(VLF)、背根(DR)及腹根(VR)电刺激:由三通道电刺激器(Nihon Kohden,Japan)产生的方波脉冲分别经刺激器中一个通道输出,经隔离器(Nihon Kohden,Japan)以恒压模式至同芯双极刺激电极(Frederick Haer& Co.,USA)。刺激电极尖端放置到脊髓切片的腹外侧索区、背根和腹根残端上,用于激活下行、背根传入和腹根纤维。
1.4 给药方法 咪达唑仑注射液(徐州恩华药业有限公司),实验时临时用ACSF配制成所需浓度0.1、0.3、1.0 mmol/L,由恒流泵灌流给药,全程用混合气体饱和,灌流用药的前后条件(如灌流的速度与温度等)保持一致。每种浓度灌流15 min,最后用ACSF洗脱。
1.5 分析方法 记录到的资料,用pClamp 8.0中的 Clampfit 8.1 软件(Axon Instruments Inc.,USA)进行处理,数据分析用Origin 5.0软件。数据以±s表示,统计学显著性检验采用配对t检验,P<0.05为有显著性意义。
2 结果
选取静息电位(resting potential,RP)负于-60 mV且动作电位有超射,记录稳定的细胞,通过加在腹根残端上的同芯双极刺激电极进行逆行激活鉴定,若记录到具有全或无特点的动作电位(逆行AP)或碰撞试验阳性,即鉴定为MN,并进行如下实验和分析。
2.1 咪达唑仑对MN电学特性的影响 在5个MN,给予0.1 ~1.0 mmol/L的咪达唑仑累积灌流每一浓度各15 min,观察用药前后膜电生理参数,结果见表1。可见咪达唑仑产生浓度依赖性去极化作用(配对 t测验,P <0.05 或 P <0.01),在 0.3 mmol/L浓度作用时斜率电阻的增大有显著性意义(n=5,P <0.05),作用可逆。
2.2 咪达唑仑对MN动作电位的影响 对5个诱发出动作电位的MN,给予0.1~1.0 mmol/L的咪达唑仑累积灌流各15 min,结果显示动作电位的幅度和超射值随着浓度的增加而逐渐降低,1.0 mmol/L的咪达唑仑完全取消了动作电位的发放(表1、图1)。
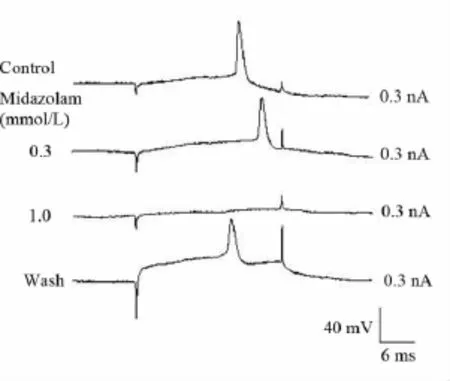
图1 咪达唑仑可逆性并浓度依赖性抑制MN的动作电位Fig 1 Reversibly and concentration-dependently inhibitory action of midazolam on action potential in a MN in vitro.RP was-73 mV
表1 咪达唑仑对MN电生理参数的影响(±s,n=5)Tab 1 Effects of midazolam on electrophysiological properties of neonatal rat spinal cord MNs in vitro(±s,n=5)
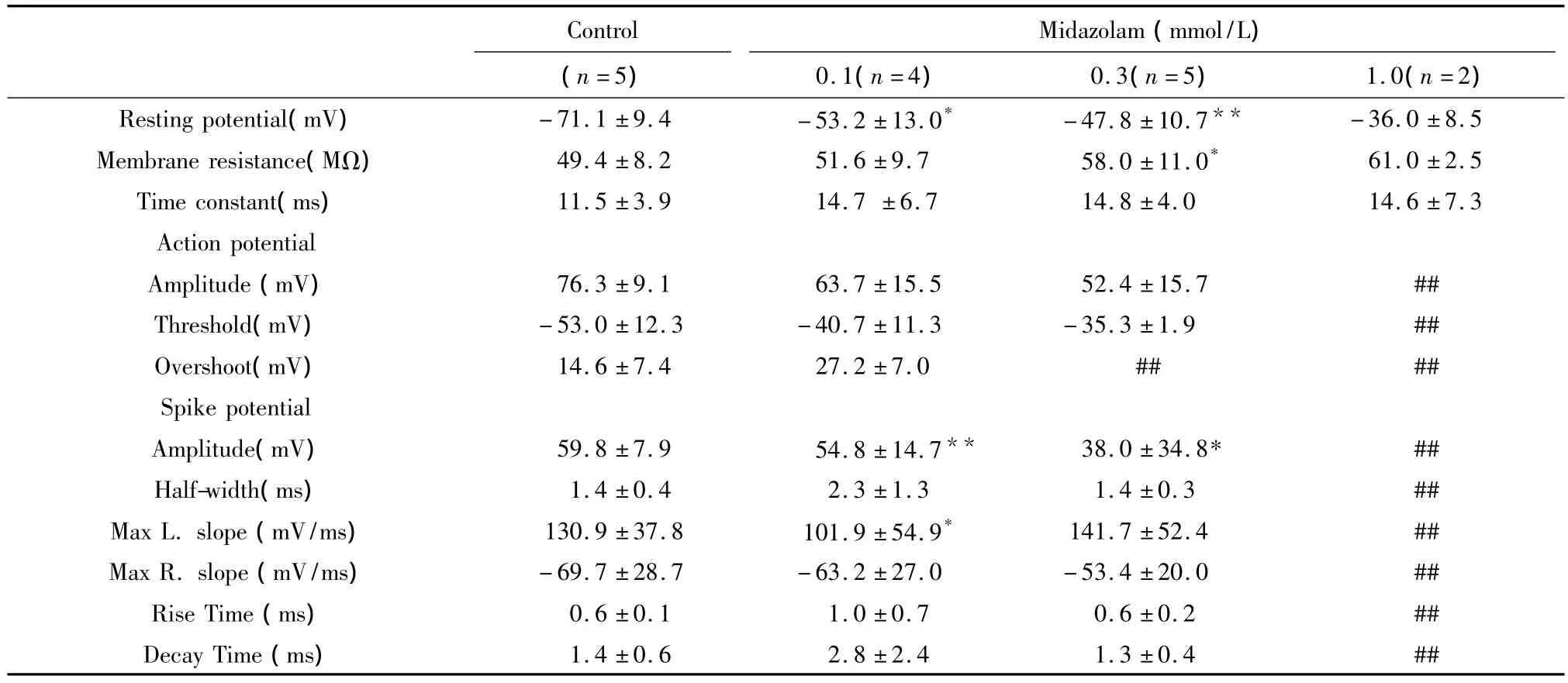
表1 咪达唑仑对MN电生理参数的影响(±s,n=5)Tab 1 Effects of midazolam on electrophysiological properties of neonatal rat spinal cord MNs in vitro(±s,n=5)
与对照组比较:*P <0.05,** P <0.01,## 完全取消
Control Midazolam(mmol/L)(n=5) 0.1(n=4) 0.3(n=5) 1.0(n=2)Resting potential(mV) -71.1 ±9.4 -53.2 ±13.0* -47.8 ±10.7**1.4 ±0.6 2.8 ±2.4 1.3 ±0.4 ##-36.0 ±8.5 Membrane resistance(MΩ) 49.4 ±8.2 51.6 ±9.7 58.0 ±11.0* 61.0 ±2.5 Time constant(ms) 11.5 ±3.9 14.7 ±6.7 14.8 ±4.0 14.6 ±7.3 Action potential Amplitude(mV) 76.3 ±9.1 63.7 ±15.5 52.4 ±15.7 ##Threshold(mV) -53.0 ±12.3 -40.7 ±11.3 -35.3 ±1.9 ##Overshoot(mV) 14.6 ±7.4 27.2 ±7.0 ## ##Spike potential Amplitude(mV) 59.8 ±7.9 54.8 ±14.7** 38.0 ±34.8* ##Half-width(ms) 1.4 ±0.4 2.3 ±1.3 1.4 ±0.3 ##Max L.slope(mV/ms) 130.9 ±37.8 101.9 ±54.9* 141.7 ±52.4 ##Max R.slope(mV/ms) -69.7±28.7 -63.2 ±27.0 -53.4±20.0 ##Rise Time(ms) 0.6 ±0.1 1.0 ±0.7 0.6 ±0.2 ##Decay Time(ms)
2.3 咪达唑仑对MN动作电位发放频率的影响对实验中记录到的MN给予不同强度(0.1~1.3 nA,300 ms)的细胞内去极化脉冲,大部分MN的放电频率呈现与电流强度相关性升高(I-F关系曲线),对于其中 5 个 MN 给予 0.1、0.3 mmol/L 咪达唑仑灌流,观察到MN的I-F关系曲线右移、斜率降低(图 2),其中 0.3 mmol/L 咪达唑仑对 0.2 ~0.6 nA时的放电频率抑制有统计学意义(n=5,P<0.05),说明咪达唑仑浓度依赖性抑制MN的动作电位发放频率。
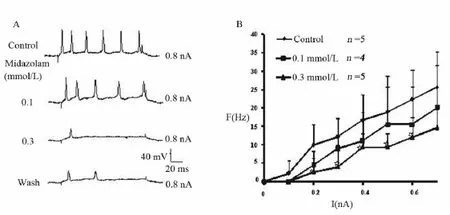
图2 咪达唑仑对MN动作电位发放频率的影响Fig 2 Effects of midazolam on current intensity-firing frequency(I-F)in a MN
2.4 咪达唑仑对MN背根兴奋性突触后电位的影响 在记录到背根电刺激诱发出兴奋性突触后电位(DR-EPSP)的4 个 MN,给予0.1 ~ 1.0 mmol/L 的咪达唑仑各累积灌流15 min,观察到咪达唑仑对DR-EPSP呈现可逆性抑制作用(图3、表2),其中0.1 mmol/L的咪达唑仑的抑制作用有显著性统计学意义(n=3,P <0.05),并呈浓度依赖性特征(图4)。另外,在记录到DR-EPSP合并抑制性突触后电位(DR-IPSP)的3个 MN,给予 0.1 ~ 1.0 mmol/L咪达唑仑各累积灌流15 min,随着浓度增大DR-EPSP逐渐被抑制,而 DR-IPSP的幅度增大,但在1.0 mmol/L浓度DR-IPSP也被完全取消,作用可被ACSF部分洗出。一个细胞的典型记录例示于图5。
表2 咪达唑仑对MN DR-EPSP的影响(±s,n=4)Tab 2 Effects of midazolam on DR-EPSP of rat spinal cord MNs in vitro(±s,n=4)
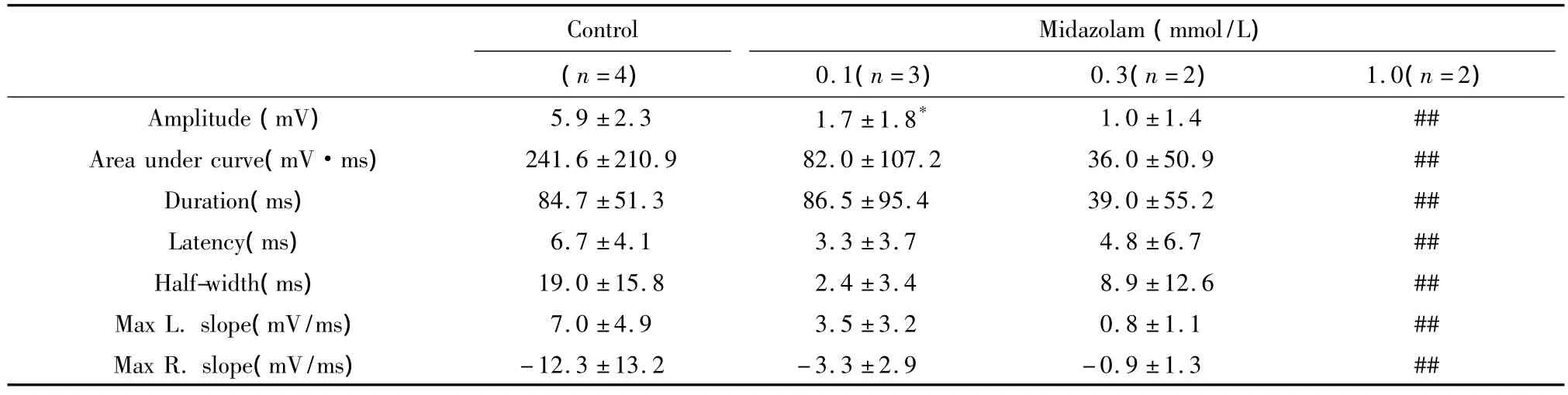
表2 咪达唑仑对MN DR-EPSP的影响(±s,n=4)Tab 2 Effects of midazolam on DR-EPSP of rat spinal cord MNs in vitro(±s,n=4)
与对照组比较:*P<0.05,##完全取消
Control Midazolam(mmol/L)(n=4) 0.1(n=3) 0.3(n=2) 1.0(n=2)Amplitude(mV) 5.9 ±2.3 1.7 ±1.8*-12.3 ±13.2 -3.3 ±2.9 -0.9 ±1.3 ##1.0 ±1.4 ##Area under curve(mV·ms) 241.6 ±210.9 82.0 ±107.2 36.0 ±50.9 ##Duration(ms) 84.7 ±51.3 86.5 ±95.4 39.0 ±55.2 ##Latency(ms) 6.7 ±4.1 3.3 ±3.7 4.8 ±6.7 ##Half-width(ms) 19.0 ±15.8 2.4 ±3.4 8.9 ±12.6 ##Max L.slope(mV/ms) 7.0 ±4.9 3.5 ±3.2 0.8 ±1.1 ##Max R.slope(mV/ms)
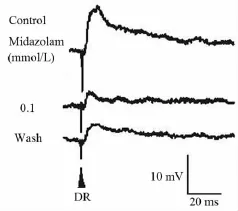
图3 咪达唑仑(0.1 mmol/L)对MN DR-EPSP的可逆性抑制作用Fig 3 Reversible action of midazolam(0.1mmol/L)on DR-EPSP in a MN in vitro
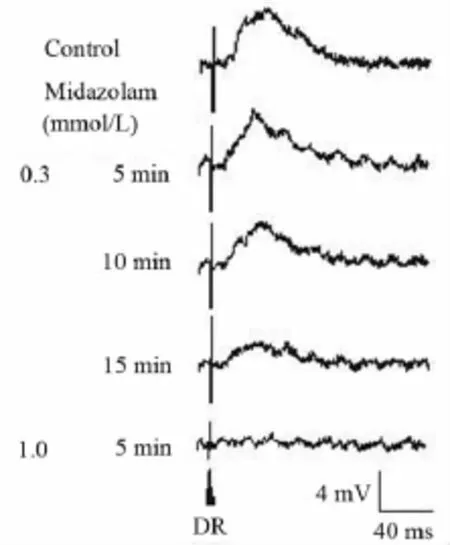
图4 咪达唑仑(0.3,1.0 mmol/L)浓度依赖性抑制 MN的DR-EPSPFig 4 Concentration-dependently inhibitory action of midazolam on DR-EPSPs in a MN in vitro
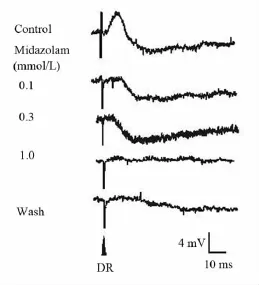
图5 不同浓度咪达唑仑对MN DR-EPSP复合DR-IPSP的作用Fig 5 Effects of midazolam on DR-EPSP and DR-IPSP in a MN in vitro
3 讨论
本实验运用细胞内记录技术,观察到咪达唑仑对新生大鼠脊髓切片MN膜电学性质、动作电位和电刺激背根产生的DR-EPSP均具有可逆性抑制作用,这可能与咪达唑仑增强GABAA受体活性、阻断Na+通道等作用有关。
咪达唑仑是临床上常用的一种苯二氮艹卓类(BZ)静脉麻醉药,BZ受体是GABAA受体主要识别位点之一,位于神经元的突触膜上,与GABAA受体相邻并耦联于共同的Cl-通道。与异丙酚复合应用于手术病人全身麻醉[5],具有良好的镇静作用。目前认为其麻醉作用的分子机制与神经细胞膜上离子通道的活性变化有关[6]。多年来,γ-氨基丁酸(GA-BA)受体及其门控的Cl-通道复合物一直是全麻机制的研究焦点。BZ类药物可与其相应位点结合,使受体发生变构,促进GABA与低亲和力的GABA位点结合起到增强抑制的效果[7]。在对中枢神经系统的抑制作用中,有研究[8]显示咪达唑仑与GABAA受体复合体中的BZ位点结合数目越多,其药理作用也越强,原因可能是咪达唑仑与BZ受体结合后增强GABA与GABAA受体结合,使神经元上Cl-通道开放,促使Cl-内流,形成神经细胞膜的超极化状态,从而减少了神经元的兴奋性递质的释放,同时抑制了脑内神经突触对GABA的重摄取。由此可见,本文观察到咪达唑仑抑制脊髓MN的DR-EPSP的作用,可能是咪达唑仑作用于GABAA受体的结果,特别是在低浓度时,既抑制DR-EPSP又增强DR-IPSP的结果,为此提供了直接的证据。
在我们的实验中,咪达唑仑对脊髓MN的膜电生理特性有影响,能引起去极化反应,并有抑制AP的幅度的趋势,同时对刺激脊髓背根产生的EPSP具有明显的抑制作用。有关高浓度咪达唑仑同时可取消动作电位、DR-EPSP和DR-IPSP的作用,显然不可能是增强GABAA受体作用所致。已有研究表明临床浓度的咪达唑仑对交感神经元钠通道电流具有抑制作用[9]。也有研究[10]表明咪达唑仑对Ca2+和K+通道具有抑制作用。本文观察到咪达唑仑对细胞内去极化电流刺激诱发的动作电位具有浓度依赖性抑制作用,在高浓度完全取消动作电位的发放,结合高浓度咪达唑仑也完全取消DR-IPSP的作用,表明高浓度咪达唑仑的作用,至少涉及Na+通道的阻断作用。
咪达唑仑与异丙酚已经被广泛联合运用于临床麻醉中,两药联合运用既可确保患者产生镇静-遗忘效应,又有利于减少各自的用量,降低药物不良反应[11],而我们实验室前期的研究显示临床浓度异丙酚对离体脊髓运动神经元有抑制作用,且认为高浓度时通过直接抑制谷氨酸受体而起作用[12]。结合本文对咪达唑仑作用的观察,提示咪达唑仑可能在MN靶点上与异丙酚有协同作用,其具体机制仍需进一步研究。
[1]REVES JG,FRAGEN RJ,VINIK HR,et al.Midazolam:pharmacology and uses[J].Anesthesiology,1985,62(3):310 -324.
[2]刘金川,陈文彬,姚尚龙.咪唑安定药理学特点及其临床应用研究进展[J].中国热带医学,2004,4(3):485 -486.
[3]GOODCHILD CS,NOBLE J.The effects of intrathecal midazolam on sympathetic nervous system reflexes in man—a pilot study[J].Br J Clin Pharmacol,1987,23(3):279 -285.
[4]汪萌芽.新生大鼠脊髓切片运动神经元的电生理参数测定[J].中国应用生理学杂志,1993,9(2):164-167.
[5]O'SHEA SM,WONG LC,HARRISON NL.Propofol increases agonist efficacy at the GABAAreceptor[J].Brain Res,2000,852(2):344-348.
[6]夏梦,于布为.作用于GABA-R的静脉麻醉药(异丙酚与咪唑安定)之间相互作用的研究进展[J].国外医学麻醉学与复苏分册,2003,24(4):231 -234.
[7]KOHNO T,KUMAMOTO E,BABA H,et al.Actions of midazolam on GABAergic transmission in substantia gelatinosa neurons of adult rat spinal cord slices[J].Anesthesiology,2000,92(2):507 -515.
[8]PARK JS,HIGASHI H,NAGATA K,et al.Bicuculline-resistant,Cldependent GABA response in the rat spinal dorsal horn[J].Neurosci Res,1999,33(4):261 -268.
[9]郑吉建,庄心良,刘宝刚,等.咪唑安定对交感神经元全细胞钠通道电流的抑制作用[J].中国临床药理学与治疗学,2000,5(2):108-111.
[10]YAMAKAGE M,MATSUZAKI T,TSUJIGUCHI N,et al.Inhibitory effects of diazepam and midazolam on Ca2+and K+channels in canine tracheal smooth muscle cells[J].Anesthesiology,1999,90(1):197-207.
[11]许继元,李茂琴,张舟,等.咪唑安定和丙泊酚联用对危重患者镇静-遗忘作用的研究[J].中国危重病急救医学,2008,20(8):449-451.
[12]CHENG LZ,WANG MY.Effects of propofol on glutamate-induced responses in motoneurons of neonate rat spinal cord slices.2005 Abstract Viewer/Itinerary Planner.Washington,DC:Society for Neuroscience,2005,No.158.14,Online.
