白菜类作物氮利用效率的关联分析
2011-08-07林良斌李石开丁建明王晓武武
翟 文 林良斌 李石开 丁建明 汪 骞 程 锋 王晓武武 剑*
(1云南农业大学农学与生物技术学院,云南昆明 650201;2中国农业科学院蔬菜花卉研究所,北京 100081;3云南省农业科学院园艺作物研究所,云南昆明 650205;4东北农业大学,黑龙江哈尔滨 150030)
作物正常生长发育依赖于养分的充足供应,而氮肥作为大量使用的元素是农业生产中重要的增产因子之一(Masclaux-Daubresse et al.,2010),随着氮肥用量的不断增加,在提高产量的同时,传统的蔬菜施肥管理模式容易造成生产成本增加、水肥浪费、土壤养分比例失调、蔬菜硝酸盐累积、地下水资源严重污染等一系列问题(Loudet et al.,2003),这些问题越来越受到人们的关注。关联作图是一种利用连锁不平衡(Linkage disequilibrium,LD)检测自然群体中基因位点及其等位变异的方法。关联分析曾经被广泛应用于人类遗传学(March,1999),目前关联分析已应用于玉米、水稻、拟南芥等植物关于氮利用效率的遗传研究(Flint-Garcia et al.,2005;Atwell et al.,2010;Huang et al.,2010),但在蔬菜的氮利用上还鲜见报道。
白菜类作物是我国重要的栽培蔬菜,其生长迅速、生长期短、产量高、需肥量较大,生产中氮肥用量过大是一个普遍存在的问题。本试验以 160份有代表性的白菜类作物品系组成的自然群体为试材,找出其优异位点和相应的等位变异,进而发掘出具有优异等位变异的载体品种,提高白菜类作物的氮利用效率,改善氮肥利用、解决氮素损失问题。
1 材料与方法
1.1 试验材料
选取不同来源的160份白菜类作物种质材料组成一个具有广泛代表性的自然群体,包括23份芜菁、62份蔬菜类型、75份油用类型。
1.2 试验方法
2009年10月在云南省昆明市西山区选取相对贫瘠的土地播种146份材料,均匀随机地在10个地点选取土样检测,pH值7.15,有机质含量46.36 mg·kg-1,氮百分比含量为0.229,符合标准试验要求。随机区组设计,2个氮水平处理:26 g·m-2和0 g·m-2,分别用N+和N-表示,每处理3次重复,每重复6株1小区,每小区选取长势均一的3株调查表型性状,在播种后80 d测量株高、叶片数、叶长、叶宽、叶面积、单叶质量;每小区选取1株在播种后80 d测量生物总量,播种后180 d测量生物总量、种子产量和氮含量。
2010年10月在中国农业科学院蔬菜花卉研究所玻璃温室内进行盆栽试验,播种158份材料,选用氮素含量很低的草炭、蛭石(1V∶1V)为基质,pH为5.5~5.9,硝态氮(NO3-)含量为34.6 mg·kg-1。每周用营养液(Loudet et al.,2003)浇灌,2个氮水平处理:10 mmol·L-1(N+)和3 mmol·L-1(N-)。氮总投入量分别是正常氮(N+):KNO3-0.88 g·株-1、CaNO3-1.03 g·株-1;低氮(N-):KNO3-0.35 g·株-1、CaNO3-0.21 g·株-1,每处理4次重复。播种后50 d测量株高、叶片数、单叶质量、叶长、叶宽、叶面积和开展度。
株高为植株最高的营养生长叶片的位置到根部以上的长度;开展度为地上部分所形成的最大宽度;总生物量为植株地上部和地下部的生物总量;叶片形态取植株从外到内第 3片真叶扫描,称取叶片的单叶质量,使用 LA-S全能型植物图像分析系统软件分析扫描的图片,测量叶长、叶宽、叶面积;用于扫描的叶片烘干送云南农业大学环境科学实验室检测氮含量,检测方法为H2SO4混合加速剂蒸馏法(鲁如坤,2000)。
1.3 表型性状的遗传变异及相关性分析
采用SPSS 10.0软件对各性状进行基本的统计分析,用每份材料均值进行不同氮处理之间各性状方差分析(ANOVA)。

式中,TN+表示正常供氮条件下的性状均值,TN-表示低氮胁迫下的性状均值。
1.4 InDel标记全基因组扫描
选取苗期的幼嫩叶片,用抽真空冷冻干燥机干燥,研磨至粉末状保存。DNA提取方法参照改良CTAB法(Pritchard et al.,2000),随机选取8份材料为筛选引物的样本,由中国农业科学院蔬菜花卉研究所生物技术实验室提供的分布于白菜基因组10条染色体的500对InDel标记进行引物筛选,选择多态性较好、基因组分布均匀的178对引物进行群体基因分型。InDel反应体系(20 uL):15 ng·μL-1模板 DNA 5 μL,2.5 U·μL-1Taq酶 0.4μL,10×buffer 2.0 μL,5 pmoL·μL-1上游引物 0.4 μL,5 pmoL·μL-1下游引物 0.4 μL,2.5 mmol·μL-1dNTP 1.6 μL,ddH2O 10.4 μL。反应程序:94 ℃预变性5 min,94 ℃变性40 s,57 ℃退火40 s,72 ℃延伸40 s,35个循环;72 ℃延伸5 min;16 ℃保存。PCR扩增产物用8%聚丙烯酰胺凝胶电泳检测。
1.5 连锁不平衡(LD)的衡量与群体遗传结构分析
使用标准不平衡系数(D')衡量位点间 LD(Flint-Garcia et al.,2003),应用Edward Buckler Lab开发的软件包TASSEL计算LD配对检测的矩阵图,用于观测共线及非共线标记之间的LD排列。
应用STRUCTURE软件(Pritchard et al.,2000)对白菜类作物自然群体做群体结构分析。使用混合模型群体数目(K值)从 2~8模拟群体结构,并假定全部 207个变异位点都是独立的。MCMC(Markov Chain Monte Carlo)设置10万次迭代,初始burn-in次数为10万。基于数学模型确定群体分组和个体分配,并计算相应的Q值。
观察组治疗后TNF-α、IL-1、SOD、MDA、NT-proBNP较对照组明显改善,两组差异有统计学意义(P<0.05)。
1.6 关联分析
采用 TASSEL2.0软件(Abdurakhmonov & Abdukarimov,2008)的 GLM(General Linear Model)程序,以各Q值作为协变量进行群体矫正,将10个性状的表型数据分别与标记变异进行回归分析。
2 结果与分析
2.1 不同氮处理下表型性状的遗传变异
两年统计结果如表1所示,160份种质材料(包括11个亚种或变种:芜菁、白菜型油菜、结球白菜、普通白菜、菜薹、意大利菜心、紫菜薹、乌塌菜、黄籽沙逊油菜、水菜、Komatsuna)各亚种或变种之间除了氮含量外其余性状差异达显著或极显著水平。
2009年云南大田试验中,不同氮处理之间,除了株高和叶片数外,其他各性状在施氮(N+)和不施氮(N-)条件下呈极显著性差异,且施氮处理的植株生长状况优于不施氮处理;株高和叶片数差异不显著可能是相对受氮处理水平影响较小,受环境影响较大。虽然在氮胁迫条件下各表型性状都有一定程度的降低,但各性状受低氮胁迫影响的程度不一样,其中生物量、单叶质量和种子产量降低的幅度较大,氮敏感指数较高。低氮胁迫下,80 d生物总量和180 d生物总量平均值分别为39.83 g和242.03 g,比正常供氮水平降低了29.12%和29.67%;种子产量均值55.18 g,比正常供氮水平降低了29.17%;单叶质量均值4.15 g,比正常供氮水平降低了17.66%。
2010年北京盆栽试验中,单叶质量降低最明显,均值为 1.93 g,比正常供氮水平降低了24.61%;其次是叶面积,均值为49.00 cm2,比正常供氮水平降低了21.23%。由于后期生长势较弱,盆栽试验没有调查后期生物量和种子产量等性状。

表1 不同氮处理下白菜类作物的表型性状
2.2 InDel标记位点之间的连锁不平衡与群体遗传结构分析
10条染色体上207个InDel位点的21 321种两两位点组合中,不论共线性组合,还是非共线性组合,连锁不平衡均不明显。得到统计概率支持的不平衡成对位点比例少,占总位点组合的7.02%;不平衡程度D'>0.5的组合数占总位点组合的17.75%。共线InDel位点D'值随遗传距离增加有明显的衰减。群体结构分析表明,样本的等位变异频率特征类型数 K=5,即样本亚群体的数目为5。
2.3 与表型性状显著相关的等位变异
对2009年云南大田试验调查的10个表型性状以及2010年北京盆栽试验调查的7个性状与标记进行关联分析,标记贡献率均大于0.04,云南和北京的试验分别检测出45个和35个显著性相关的标记,其中4个标记为同一性状两年共定位,平均贡献率为0.06(表2)。
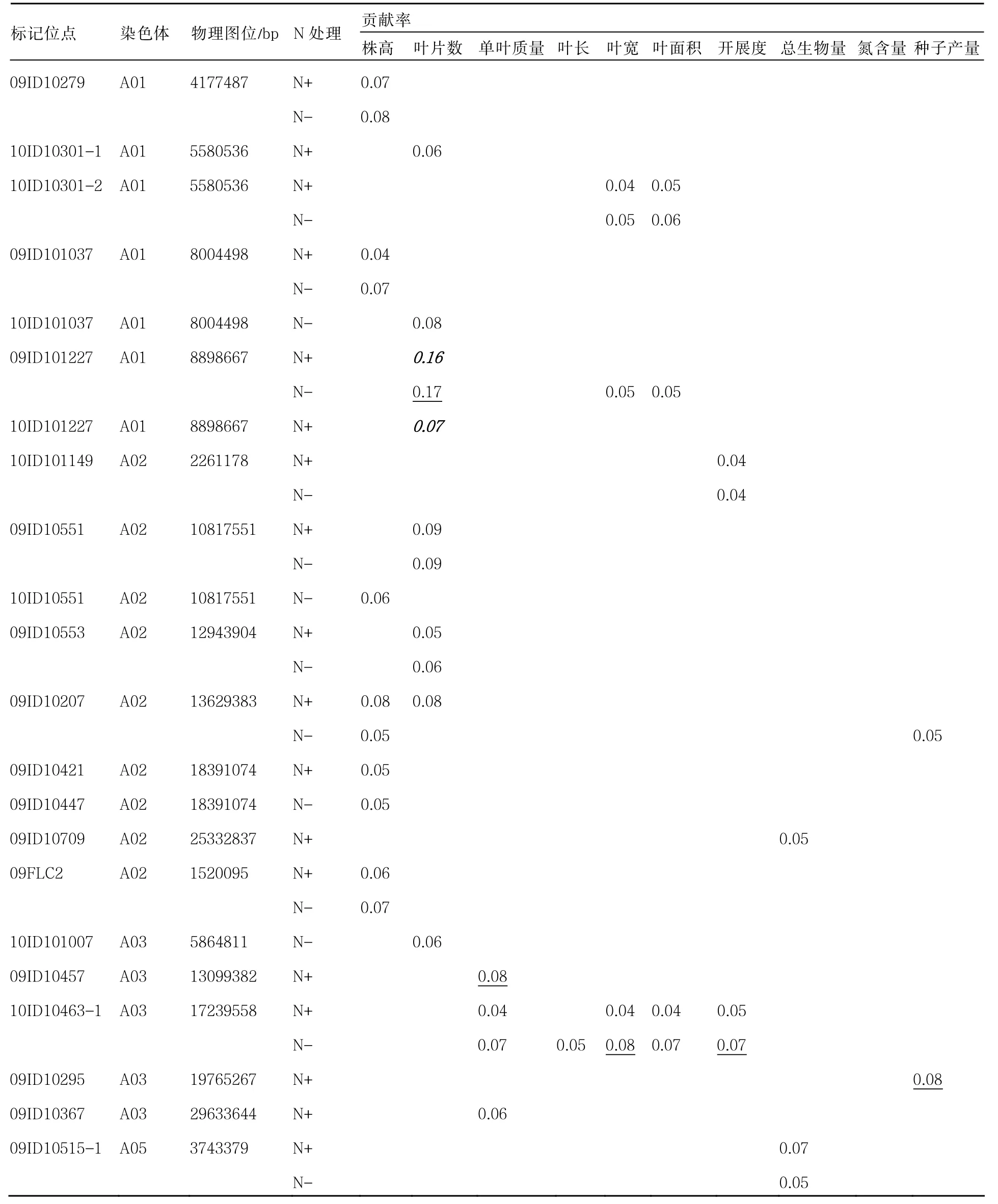
表2 部分重要的显著相关性位点及其对白菜类作物表型变异的贡献率

续 表

续 表
从性状间比较来看,同一位点多个性状相关联情况很普遍,关联到2个以上性状的变异位点共有24个,在染色体A03上有5个性状共定位到10ID1046标记,有3个性状共同定位到A07染色体的09ID10109标记,有可能是一因多效的遗传基础。
株高共检测到33个在不同氮水平下显著关联位点,其中N+条件下17个,在N-条件下有16个,其中贡献率最高的位点是 N-的 09ID10091。ID10581两年都只在 N+条件下检测到,10ID10253位点株高和叶片数在N+条件下共定位,10ID101209在N+条件下被检测到与5个性状相关联,说明这些位点与氮充足条件下表达,而在氮胁迫条件下被抑制的某些基因有关。
叶片数共检测到26个显著性位点,N+条件下有15个,N-条件下有11个,其中ID101227在两年都被定位到,2009年云南大田试验在两个氮水平都有定位,平均贡献率高达0.16,而且与叶面积、叶宽共定位。说明其是植物叶片数目和植物形态生长非常关键的位点。
叶长共检测到14个显著性位点,N+条件下有7个,N-条件下有7个,最高贡献率的位点是N-条件下的09ID10255,而且这个位点在N-水平下在叶面积、单叶质量和总生物量中都被检测到,10ID10487也在叶面积中N-条件下被检测到,说明这两个位点存在氮胁迫条件下高表达的基因,有可能是控制氮利用效率的关键基因。
叶宽共检测到13个显著性位点,N+条件下有6个,N-条件下有7个;叶面积共检测到15个位点,N+条件下有5个,N-条件下有10个,两个性状贡献率最高的位点都是09ID10715,并且都是在N+条件下。说明这个位点在氮充足的情况下控制叶片的形态生长。
种子产量共检测到9个显著性位点,N+条件下有4个,N-条件下有5个,贡献率最高的是位于A03染色体上的09ID10295(N+)和位于A07染色体上的09ID10109(N-),09ID10109也检测到与叶长(N-)和总生物量(N+和 N-)显著关联,在 N-条件下的贡献率高于在 N+条件下。因此推测这个位点存在可能在氮胁迫条件下高效表达的基因,并影响着植物生物量、繁殖能力和植株形态等多个性状,值得进一步的研究和分析。
3 讨论
群体结构指的是一个群体内存在亚群的情况,亚群的混合、自然和人为的选择使整个群体所估计的连锁不平衡(LD)强度增强,可能导致基因多态性位点与性状的相关性并非由功能性等位基因引起,从而显现假阳性结果(Gupta et al.,2005)。因此,进行关联分析前对群体进行结构分析和调节是必要的。
本试验基于少量分子标记(207个位点),只是粗略意义上的全基因组关联分析,目的在于为即将开展的候选基因关联作图做好铺垫。严格意义上的全基因组关联分析需使用高密度标记对全基因组进行扫描。特别是对于白菜类这种常异交植物,LD衰减的距离较短(相对于自花授粉作物拟南芥、水稻、小麦等来说),所需的标记数量更多。
QTL定位方法比较多,本试验所采用关联分析方法,应用TASSEL软件的GLM程序检测表型变异与InDel位点关联的显著性,由于不依赖于遗传图谱进行QTL分析,比较简单直观,可以对作物群体一个基因座的多个变异位点进行分析,且对QTL的检测能力较高。然而该方法的缺陷是不能估计QTL的具体位置及其加性、上位性效应。
基因之间的相互关联和相互影响,会随着环境的压迫和代谢的变化,使一些特殊基因表达可能受到抑制(Kusano et al.,2011),正常氮水平下,为了促进细胞的分裂和增长,植物基因表达量较多,因此植物叶面积增长快,能有更多的叶面积用来进行光合作用,植物生命活动旺盛,基因的表达和代谢都较丰富。由于氮是植物生命活动的必须元素,在N-处理后,出现了一系列分子水平的变化(DNA、RNA、蛋白和代谢),顶端分生组织生长也减缓,某些作为转录因子的基因家族(LBD37/ASL39,LBD38/ALS40和LBD39/ASL41)的表达水平也有所减弱,以维持在低氮环境植物的生存(Rubin et al.,2009;Tschoep et al.,2009),这就能解释为什么在N+条件下检测到的显著性关联位点要比 N-条件下要多,而在 N-条件下还能检测到一些特殊的显著关联位点,这些位点上的相关基因可能就是与氮吸收利用效率有关的,在氮胁迫的条件下保证植物的生长。
选育氮高效利用的白菜类品种是减少氮肥施用量、降低生产成本和环境污染的一种有效途径,但由于氮素利用涉及到多个性状,并且表现出典型的数量性状遗传,利用常规育种方法选择的难度较大,本试验鉴定了一批与氮高效利用有关的QTL位点,有助于利用分子标记辅助选择氮素利用效率。
鲁如坤.2000.土壤农业化学分析方法.北京:中国农业科技出版社:278-285.
Abdurakhmonov I Y,Abdukarimov A.2008.Application of association mapping to understanding the genetic diversity of plant germplasm resources.Int J Plant Genomics,574927.
Atwell S,Huang Y S,Vilhjalmsson B J,Willems G,Horton M,Li Y,Meng D,Platt A,Tarone A M,Hu T T,Jiang R,Muliyati N W,Zhang X,Amer M A,Baxter I,Brachi B,Chory J,Dean C,Debieu M,de Meaux J,Ecker J R,Faure N,Kniskern J M,Jones J D,Michael T,Nemri A,Roux F,Salt D E,Tang C,Todesco M,Traw M B,Weigel D,Marjoram P,Borevitz J O,Bergelson J,Nordborg M.2010.Genome-wide association study of 107 phenotypes inArabidopsis thalianainbred lines.Nature,465:627-631.
Flint-Garcia S A,Thornsberry J M,Buckler E S.2003.Structure of linkage disequilibrium in plants.Annu Rev Plant Biol,54:357-374.
Flint-Garcia S A,Thuillet A C,Yu J,Pressoir G,Romero S M,Mitchell S E,Doebley J,Kresovich S,Goodman M M,Buckler E S.2005.Maize association population:a high-resolution platform for quantitative trait locus dissection.Plant J,44(6):1054-1064.
Gupta P K,Rustgi S,Kulwal P L.2005.Linkage disequilibrium and association studies in higher plants:present status and future prospects.Plant Mol Biol,57(4):461-485.
Huang X,Wei X,Sang T,Zhao Q,Feng Q,Zhao Y,Li C,Zhu C,Lu T,Zhang Z,Li M,Fan D,Guo Y,Wang A,Wang L,Deng L,Li W,Lu Y,Weng Q,Liu K,Huang T,Zhou T,Jing Y,Li W,Lin Z,Buckler E S,Qian Q,Zhang Q F,Li J,Han B.2010.Genome-wide association studies of 14 agronomic traits in rice landraces.Nat Genet,42(11):961-967.
Kusano M,Fukushima A,Redestig H,Saito K.2011.Metabolomic approaches toward understanding nitrogen metabolism in plants.J Exp Bot,62(4):1439-1453.
Loudet O,Chaillou S,Merigout P,Talbotec J,Daniel-Vedele F.2003.Quantitative trait loci analysis of nitrogen use efficiency inArabidopsis.Plant Physiol,131(1):345-358.
March R E.1999.Gene mapping by linkage and association analysis.Mol Biotechnol,13(2):113-122.
Masclaux-Daubresse C,Daniel-Vedele F,Dechorgnat J,Chardon F,Gaufichon L,Suzuki A.2010.Nitrogen uptake,assimilation and remobilization in plants:challenges for sustainable and productive agriculture.Ann Bot,105(7):1141-1157.
Pritchard J K,Stephens M,Donnelly P.2000.Inference of population structure using multilocus genotype data.Genetics,155(2):945-959.
Rubin G,Tohge T,Matsuda F,Saito K,Scheible W R.2009.Members of theLBDfamily of transcription factors repress anthocyanin synthesis and affect additional nitrogen responses inArabidopsis.Plant Cell,21(11):3567-3584.
Tschoep H,Gibon Y,Carillo P,Armengaud P,Szecowka M,Nunes-Nesi A,Fernie A R,Koehl K,Stitt M.2009.Adjustment of growth and central metabolism to a mild but sustained nitrogen-limitation inArabidopsis.Plant Cell Environ,32(3):300-318.
