广东地区发病猪群猪链球菌感染监测及药敏试验
2011-08-07臧莹安李春玲
臧莹安,卢 頔,胡 波,宋 帅,李 淼,李春玲
(1.仲恺农业工程学院动物科学系,广东 广州 510225;2.广东省农业科学院兽医研究所,广东 广州 510640)
猪链球菌病(Swine streptococcsis)是由多种链球菌感染引起的危害养猪业的一种国家规定的二类动物疫病。链球菌虽然抵抗力不强,但由于抗生素的滥用,易产生耐药性,导致治疗失败[1-2]。所以,本试验通过对广东部分地区发病猪群猪链球菌可疑菌进行分离鉴定,进而对其进行药敏试验,为各猪场合理用药提供依据。
1 材料与方法
1.1 仪器 HZQ-X100振荡培养箱,购自哈尔滨市东明医疗仪器厂;电热恒温培养箱,购自上海跃进医疗器械一厂;基因扩增仪,购自杭州博日科技有限公司;稳压稳流电泳仪,购自北京市六一仪器厂;紫外透射分析仪,购自珠海星马医学仪器有限公司。
1.2 试剂 新生牛血清,托-休二氏液体培养基(THB),托-休二氏体培养基(THA),细菌微量生化反应管,药敏纸片和质控菌株,均购自广东环凯微生物科技有限公司。
1.3 实验动物 18~20g雄性昆明系小鼠,购自广东省医学实验动物中心。
1.4 细菌分离培养 将疑似猪链球菌菌株S1~S20接种在THB培养基中,置于37℃振荡培养箱中培养16~18h后,在超净工作台中采用划线分离培养法用接种环挑取菌液接种于血平板上,37℃培养14~16h,经培养无杂菌者,选取α溶血、光滑圆形、半透明、直径1~2mm的小菌落,每个样品挑去3~6个疑似菌落,分别接种3mL THB培养基中,37℃培养16~18h后,仔细观察分离菌经培养后的生长情况,并挑取单个可疑菌落和液体培养物分别作革兰染色镜检。
1.5 生化特性分析 无菌操作,用移液枪分别吸取上述的各分离菌液各100μL于3mLTHB培养液中,置于37℃振荡培养箱中培养16~18h后,分别做生长基水解试验和糖发酵试验。
1.6 药敏试验 按照纸片扩散法[8]操作。对照质控菌株接种于TSB培养基中培养OD600值在0.08~0.1左右时进行药物敏感试验。
1.7 动物试验 将70只清洁级小鼠平均分为7组,其中一组为生理盐水对照组。随机抽取6个分离株先接种普通血平板,37℃培养24h后,挑取单菌落接种含5%犊牛血清的THB培养基中,37℃培养16h。各菌平板法计数后,调整菌液浓度至3×108CFU/mL。每组腹腔接种0.5mL/只。观察记录小鼠临床发病和死亡情况,若出现小鼠死亡,立即剖检。用接种环沾取死亡小鼠心脏、肺和肝脏在血平板上划线,经培养无杂菌者,挑取单个菌落接种于THB培养液中培养16~18h后,仔细观察分离菌的生长情况,并对液体培养物做PCR检测。
1.8 PCR检测 本试验采用的引物序列(5′-3′)是CAGTATTTACCGCATGGTAGATAT,GTAAGATACCGTCAAGTGAGAA。片段大小为294 bp。两个特异性PCR扩增均采用25μL反应体系。在反应管中依次加入10×PCR Buffer 2.5μL、25 mmol/L MgCl22.0μL、2.5mmol/L dNTPs 2.0 μL、10pmol/μL 引物各0.5μL、模板1.0μL、5 U/μLTaq酶0.15μL,再加ddH2O调整终体积至25μL。最后置于PCR扩增仪中经94℃变性5min后进入循环,94℃30s,60℃1min,72℃1.5min,35个循环后72℃保温10min。同时设阴、阳性对照。将得到的PCR产物用1.5%琼脂糖凝胶进行电泳分离,紫外灯下照相记录。
2 试验结果
2.1 细菌分离培养结果 可观察到该菌溶血,呈直径1~2mm的圆形、微突、表面光滑湿润、小菌落形式存在。革兰染色后呈紫色。在液体培养基中呈长链状,一般由8~15个球菌排成链状,无鞭毛,无芽孢,不运动,无荚膜,无两极着色现象。
2.2 生化试验结果 鉴定的菌株生化特性稳定。菌株对蔗糖、乳糖、淀粉、pH值9.6肉汤、葡萄糖磷酸盐胨水等易发酵,对棉子糖、蕈糖、果糖等糖类的发酵,菌株间有差异;对硫化氢、马尿酸钠、枸橼酸盐等无机盐类物质及6.5%高盐肉汤、40%胆汁肉汤、蛋白胨水等不发生反应。
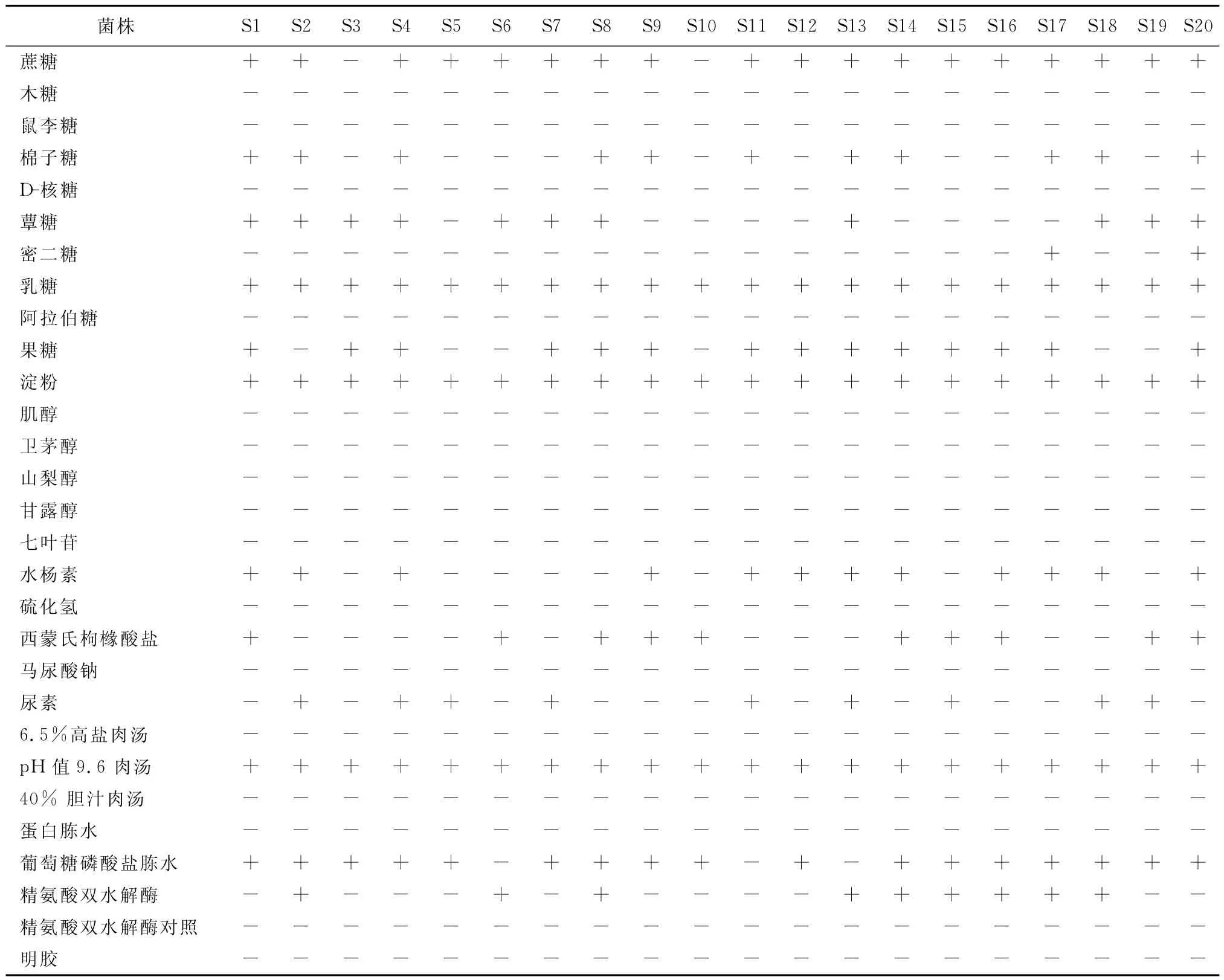
表1 分离菌株生化反应
2.3 动物试验结果
2.3.1 临床症状 攻毒后24h,小鼠表现为被毛松乱,精神委靡,行动迟缓,食欲减退,喜趴伏,聚堆,有的小鼠表现呼吸加快、消瘦等症状。死亡的小鼠全身多个器官充血、淤血,肝脏,肺脏、肾脏等肿大,有黏性渗出物。生理盐水对照组未出现小鼠死亡。
2.3.2 细菌分离和PCR鉴定 死亡小鼠体内肺脏、心、肝脏都可以分离到细菌,细菌菌落形态与接种菌一致,经PCR鉴定为猪链球菌。
2.4 药敏试验结果 由表2可知,20株典型链球菌分离株中大部分对阿莫西林敏感,对先锋霉素Ⅴ、先锋霉素Ⅵ等药物中度敏感,对乙酰螺旋霉素、磺胺异恶唑、复方新诺明、氟苯尼考、洁霉素、四环素、强力霉素产生了耐药性。个别菌株产生了非常普遍的耐药性。

表2 20株猪链球菌分离菌的耐药情况
3 讨论
本试验通过分离细菌的形态观察、生化试验、PCR检测、动物试验等进行可疑菌的综合判定,结果表明,此20株分离菌均为猪链球菌。猪链球菌的生化特性稳定,发病猪群分离株没有明显差别,不同菌株对于个别糖类有利用的区别。生化指标可作为细菌鉴定的一个参考。同时也佐证了PCR方法作为细菌鉴定方法的准确性、精确性。
本试验对从广东部分地区发病猪分离到的20株菌株进行了13种抗生素的耐药性检测,90%~100%的菌株对于大环内酯类/林可胺类、喹诺酮类、四环素类都有耐药性,而部分菌株对青霉素类、头孢类敏感。85%的菌株对于阿莫西林中度敏感。
根据中国兽医药品监察所2005年对从四川不同地区病死猪体内分离得到的猪链球菌2型的药敏试验结果,7个菌株对四环素、土霉素、多西环素和链霉素耐药,对于阿米卡星、新霉素和庆大霉素中度敏感,而对于青霉素、头孢类、氟喹诺酮类、氯霉素类药物等敏感[3-4]。Marie等分别检测了1996~2001年间从法国临床病猪或者不同国家病人体内分离的共135株猪链球菌对于临床常用的13种抗菌药物的耐药性,检测结果表明,几乎所有的菌株都对青霉素G、阿莫西林、头孢噻呋、氟苯尼考、庆大霉素、杆菌肽锌敏感,耐药性最为严重的是多西环素、大环内酯类以及林可胺类抗生素,仅有几株菌株出现对链霉素和卡那霉素的高水平耐药[5]。可以看出,猪链球菌在不同国家和地区的耐药性具有一定的差异,但是基本上对于青霉素类、头孢类都表现为高度敏感,而对于大环内酯类/林可胺类、磺胺类和四环素等的耐药性则较为严重。目前,人们对猪链球菌的耐药机理进行了深入的研究。PCR检测结果表明,耐药性的产生主要是细菌核糖体甲基化的结果[6-7]。研究表明,细菌长时间承受着多种抗生素选择的压力,因此,只有携带多种耐药决定子的细菌才得以生存,这些耐药决定子一般位于转座子中,可在不同菌种、菌株间传递,造成细菌对抗生素的普遍交叉耐药[9-10]。不同地区的耐药情况有差别,而地区上相近的分离株的抗生素抗性和多重耐药性均较为相似。这可能是猪场地理位置较近,有利于耐药菌株传播造成的。从猪场管理和耐药性分布情况来看,管理越规范、卫生和隔离条件越好的猪场其菌株的分离数越少,分离株的耐药性情况也越低。所以,猪场的管理能力、卫生隔离条件、猪源等都可能影响猪的带菌程度和菌株耐药性变化。
[1]中国农业科学院哈尔滨兽医研究所.兽医微生物学[M].北京:中国农业出版社,1998.
[2]陆承平.兽医微生物学[M].3版.北京:中国农业出版社,2001.
[3]白雪梅,张亚兰,孙娜,等.100株猪链球菌的生化检测及药物敏感性分析[J].中国人兽共患病学报,2006,22(5):369-398.
[4]Kopic J,Paradzik M T,Pandak N.Streptococcus suis infection,a zoonosis we should have in mind-2cases reports[J].LijecVjesn,2003,125(5-6):134-137.
[5]Pallares F J,Halbur P G,Roth J A,et al.Comparison of experimental models for Streptococcus suis infection of conventional pigs[J].Can J Vet Res,2003,67(3):225-228.
[6]Cloutier G,D Allaire S,Martinez G,et al.Epidemiology of Streptococcus suis serotype 5infection in a pig herd with and without clinical disease[J].Vet Microbiol,2003,97(1-2):135-151.
[7]沈萍,黎满香.猪链球菌2型及7型分离株对16种抗生素的耐药性分析[J].安徽农业科学,2009,37(1):140-141.
[8]宋立,高光,宁宜宝,等.猪链球菌Ⅱ型四川分离株对抗菌药的敏感性分析[J].中国兽药杂志,2005,39(10):1-5.
[9]拜廷阳,闫若潜,吴志明,等.猪链球菌病研究进展[J].动物医学进展,2007,28(9):83-87.
[10]李雅静,高志清,赵宝华.猪链球菌检测及猪链球菌病防治的研究进展[J].中国兽药杂志,2007,41(10):39-43.
