大劣按蚊丝氨酸蛋白酶AdSP3的组织定位和定量研究
2011-08-06王英黄复生张锡林徐文岳段建华
王英,黄复生,张锡林,徐文岳,段建华
(第三军医大学基础部病原生物学教研室,重庆 400038)
明确某一分子在机体中不同组织的表达、分布及转录水平,对该蛋白的功能研究具有重要提示意义。昆虫能够通过其天然免疫机制防御病原体的入侵感染,其免疫系统包括物理屏障作用、细胞免疫反应和体液免疫反应等。其中,丝氨酸蛋白酶级联反应能够调节昆虫的各种免疫反应,尤其在昆虫抗入侵病原体的黑化包被反应中起着关键作用[1]。丝氨酸蛋白酶能够催化无活性的PPO蛋白水解成有活性的PO,进而启动黑色素的产生和沉积,同时促进伤口愈合和包被反应的发生[2,3]。丝氨酸蛋白酶还参与了细胞吞噬作用,因为利用PPO抗体或PAPs抗体能够明显阻断对细菌的细胞吞噬作用;而分裂素活化蛋白激酶能够通过调节PAPs的分泌控制黑化包被反应和细胞吞噬作用[4]。本研究利用 RTPCR技术和Real-time PCR技术,从mRNA水平研究了丝氨酸蛋白酶3(AdSP3)在大劣按蚊不同组织中的分布及表达水平与疟原虫感染的相关性,推测该酶在大劣按蚊抗约氏疟原虫感染中的生物学作用。
1 材料与方法
1.1 材料
大劣按蚊(Anopheles dirus)为我国海南株,约氏疟原虫(Plasmodium yoelii)为BY265株,感染所用小鼠为昆明株小鼠。
1.2 主要试剂
DEPC购自Sigma公司,琼脂糖购自OXOID公司,溴化乙锭和T ripure RNA提取液购自 Roch公司,RT-PCR试剂盒、DNA Marker及DNA胶纯化回收试剂盒购自 Takara公司,Taq酶购自Promega公司,SYBR Green I购自天泽基因公司。
2 方法
2.1 PCR方法对蚊体内丝氨酸蛋白酶的表达进行组织定位
2.1.1 标本采集及总RNA的提取 取正常4日龄大劣按蚊雌性成蚊200只,采用挤压法(方法同前)将血淋巴细胞收集入1ml Tripure RNA提取液中,用微量加样器枪头吸打数次。取正常4日龄大劣按蚊雌成蚊20只,解剖获得蚊胃。取正常4日龄大劣按蚊雌成蚊30只,解剖获得蚊唾液腺。将采集的蚊胃和唾液腺分别在1 ml的Tripure RNA提取液中进行匀浆。常规方法提取总RNA,并进行核酸定量及纯度检测。
2.1.2 反转录(RT)合成cDNA 加样Total RNA(6 μ l)、5 ×Buffer(4 μ l)、MMLV 反转录酶(1 μ l)、dNTP(4 μ l)、Oligo(dT)15(1 μ l)、RNAi(1 μ l)、DEPC 处理水(3 μ l)。混匀后,42℃孵育2 h,99℃5 min灭活 MMLV,备用。
2.1.3 聚合酶链式反应(PCR)引物设计与合成:根据本课题组已合成的AdSP3的cDNA序列,利用Primer软件设计引物序列,委托上海生工生物工程技术服务有限公司合成引物。上游引物序列(5′to3′)CAA CAA GAG GCT GGA TGA AGG,下游引物序列(5′to3′)TGC TGC TGG T TC TCG 。反应体系为 cDNA(3.0 μ l)、10×Buffer(2.5 μ l)、5 u/μ l的 Taq 酶(0.3 μ l)、25mM 的 MgCl2(1.5 μ l)、2.5 mM 的 dNTP(2.0 μ l)AdSP3 上游引物 1.0 μ l、Ad-SP3下游引物(1.0 μ l)、ddH2O(13.7 μ l)。反应条件为94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,共 35个循环,最后 72℃再延伸5 min。1%琼脂糖凝胶电泳检测PCR产物。
2.2 大劣按蚊感染约氏疟原虫前后及不同时相点丝氨酸蛋白酶的转录水平研究
2.2.1 动物感染与实验分组 设感染组和正常组,分别吸食感染约氏疟原虫的鼠血和正常鼠血。大劣按蚊感染约氏疟原虫的方法同前。分别于吸血后1 d、3 d、5 d、7 d和 9 d采集大劣按蚊雌蚊的血淋巴(吸感染血组依次为 I1d 、I3d、I5d、I7d、I9d 和吸正常血组N1d),直接虹吸入 Tripure RNA提取液中。总RNA的提取及反转录方法同上。
2.2.2 Real-time PCR 引物同上述 RT-PCR,利用SYBR Green染色法。对以上分组的每组均分别进行AdSP3和S7(内参照)的扩增,另设AdSP3和S7扩增的空白对照管(只加引物,不加模板)。此外,同时以AdSP1的质粒为模板做一标准曲线。反应体系 :cDNA 2 μ l、10 ×Buffer 2.5 μ l、5 u/μ l的Taq 酶 0.3 μ l、25 mM 的 MgCl21.5 μ l、2.5 mM 的dNTP 2 μ l、AdSP3上游引物 1 μ l、AdSP3下游引物1 μ l、SYBR Green(1 ∶10000 稀释液)1 μ l、ddH2O 13.7 μ l。反应条件:94℃预变性5 min后,94℃变性1 min、55℃退火1 min、72℃延伸1 min,读板,共35个循环。
3 结果
3.1 丝氨酸蛋白酶在正常大劣按蚊血淋巴细胞、唾液腺和蚊胃中的分布情况
经过RT-PCR及琼脂糖凝胶电泳后,在紫外仪内可见血淋巴细胞组(L)和唾液腺组(S)均有一清晰而锐利的420 bp条带,这与根据AdSP3序列预测大小一致。蚊胃组(G)则见多个条带(见图1)。
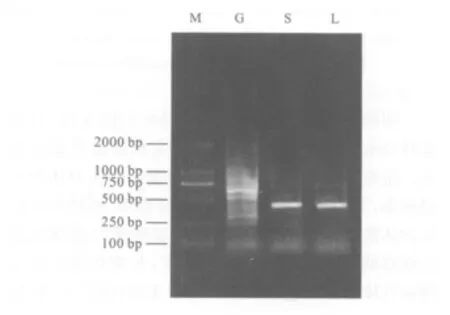
图1 1%琼脂糖凝胶电泳检测RT-PCR产物Fig.1 Result of 1%agarose electrophoresis to test product of RT-PCR
3.2 大劣按蚊感染约氏疟原虫前后及不同时相点丝氨酸蛋白酶的转录水平
Real-time PCR结果中的熔解曲线图(见图2)显示,除主峰外未见杂峰,扩增AdSP3的 Tm值(熔解温度)为80℃,扩增S7的 Tm 值为79℃,说明扩增效果好,特异性强(无非特异扩增)。因此,用于定量研究结果可信。在对AdSP3和S7的扩增中,荧光检测显示起跳好,说明扩增成功(见图3)。
根据检测结果和标准曲线计算出各试验组的AdSP3和S7的模板含量(拷贝数),然后求得同组的Ad*SP3与S7模板含量比值(见表1),此比值即可反映各试验组间AdSP3的相对转录水平(即mRNA水平)。结果显示,I7d与I9d两组间无显著性差异(P>0.05),其余各试验组间的AdSP3转录水平比较均具有显著性差异(P<0.01)。I1d组AdSP3的转录水平明显高于同时相点的N1d组;I3d组则水平下降,低于I1d组;I5d组转录水平又明显上升;I7d组AdSP3的转录水平又明显回降,I9d组转录水平与I7d组相当,趋于稳定表达水平(见图4)。

图2 AdSP3和S7的熔解曲线Fig.2 Melting curve of AdSP3 and S7

图3 AdSP3的Real-time PCR扩增结果Fig.3 Results of Real-time PCR to amplify AdSP3
表1 Real-time PCR结果中各试验组的转录水平(n=6,±s)Tab.1 Transcription level of groups shown in the results of Real-time PCR(n=6,±s)
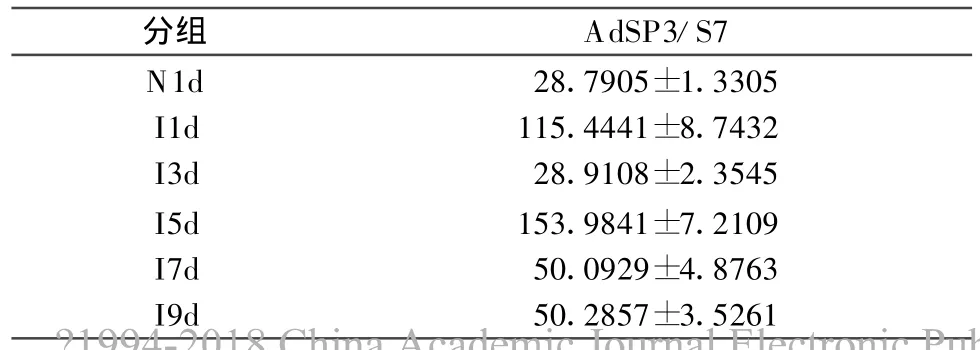
表1 Real-time PCR结果中各试验组的转录水平(n=6,±s)Tab.1 Transcription level of groups shown in the results of Real-time PCR(n=6,±s)
?
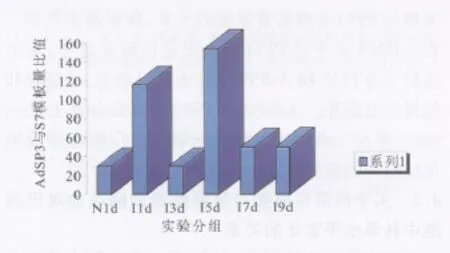
图4 吸血后不同时相点大劣按蚊各组AdSP3的转录水平Fig.4 Transcriptions of AdSP3 in An.dirus at different time points after blood feeding
4 讨论
4.1 关于丝氨酸蛋白酶在蚊体内的组织定位
本研究首先利用RT-PCR方法,从mRNA水平检测了AdSP3在大劣按蚊不同组织的分布情况。由结果看,从血淋巴细胞和唾液腺中均能成功扩增出特异条带,大小420 bp,与根据Genbank中的AdSP3序列及引物序列预测的目的片段大小完全一致。本研究结果提示,在血淋巴细胞和唾液腺中存在丝氨酸蛋白酶AdSP3的mRNA,即蚊血淋巴细胞和唾液腺能够成功表达丝氨酸蛋白酶。而在蚊胃中对AdSP3扩增,出现多个条带,根据这一结果我们暂无法确定在蚊胃中有无AdSP3的转录。
对烟草天蛾组织定位研究显示,不同的丝氨酸蛋白酶表达部位并不完全一致:HP13和 HP18只在血淋巴细胞内表达,而HP12和HP20-HP22则仅在脂肪体细胞表达,其它的HPs则在这两种细胞内均有表达[5]。对冈比亚按蚊的研究发现,其丝氨酸蛋白酶Sp22D主要表达于血淋巴细胞、脂肪体细胞和蚊胃上皮细胞,且蚊胃组织的阳性信号最强[6]。提示大劣按蚊的各种丝氨酸蛋白酶表达部位可能也不完全一样。本研究结果仅提示AdSP3在血淋巴细胞和唾液腺内有表达,在蚊胃内则不确定。
丝氨酸蛋白酶是黑化包被反应中的一个关键酶,它能够催化无活性的PPO蛋白水解成有活性的PO,进而启动黑化反应的发生。而黑化包被反应是昆虫天然免疫的重要机制之一,也是蚊抗疟原虫感染的重要方式。丝氨酸蛋白酶在黑化反应中作用的发挥与PPO必然有着紧密的关系,我室郝宏兴等[7]在mRNA水平对PPO的组织定位研究显示,大劣按蚊AdPPO2和AdPPO3在血淋巴细胞、唾液腺和蚊胃均有分布。AdSP3与PPO在组织分布上的一致性,提示二者的相关性及丝氨酸蛋白酶在卵囊黑化反应中的重要作用。
4.2 关于疟原虫感染与丝氨酸蛋白酶在血淋巴细胞中转录水平变化的关系
根据熔解曲线可见,在PCR过程中基本没有非特异扩增和引物二聚体的产生,使得试验结果能较好地反映扩增的目的片段含量,从而准确计算出模板中的cDNA含量。本研究结果显示,吸食感染血后1 d的按蚊血淋巴AdSP3的转录水平明显高于同时相点的吸食正常血组。这与Volz等[8]的研究结果一致,即感染后1 d时血淋巴中丝氨酸蛋白酶的含量较吸正常血组增加。疟原虫感染按蚊后24 h,正是动合子穿过蚊胃壁的过程,这是疟原虫感染按蚊蚊胃并形成卵囊的时期,会启动一系列的蚊天然免疫[9]。事实上,昆虫的各种丝氨酸蛋白酶在感染后24 h的转录水平变化并不完全一样。例如烟草天蛾在细菌攻击感染后 24 h时血淋巴细胞内PAP2和血淋巴蛋白 2(HP2)、HP7、HP9、HP10、HP12-HP22的 mRNA水平均增高,血浆中HP12、HP14-HP19、HP21和 HP22等蛋白的浓度在细菌攻击感染后24 h也增加;而HP24感染后24 h却几乎未见表达。冈比亚按蚊在进行细菌或疟原虫攻击感染后,其丝氨酸蛋白酶Sp14A、Sp14D1、Sp14D2和Sp22D的转录均上调,但Sp18D在攻击感染后mRNA水平则未见增高[6],因此,不同的丝氨酸蛋白酶受到免疫信号的不同调节。总之,在昆虫体内丝氨酸蛋白酶组成了一个复杂的蛋白酶网络,介导着对创伤和病原体感染的快速防御反应[5,10]。本结果说明,疟原虫的感染诱导了按蚊AdSP3的表达增强,进一步支持了丝氨酸蛋白酶在蚊抗疟原虫感染中的作用。
根据吸血后不同时相点的定量检测,得知吸血后3 d大劣按蚊的AdSP3 mRNA水平明显下降,这可能由两个原因造成:一是感染后24 h时大量mRNA参与了AdSP3的翻译、表达,对mRNA的消耗过大;二是感染后3 d时疟原虫已穿过蚊胃壁,在胃基底膜处定位后,卵囊逐渐发育(这一阶段相对较为稳定),对按蚊的刺激因子较少,以使得按蚊对Ad-SP3的转录降低。而蚊感染疟原虫后5 d时,Ad-SP3的表达又明显增加,提示感染后5 d时又大量启动了丝氨酸蛋白酶的转录、表达,以增强黑化反应的发生。我室徐文岳等[11]的研究发现,大劣按蚊对约氏疟原虫的卵囊黑化在光镜下最早于感染后7 d时发现,因此黑化反应的启动则在7 d之前。我室黄复生等[12]的研究则提示,约氏疟原虫感染大劣按蚊后5 d在电镜下其周围即可见少数血细胞附着,即包被反应已经发生。在蚊对疟原虫的黑化包被反应中,需要丝氨酸蛋白酶级联反应的启动和PPO的活化。因此,丝氨酸蛋白酶转录水平的变化必然与PPO和PO有着密切关系。我室徐文岳等[13,14]对PPO的研究发现,在吸血后4~5 d,PPO的蛋白合成明显增强;而对PO的研究则显示,在血餐后5 d时PO活性最高,之后逐渐下降,这与本结果中吸血后5 d丝氨酸蛋白酶转录水平增高一致,提示SP与PPO及PO之间转录水平的变化存在相关性及它们在黑化反应中具有重要作用。由此推断,大劣按蚊丝氨酸蛋白酶及PPO级联反应在血餐后5 d时达到高峰。吸血后7 d和9 d较之5 d时的AdSP3转录水平发生下降,并趋于稳定水平,这可能是由于免疫刺激因子减少,导致转录水平下降并趋于稳定。
总之,本试验在mRNA水平研究了AdSP3在大劣按蚊不同组织的表达分布及吸血和感染疟原虫后不同时相点的表达情况。结果提示,AdSP3在不同组织的分布和其转录水平的变化与PPO和疟原虫的感染相关,说明丝氨酸蛋白酶AdSP3在大劣按蚊抗约氏疟原虫感染中可能作为前酚氧化酶活化酶发挥了重要作用。丝氨酸蛋白酶在蚊抗疟原虫感染天然免疫及黑化包被反应中的作用是通过复杂的信号通路完成的[15],AdSP3在大劣按蚊对约氏疟原虫的黑化包被反应中的具体作用机制还有待进一步研究。
[1]Sakamoto M,Ohta M,Suzuki A,et al.Localization of the serine protease homolog BmSPH-1 in nodules of E.coli-injected Bomby x mori larvae and functional analysis of its role in nodule melanization[J].Dev Comp Immunol,2011,35(5):611-619.
[2]Cerenius L,Soderhall K.The prophenoloxidase-activating system in invertebrates[J].Immunol Rev,2004,198(1):116-126.
[3]Nappi AJ,Vass E.Cy totoxic reactions associated with insect immunity[J].Adv Exp Med Biol,2001,484:329-348.
[4]Mav rouli M D,Tsakas S,T heodorou GL,et al.M AP kinase mediate phagocy tosis and melanization via prophenoloxidase activation in medfly hemocytes[J].Biochimica et Biophysica Acta,2005,1744(2):145-156.
[5]Wang Y,Zou Zhen,Jiang HB.An ex pansion of the dual clipdomain serine proteinase family in Manduca sexta:Gene organization,expression,and evolution of prophenoloxidase-activating proteinase-2,hemolymph proteinase 12,and other related proteinases[J].Genomics,2006,87(3):399-409.
[6]Gorman MJ,Andreeva OV,Paskewitz SM.Sp22D:a multidomain serine protease with a putative role in insect immunity[J].Gene,2000,251(1):9-17.
[7]郝宏兴,邱宗文,段建华,等.大劣按蚊AdPPO2、AdPPO3基因cDNA克隆与组织定位[J].第三军医大学学报,2004,26(6):470-472.
[8]Volz J,Osta M A,Kafatos FC,et al.The roles of two clip domain serine proteases in innate immune responses of the malaria vector Anopheles gambiae[J].J Biol Chem,2005,280(48):40161-40168.
[9]Vlachou D,Schlegelmilch T,Christophides GK,et al.Functional genomic analysis of midgut epithelial responses in A-nopheles during Plasmodium invasion[J].Curr Biol,2005,15(13):1185-1195.
[10]Jiang HB,Wang Y,Gu Yongli,et al.Molecular identification of a bevy of serine proteinase in Manduca Sexta hemolymph[J].Insect Biochemistry and Molecular Biology,2005,35(8):931-943.
[11]Xu WY,Huang FS,Hao HX,et al.Two serine protease from Anopheles dirus haemocytes exhibit changes in transcript abundance after infection of an incompatible rodent malaria parasite,Plasmodium yoelii[J].Veterinary Parasitology,2006,139(1):93-101.
[12]黄复生,王兴相.大劣按蚊血细胞对约氏疟原虫卵囊黑化的作用[J].中国寄生虫病防治杂志,1995,8(4):284-285.
[13]徐文岳,黄复生,况明书,等.约氏疟原虫卵囊黑化期间大劣按蚊血淋巴蛋白的分析[J].第三军医大学学报,2001,23(9):1098-1100.
[14]徐文岳,黄复生,张锡林,等.大劣按蚊血淋巴酚氧化酶与约氏疟原虫卵囊黑化关系的研究[J].第三军医大学学报,2001,23(4):440-442.
[15]Zou Z,Shin SW,Alvarez KS,et al.Distinct melanization pathways in the mosquito Aedes aegypti[J].Immunity,2010,32(1):41-53.