酶制剂在玉米秸秆双菌种固态发酵生产微生物油脂中的应用
2011-08-04李新社陆步诗金双喜
李新社,陆步诗,金双喜
(邵阳学院 生物与化学工程系,湖南 邵阳,422000)
能源是维系社会、经济和环境协调发展的基础,也是人类生存和发展的前提。面对全球社会经济的迅速发展,人类对能源的需求日益增长,仅中国能源消耗每年就以超过 10%的速度增长[1]。开发清洁的可再生能源——生物柴油已迫在眉睫。目前,生物柴油的生产原料以植物油为主,原料成本占总生产成本的70%~85%[2],受原料成本的影响,工业化生产程度低,经济可行性差,因此,寻找一种廉价的原料成为生物柴油产业化的关键。秸秆是地球上丰富的可再生资源。据联合国粮农组织统计,世界秸秆年产量为 20~30亿t,中国每年农作物秸秆产量约7亿t,占全世界秸秆总量的20%~30%[3],其中玉米秸秆、小麦秸秆和稻秆占75%以上。目前玉米秸秆主要用于还田、气化发电、生产食用菌[4]、造纸和生产青贮饲料[5]等,利用率不足总量的60%。一些产油微生物能够利用各种廉价甚至废弃的工农业下脚料如生物秸秆为原料,转化为微生物油脂。利用微生物制备油脂具有许多优点:微生物细胞增殖快,生产周期短;微生物生长所需的原料丰富且价格便宜;能大规模生产,生产成本低;不受季节、气候变化的限制。因此,利用微生物发酵玉米秸秆生产微生物油脂用于生物柴油的制备,不但可以使玉米秸秆得到合理的利用,同时又可以开辟一条清洁能源再生途径解决当今面临的能源危机。微生物发酵生产油脂的研究起步较早,早期主要集中在获取附加值较高的功能性油脂上[6-10]。目前,研究和应用较多的油脂生产菌主要有深黄被孢霉、斯达氏酵母、圆红冬孢酵母、黏红酵母以及隐球酵母等[11-17],利用皮状丝孢酵母生产微生物油脂鲜有报道[18-19]。利用玉米秸秆发酵生产微生物油脂有报道[20-21],但利用皮状丝孢酵母发酵玉米秸秆生产微生物油脂未见有报道。本文作者对纤维素酶和康宁木霉预处理玉米秸秆、皮状丝孢酵母发酵玉米秸秆预处理物积累油脂的工艺条件进行研究,以期为微生物油脂发酵生产提供技术依据。
1 材料与方法
1.1 材料、仪器与试剂
1.1.1 材料
玉米秸秆:采自湖南省邵阳市新邵县农村。
菌种:康宁木霉(Trichoderma koningii,GIM3.444)、皮状丝孢酵母(Trichosporon cutaneum,GIM2.68) 购于广东省微生物研究所菌种保藏中心。
麸皮:市场购买。
1.1.2 主要仪器
仪器主要有:722型光电比色计、超净工作台、高压蒸汽灭菌锅、冰箱、恒温培养箱、离心机、真空干燥箱、显微镜、电子分析天平、pH计、恒温干燥箱、超声波细胞破碎机等。
1.1.3 试剂
试剂为:琼脂、磷酸二氢钾、七水合硫酸镁、维生素B1、硫酸铵、氯化钙、硫酸亚铁、硫酸锰、氯化锌、氯化钴等,为市售化学纯商品;葡萄糖、氢氧化钠、无水亚硫酸钠、二硝基水杨酸、酒石酸钾、结晶酚、无水乙醚等,为市售分析纯商品;纤维素酶(酶活性≥1 000 U/g),由国药集团化学试剂有限公司提供。
1.2 试验方法
1.2.1 培养基的制备
(1) PDA 培养基的制备[22]。马铃薯去皮称取200 g,切成块煮沸 30 min,用四层纱布过滤,制成马铃薯汁,添加葡萄糖20 g、磷酸二氢钾3 g、七水合硫酸镁1.5 g、维生素B1(硫胺素) 8 mg,溶解后补足水至1 L,调节 pH为 6。固体培养基的琼脂添加量1.5%~2.0%(质量分数)。分装后加棉塞包扎好,在121℃高压蒸汽灭菌20 min。
(2) Mandels营养盐液的制备[23]。称取磷酸二氢钾2 g,硫酸铵1.4 g,七水硫酸镁3 g,氯化钙0.3 g,七水硫酸亚铁5 mg,硫酸锰1.6 mg,氯化锌1.7 mg,氯化钴2.0 mg,溶于1 L蒸馏水中。
(3) 玉米秸秆粉固体发酵培养基制备。将玉米秸秆粉80 g、麸皮40 g和Mandels营养液100 mL装入三角瓶中,包扎好,在121 ℃高压蒸汽下灭菌20 min。
1.2.2 菌种活化与扩大培养
(1) 康宁木霉活化与扩大培养。PDA琼脂培养基→分装试管→灭菌→摆斜面→接种→培养(28 ℃培养3 d,共活化3次)→接种PDA液体培养基(三角瓶)→扩大培养(28 ℃培养4 d)→种子。
(2) 皮状丝孢酵母的活化与扩大培养。PDA琼脂培养基→分装试管→灭菌→摆斜面→接种→培养(28 ℃培养3 d,共活化3次)→接种PDA液体培养基(三角瓶)→扩大培养(28 ℃培养3 d)→种子。
1.2.3 玉米秸秆预处理[24]
将玉米秸秆去叶、切断,于72 ℃恒温干燥箱中烘干24 h,用粉碎机粉碎,过筛(孔径380 μm)备用。
1.2.4 还原糖含量的测定 DNS法[25]
(1) 制备DNS试剂。
① 在300 mL质量分数为4.5%的NaOH溶液中,加入1.0%二硝基水杨酸 (体积分数)溶液880 mL及酒石酸钾钠255 g。
② 在22 mL 10%NaOH(质量分数)溶液中加入结晶酚10 g,加水使之溶解,最后定容至100 mL。
③ 取第2步溶液69 mL加入无水亚硫酸钠6.9 g,使之溶解。
④ 将第3步溶液注入第1步溶液中,完全溶解后,储于棕色试剂瓶中。在室温下,放置7~10 d以后使用。
(2) 制备1 g/L葡萄糖标准溶液。准确称取100 mg分析纯葡萄糖(预先在105 ℃下干燥至质量恒定),用少量蒸馏水溶解后定容至 100 mL,于冰箱中保存备用。
(3) 萄糖标准曲线的绘制。表 1所示为试剂及其处理工艺。取6支洗净烘干的25 mL有刻度比色管,编号后按表1所示加入葡萄糖溶液和蒸馏水,配制成一系列不同浓度的葡萄糖溶液。充分摇匀后,向各试管中加入2.0 mL DNS溶液,摇匀后沸水浴5 min,迅速冷却后用蒸馏水定容至25 mL,充分混匀。在540 nm波长下,以1号试管溶液作为空白对照,调零点,用722型光电比色计测定其它各管溶液的吸光度并记录结果。

表1 葡萄糖标准曲线绘制试剂及其处理Table 1 Reagents and its treatment of standard curve of glucose
(4) 样品还原糖的测定。取1 mL样品液于25 mL的比色管中,再加入2 mL DNS试剂混匀,沸水浴加热5 min,迅速冷却,加蒸馏水定容至25 mL,摇匀,同时以蒸馏水代替试样进行同样的操作进行空白对照调零点。在波长540 nm下测出吸光度,从标准曲线中查出葡萄糖质量浓度。
1.2.5 油脂含量的测定
采用索氏抽提法[26],利用超声波细胞破碎机使样品中的细胞破裂,细胞内油脂释放出来。称取3 g样品放入小烧杯中,将小烧杯置于72 ℃恒温干燥箱中烘干2 h,装入事先切成尺寸(长×宽)为8 cm×8 cm的滤纸中,包好,用长镊子将滤纸包放入浸提管底部。将洗净的索氏提取器小烧瓶用铅笔在磨口处(内侧)编号,于103~105 ℃下烘2 h,取出,置于干燥器内冷却。然后用电子分析天平称量质量,并记录。于已称量的小烧瓶内倒入 1/3~1/2体积的无水乙醚。连接索氏提取器各部分,在44 ℃恒温水浴中加热回流4 h。提取完毕,待无水乙醚完全流入小烧瓶时,取出滤纸包,再回流一次洗涤浸提管。继续加热,待浸提管内无水乙醚液面接近虹吸管上端而未流入小烧瓶前,倒出浸提管中溶剂。若小烧瓶中尚留溶剂,则继续加热蒸发,直至小烧瓶中溶剂基本蒸尽,停止加热,取下小烧瓶,洗净烧瓶外壁可能沾有的污渍,用电吹风将瓶中残留的无水乙醚吹尽,再置103~105 ℃烘箱中烘30 min,取出置干燥器中冷却至室温,称量。由小烧瓶增加的重量可计算出样品的油脂含量。
1.2.6 纤维素酶和康宁木霉处理玉米秸秆的工艺条件
制备玉米秸秆粉固体发酵培养基→121 ℃高压蒸汽灭菌20 min→加入纤维素酶溶液→接种康宁木霉→置入恒温培养箱中培养一定时间→抽滤,得滤液→定容至100 mL→测还原糖含量[27-28]。
1.2.7 皮状丝孢酵母发酵玉米秸秆生产微生物油脂的工艺
以纤维素酶和康宁木霉发酵玉米秸秆获得的降解物为原料,接种一定量皮状丝孢酵母,置恒温培养箱中培养一定时间后,检测油脂的含量。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
配制系列浓度的葡萄糖标准溶液,用722型光电比色计进行比色测定,用空白管溶液调零点,记录吸光度值。以葡萄糖标准溶液浓度为横坐标,以吸光度值为纵坐标绘制标准曲线,结果见图 1。以葡萄糖为标准品制定标准曲线,y=0.628 9x-0.010 8,曲线相关系数R2=0.997 7。
2.2 纤维素酶和康宁木霉处理玉米秸秆的工艺条件
设定纤维素酶添加量、康宁木霉接种量、处理温度、处理时间为4个变量,每因素采用三水平,进行L9(34)正交试验,正交试验设计见表2。通过检测玉米秸秆处理物中还原糖含量来确定纤维素酶和康宁木霉处理玉米秸秆的最佳处理条件,正交试验结果及数据分析见表3和表4。
表3所示为纤维素酶和康宁木霉处理玉米秸秆正交试验结果及数据处理。由表 3可知:极差RD>RB>RA>RC,主次因素顺序为处理时间、康宁木霉接种量、纤维素酶添加量、处理温度;试验A1B2C3D3为最佳组合。
表4所示为正交试验结果的方差分析结果。由方差分析可知:F0.05<FB>F0.1,F0.05<FD>F0.1,表明 B因子与D因子水平的改变对实验结果有一定的影响;因子A与D以及B与D有一定的交互作用,A与B的交互作用不显著;因子A与C的任何水平间的差异没有达到显著差异水平,显著因子是B和D。因此,利用纤维素酶和康宁木霉处理玉米秸秆的最优条件是A0B2C0D3,即康宁木霉接种量为10%,处理时间为6 d,纤维素酶添加量为0.15%,0.3%和0.45%均可,处理温度26,28和30 ℃均可。这是由于玉米秸秆是一种天然的纤维原料,主要成分是纤维素、半纤维素和木质素。纤维素结构单元是由β-1,4-糖苷键联结而成的线性葡萄糖高分子聚合物,很难被降解。半纤维素主要是木糖以及少量阿拉伯糖、半乳糖、甘露糖等组成的聚合物,半纤维素较易水解为单糖。木质素是以苯丙烷及其衍生物为基本单位构成的高分子芳香族化合物,起胶质的作用,将纤维素和半纤维素连接在一起,纤维素酶必须吸附到纤维素底物上才能促使纤维素降解。因此,纤维素酶对纤维素的可及性受木质素和半纤维素的影响而无法实现对纤维素的降解。伴随着康宁木霉生长而产生的木聚糖酶对半纤维素降解,纤维素酶对纤维素的可及性增强,从而使纤维素得到有效降解。在一定范围内,培养时间越长,降解效果越明显。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
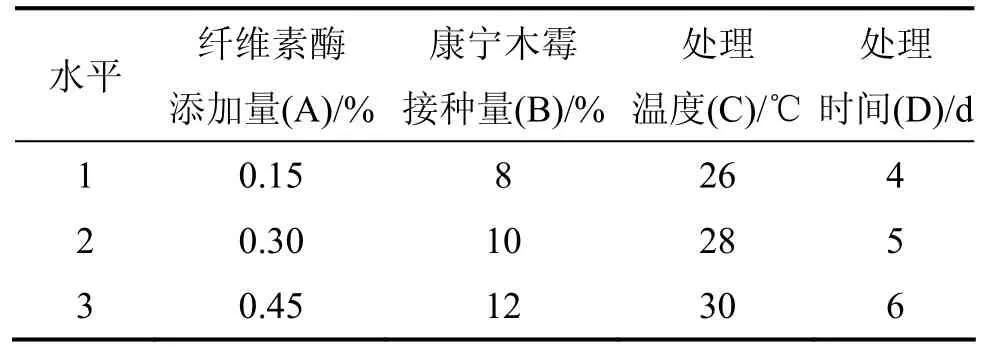
表2 纤维素酶和康宁木霉处理玉米秸秆正交试验设计Table 2 Orthogonal test design of corn stalk treated with cellulase and Trichoderma koningii
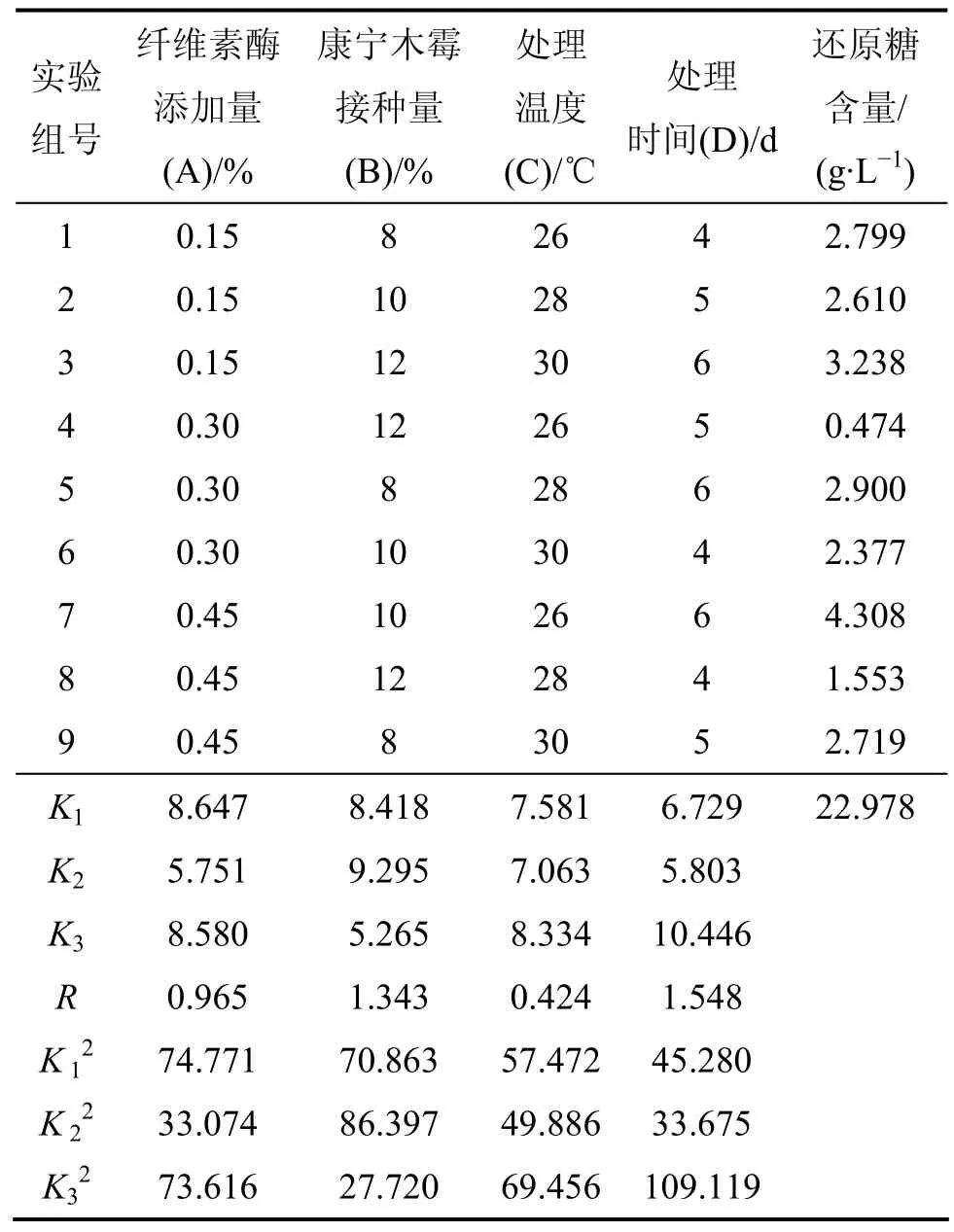
表3 纤维素酶和康宁木霉处理玉米秸秆正交试验结果及数据处理Table 3 Results of orthogonal test and data analysis of corn stalk treated with cellulase and Trichoderma koningi
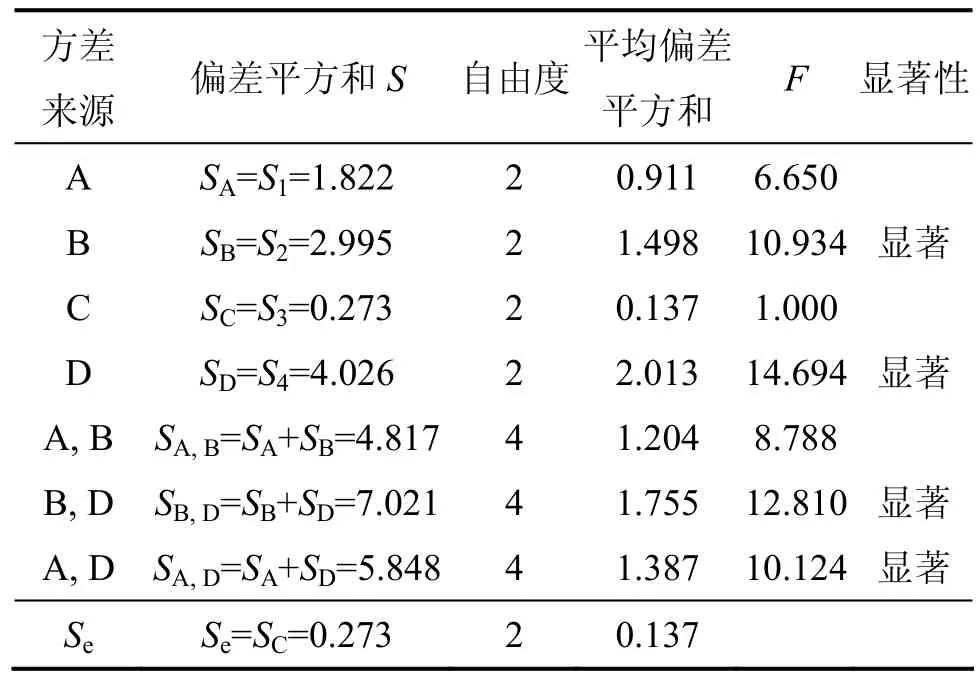
表4 正交试验结果方差分析Table 4 Valance analysis of orthogonal test
因此,在实际生产中,要控制好康宁木霉的接种量和处理时间,以促使康宁木霉良好生长,保证玉米秸秆得到充分的降解,同时,从降低成本和节约能源出发,纤维素酶添加量选择 0.15%,处理温度选择26 ℃。
2.3 皮状丝孢酵母发酵玉米秸秆生产微生物油脂的工艺条件
以最佳条件下纤维素酶和康宁木霉处理玉米秸秆获得的降解物为原料,设定皮状丝孢酵母接种量、培养温度和培养时间为3个变量,每因素采用三水平,进行L9(33)正交试验,正交试验设计见表5,通过检测油脂含量来确定微生物油脂生产的最佳工艺条件,正交试验结果及数据处理见表6和7。
由表6可知:极差RC>RA>RB;主次因素顺序为培养时间、接种量、培养温度;试验 A2B2C2为最佳组合。
由方差分析可知:因子A与B的任何水平间的差异没有达到显著差异水平,C因子水平的改变,对实验结果有一定的影响;因子A与C的交互作用不显著,显著因子是C。因此,皮状丝孢酵母发酵玉米秸秆降解物生产微生物油脂的最优工艺条件是A0B0C2,即培养时间为7 d,皮状丝孢酵母接种量为9%,11%和13%均可,培养温度为26,28和30 ℃均可。这是因为玉米秸秆降解物还原糖含量不高,营养物质不是特别丰富,皮状丝孢酵母生长缓慢,因而随着培养时间延长,油脂积累增多。

表5 皮状丝孢酵母发酵玉米秸秆生产微生物油脂正交试验设计Table 5 Orthogonal test design of corn stalk fermented by Trichosporon cutaneum
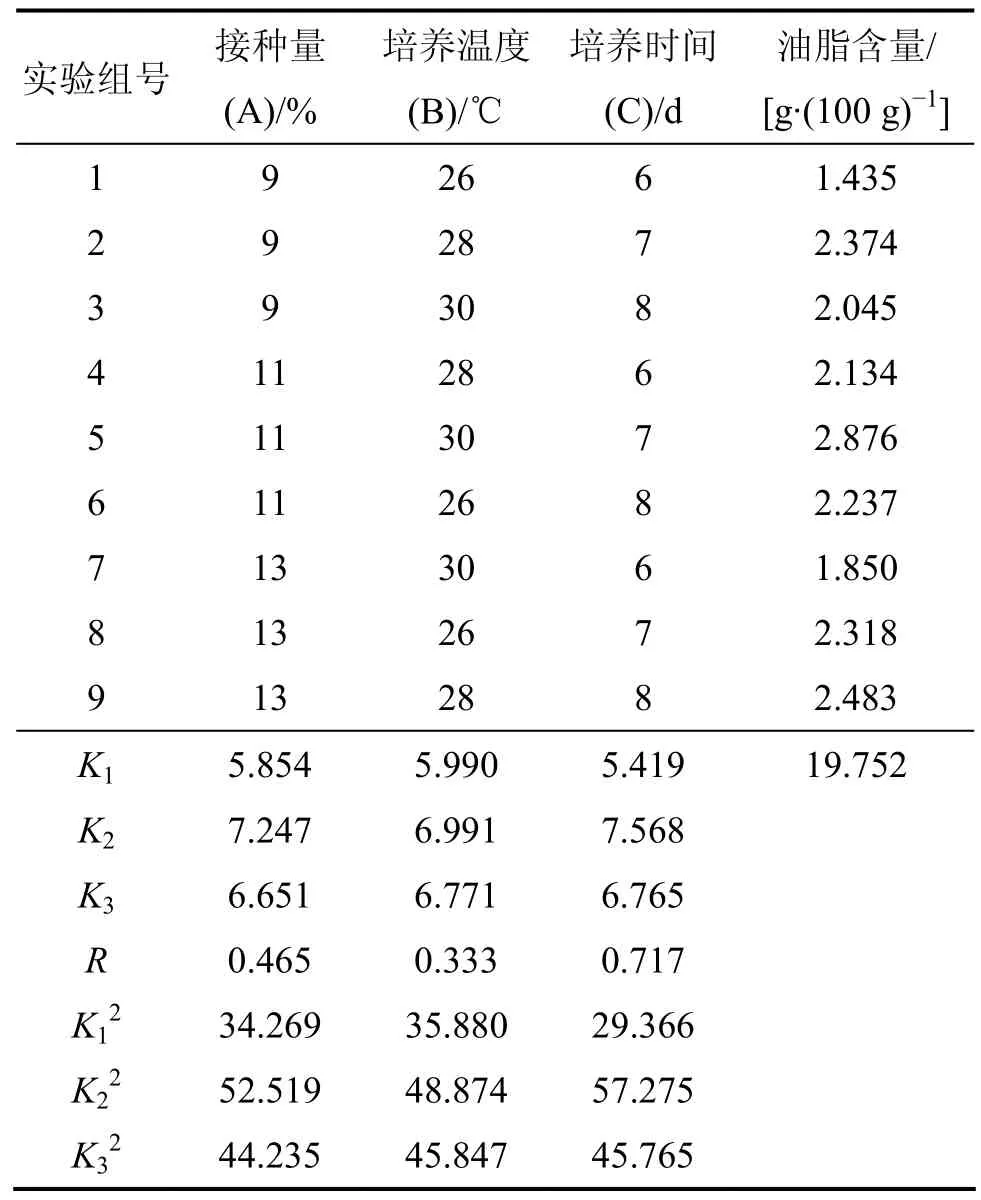
表6 皮状丝孢酵母发酵玉米秸秆生产微生物油脂正交试验结果及数据处理Table 6 Orthogonal test and data analysis of corn stalk fermented by Trichosporon cutaneum
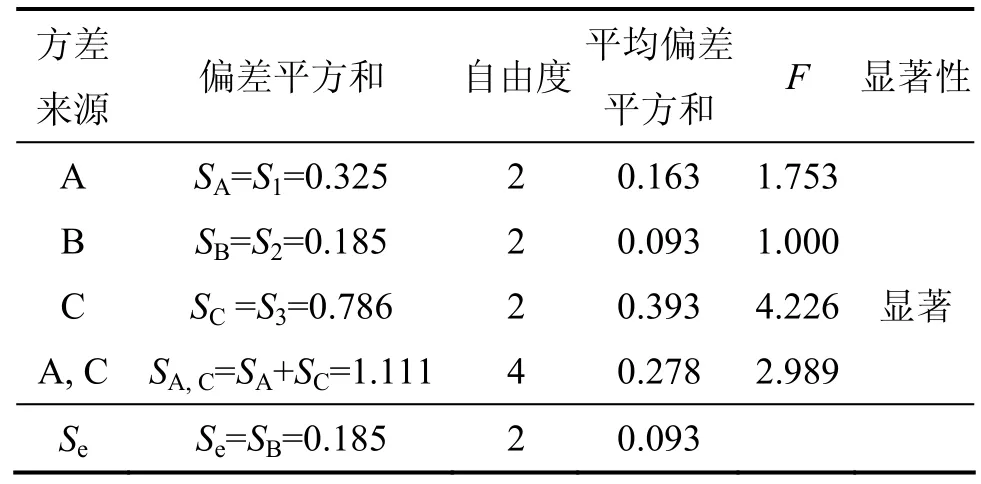
表7 正交试验结果方差分析Table 7 Valance analysis of orthogonal test
因此,在实际生产中,要控制好培养时间以积累更多的油脂。同时从降低成本角度出发,皮状丝孢酵母接种量选择9%,培养温度选择26 ℃。
2.4 最优条件试验
利用纤维素酶和康宁木霉在纤维素酶添加量为0.15%,康宁木霉接种量为10%,处理温度为26 ℃,处理时间为6 d的条件下处理玉米秸秆,并对降解物进行还原糖含量的检测;以最佳条件下纤维素酶和康宁木霉处理玉米秸秆获得的降解物为原料,在皮状丝孢酵母接种量为9%,培养温度为26 ℃,培养时间为7 d的条件下发酵,并对油脂产量进行检测。结果见表8。

表8 最优条件试验结果Table 8 Results of optimal test
由表8可知:在最佳条件下,利用纤维素酶和康宁木霉处理玉米秸秆,可获得还原糖含量为4.852 g/L的玉米秸秆降解物;利用皮状丝孢酵母发酵该玉米秸秆降解物,每100 g发酵产物中,可获得微生物油脂3.321 g。
3 结论
(1) 纤维素酶和康宁木霉处理玉米秸秆的最优组合为A1B2C1D3,即纤维素酶添加量为0.15%,康宁木霉接种量为10%,处理温度为26 ℃,处理时间为6 d。在最优处理条件下,可获得还原糖含量为4.852 g/L的玉米秸秆降解物。
(2) 利用皮状丝孢酵母发酵玉米秸秆降解物生产微生物油脂的最优组合为 A1B1C2即皮状丝孢酵母接种量为9%,培养温度为26 ℃,培养时间为7 d,在最优条件下每100 g发酵产物中,可获得微生物油脂3.321 g。
[1] 王风芹, 王艳颖, 谢慧, 等. 我国生物柴油原料来源的多样性探讨[J]. 氨基酸和生物资源, 2008, 30(1): 4-9.WANG Feng-qin, WANG Yan-ying, XIE Hui, et al. Discussion on raw material diversity of biodiesel oil production in china[J].Amino Acids & Biotic Resources, 2008, 30(1): 4-9.
[2] 朱建良, 张冠杰. 国内外生物柴油研究生产现状及发展趋势[J]. 化工时刊, 2004, 18(1): 23-27.ZHU Jian-liang, ZHANG Guan-jie. Current situation and development trend of the research and production of biodiesel [J].Chemical Industry Times, 2004, 18(1): 23-27.
[3] 陈合, 张强. 菌酶共降解玉米秸秆的工艺研究[J]. 农业工程学报, 2008, 24(3): 270-272.CHEN He, ZHANG Qiang. Technology for co-degradation of corn stalk by microorganism and enzyme[J]. Transactions of the Chinese Society of Agricultural Engineering, 2008, 24(3):270-272.
[4] 郝素琴, 刘艳. 我国农作物秸秆综合利用概况[J]. 中国环境管理干部学院学报, 2007, 17(1): 65-67.HAO Su-qin, LIU Yan. General introduction to many-sided utilization of crop straw in China[J]. Journal of Environmental Management College of China, 2007, 17(1): 65-67.
[5] 张强, 秦涛, 张红艳, 等. 玉米秸秆的综合开发利用[J]. 玉米科学, 2006, 14(2): 168-169.ZHANG Qiang, QIN Tao, ZHANG Hong-yan, et al. The comprehensive development of the corn stalk[J]. Journal of Maize Sciences, 2006, 14(2): 168-169.
[6] 薛飞燕, 张栩, 谭天伟. 微生物油脂的研究进展及展望[J]. 生物加工过程, 2005(3): 23-27.XUE Fei-yan, ZHANG Xu, TAN Tian-wei. Research advance and prospect in microbial oils[J]. Chinese Journal of Bioprocess Engineering, 2005(3): 23-27.
[7] 薛照辉, 吴谋成. 微生物油脂进展[J]. 山西食品工业, 2002(2):10-11.XUE Zhao-hui, WU Mou-cheng. Research advance in microbial oils[J]. Shanxi Food Industry, 2002(2): 10-11.
[8] 郑建仙, 耿立萍. 功能性食品基料-γ-亚麻酸[J]. 食品与发酵工业, 1996(1): 49-54.ZHENG Jian-xian, GENG Li-ping. A functional food material-γlinolenic acid[J]. Food and Fermentation Industries, 1996(1):49-54.
[9] 蒲海燕, 贺稚非, 刘春芬, 等. 微生物功能性油脂研究概况[J].粮食与油脂, 2003(11): 12-14.PU Hai-yan, HE Zhi-fei, LIU Chun-fen, et al. Research survey on functional fats and oils from microorganisms[J]. Journal of Cereals & Oils, 2003(11): 12-14.
[10] 罗玉萍, 杨荣英, 李思光, 等. 产棕榈油酸酵母菌的分离和鉴定[J]. 微生物学报, 1995, 35(6): 400-403.LUO Yu-ping, YANG Rong-ying, LI Si-guang, et al. Isolation and characterization of yeast production palmitoleic acid[J]. Acta Microbiologica Sinica, 1995, 35(6): 400-403.
[11] 耿青伟, 吴开云, 吴小芹, 等. 利用深黄被孢霉发酵生产油脂的初步研究[J]. 林业科学研究, 2010, 23(3): 336-341.GENG Qing-wei, WU Kai-yun, WU Xiao-qin, et al. Preliminary study on the mortierella isabellina fermentating to produce lipid[J]. Forest Research, 2010, 23(3): 336-341.
[12] 孔祥莉, 刘波, 赵宗保, 等. 斯达氏油脂酵母利用混合糖发酵产油脂[J]. 生物加工过程, 2007, 5(2): 36-41.KONG Xiang-li, LIU Bo, ZHAO Zong-bao, et al. Microbial production of lipids by cofermentation of Glucose and xylose with Lipomyces starkeyi[J]. Chinese Journal of Bioprocess Engineering, 2007, 5(2): 36-41.
[13] 曲威, 刘波, 吕建州, 等. 高产油脂斯达氏酵母菌株的选育及摇瓶发酵条件的初步研究[J]. 辽宁师范大学学报: 自然科学版, 2006, 29(1): 88-92.QU Wei, LIU Bo, LÜ Jian-zhou, et al. Study on the culture and fermentation conditions of the high lipid lipomyces starkeyi[J].Journal of Liaoning Normal University: Natural Science Edition,2006, 29(1): 88-92.
[14] 郭书贤, 王振伟, 刘欢, 等. 斯达油脂酵母发酵食品生产废水产油脂的研究[J]. 中国食品学报, 2010, 10(4): 245-251.GUO Shu-xian, WANG Zhen-wei, LIU Huan, et al. Study on the microbial lipid production from fermentation of food products waste water by lipomyces starkeyi[J]. Journal of Chinese Institute of Food Science and Technology, 2010, 10(4):245-251.
[15] 李永红, 刘波, 赵宗保, 等. 圆红冬孢酵母菌发酵产油脂培养基及发酵条件的优化研究[J]. 生物工程学报, 2006, 22(4):650-655.LI Yong-hong, LIU Bo, ZHAO Zong-bao, et al. Optimized culture medium and fermentation conditions for lipid production by rhodosporidium toruloides[J]. Chinese Journal of Biotechnology, 2006, 22(4): 650-655.
[16] 王敏, 李市场, 刘红霞, 等. 黏红酵母 Rhodotorula glutinis,微生物油脂提取工艺研究[J]. 中国粮油学报, 2010, 25(6): 71-75.WANG Min, LI Shi-chang, LIU Hong-xia, et al. Study on extracting microbial oil from Rhodotorula glutinis[J]. Journal of the Chinese Cereals and Oils Association, 2010, 25(6): 71-75.
[17] 相光明, 赵祥颖, 刘建军. 高产油脂隐球酵母菌发酵条件研究[J]. 粮食与油脂, 2009(3): 17-20.XIANG Guang-ming, ZHAO Xiang-ying, LIU Jian-jun. Studies on fermentation conditions for lipid production by Cryptococcus aerius[J]. Journal of Cereals & Oils, 2009(3): 17-20.
[18] 沈珺珺, 李富超, 杨庆利, 等. 皮状丝孢酵母利用大米草水解液发酵生产微生物油脂[J]. 海洋科学, 2007, 31(8): 38-41.SHEN Jun-jun, LI Fu-chao, YANG Qing-li, et al.Fermentation of Spar tina anglica acid hydrolysate by Trichosporon cutaneumfor microbial lipid production[J]. Marine Sciences, 2007, 31(8):38-41.
[19] 李新社, 陆步诗, 曾海波. 皮状丝孢酵母在酶法水解丢糟生产微生物油脂中的应用[J]. 酿酒科技, 2009, 186(12): 87-90,92.LI Xin-she, LU Bu-shi, ZENG Hai-bo. Application of trichosporon cutaneum in the production of microbial oil by enzymatic hydrolysis of distiller’s grains[J]. Liquor-Making Science & Technology, 2009, 186(12): 87-90, 92.
[20] 张杰, 张晓东, 李岩, 等. 多纤维素酶协同降解玉米秸秆及水解液微生物油脂发酵研究[J]. 现代化工, 2008, 28(2): 133-135.ZHANG Jie, ZHANG Xiao-dong, LI Yan, et al. Research on cellulase cooperative hydrolysis of corn stalk and microbial lipids fermentation from hydrolysates[J]. Modern Chemical Industry, 2008, 28(2): 133-135.
[21] 孙军德, 杨冉. 产油酵母菌的筛选及其利用玉米秸秆发酵产油研究[J]. 沈阳农业大学学报, 2010, 41(3): 335-338.SUN Jun-de, YANG Ran. Screening,fermentation and identification characters of oleaginous yeasts by utilizing corn strews[J]. Journal of Shenyang Agricultural University, 2010,41(3): 335-338.
[22] 黄秀梨. 微生物学实验指导[M]. 北京: 高等教育出版社,2006: 1-7.HUANG Xiu-li. Microbiology experimental guide[M]. Beijing:Higher Education Press, 2006: 1-7.
[23] Mandels M, Weber J. Production of cellulases[J]. Adv Chem Ser,1969, 95: 391-414.
[24] 刘雅琴, 马俊良. 玉米秸秆粉混合菌发酵生产饲料蛋白的研究[J]. 畜牧与饲料科, 2009, 30(9): 36-38.LIU Tian-xia, LIU Ya-qin, MA Jun-liang. Study on fermentation of corn straw powder with multi-strains in feed production of proteins[J]. Animal Husbandry and Feed Science, 2009, 30(9):36-38.
[25] 王文岭, 黄雪松. DNS法测定木糖含量最佳测定波长的选择[J]. 食品科学, 2006, 27(4): 196-198.WANG Wen-ling, HUANG Xue-song. Identification of optimum wavelength assayed by DNS method for determination of xylose content[J]. Food Science, 2006, 27(4): 196-198.
[26] 陈钧辉. 生物化学实验(第四版)[M]. 北京: 科学出版社, 2008:20-22, 32-34.CHEN Jun-hui. Biochemical experiments[M]. Beijing: Science Press, 2008: 20-22, 32-34.
[27] 邹水洋, 肖凯军, 郭祀远. 康宁木霉液态发酵高产纤维素酶和木聚糖酶[J]. 华南理工大学学报: 自然科学版, 2009, 37(6):69-70.ZOU Shui-yang, XIAO Kai-jun, GUO Si-yuan. Submerged fermentation of trichoderma koningii for high-yield cellulase and xylanase[J]. Journal of South China University of Technology:Natural Science Edition, 2009, 37(6): 69-70.
[28] 王菁莎, 王颉, 刘景彬. 康宁木霉固态发酵秸秆生产纤维素酶的研究[J]. 纤维素科学与技术, 2005, 13(4): 27-30.WANG Jing-sha, WANG Jie, LIU Jing-bin. Studies on solid state fermentation for cron stalk by trichoderma koningii producing cellulase[J]. Journal of Cellulose Science and Technology, 2005,13(4): 27-30.
