藻蓝蛋白对2型糖尿病大鼠血糖的调节作用
2011-08-02李继发王世金郭恒照济宁市任城区兖矿集团第三医院山东济宁707
李继发 王世金 郭恒照 (济宁市任城区兖矿集团第三医院,山东 济宁 707)
2型糖尿病是一种自然免疫和低度炎症性疾病,细胞因子是导致代谢综合征的主要原因,而炎症是胰岛素抵抗的触发因素〔1〕。甚至在亚临床阶段,慢性炎症就参与了胰岛素抵抗综合征的发生〔2〕。在整个炎症网络中,核因子 κB(NF-κB)是研究的热点之一。NF-κB抑制蛋白(I-κB)激酶/NF-κB炎症通路活化是导致胰岛素抵抗和糖尿病的重要机制之一〔3〕。张冬梅等〔4〕研究表明,藻蓝蛋白在脑缺血损伤中具有抗炎和神经保护作用,但其在2型糖尿病病理生理过程中是否具有抗炎作用尚未见报道。为此,本实验建立2型糖尿病大鼠,试图应用藻蓝蛋白进行干预,研究其对胰岛细胞功能的影响和机制。
1 材料与方法
1.1 动物模型 健康雄性Wistar大鼠30只,体重120~140 g,由青岛市药检所实验动物中心提供〔SCXK(鲁)20030010〕。动物均于实验前置于实验室适应环境1 w,自由饮食,室温(23±2)℃,自然光照,相对湿度50% ~70%。随机分为对照组、模型组和治疗组各10只。对照组10只大鼠喂以普通饲料,其余2组均喂以高糖高脂饲料(15%猪油、20%蔗糖、13%蛋黄粉、2%胆酸钠、59%普通饲料),饲养4 w后禁食12 h,以30 mg/kg的剂量一次性腹腔注射1%链脲佐菌素(STZ)柠檬酸缓冲液,对照组大鼠同步注射同剂量的柠檬酸缓冲液。注射4 w后分别剪尾取血,测空腹血糖(FBG),以血糖值≥7.0 mmol/L视为糖尿病模型建立成功〔5〕,其中16只造模成功。
1.2 干预措施 糖尿病模型成功后开始干预治疗。藻蓝蛋白粉剂(中国科学院海洋研究所提供)暗室分装后-20℃保存,加蒸馏水稀释至浓度为10%的混悬液,按500 mg/kg体重灌胃,每天1次,连续10 d。对照组和病模型组同步给予等体积的生理盐水,连续灌胃10 d。
1.3 FBG测定 各组动物分别在造模前、造模后、治疗后测定FBG(mmol/L)。测前,大鼠禁食、禁水12 h,次日鼠尾静脉取血,用自动血糖仪(强生医疗器材有限公司,稳豪型)测定FBG。
1.4 标本采集及处理 治疗结束后,各组大鼠10%水合氯醛腹腔注射麻醉,4%多聚甲醛心脏灌注固定,取胰腺组织,常规梯度酒精脱水,二甲苯透明,石蜡包埋,LEICA2135石蜡切片机连续切片,厚度5 μm,每隔10片取1片,每个标本取6片,分别裱于涂有多聚赖氨酸的载玻片上,室温保存备用。
1.5 细胞凋亡检测 TUNEL试剂盒由武汉博士德生物公司提供。取上述切片置于60℃烤箱1 h,常规脱蜡,蒸馏水浸泡2 min,按试剂盒说明书操作,DAB显色,光镜下细胞核出现片状棕黄色颗粒者为阳性着色,即凋亡细胞。部分切片不加探针,以0.1 mol/L PBS替代染色,不出现阳性着色。在光镜(400倍)下观察,每张切片随机选取4个视野,计数每个视野100个胰岛细胞中凋亡细胞所占的百分比的均数即为凋亡指数(AI)。
1.6 免疫组化染色 NF-κB p65和I-κB亲和纯化抗体、即用型SABC试剂盒、DAB显色试剂盒,均由武汉博士德生物公司提供。取上述切片置于60℃烤箱烤片1 h,常规脱蜡,蒸馏水浸泡2 min,严格按试剂盒说明书操作,DAB显色,光镜下特异性染色为棕黄色粗颗粒。部分切片不加一抗以0.1 mol/L PBS替代染色,不出现阳性着色。在光镜(400倍)下观察,每张切片随即选择4个视野,计数每个视野内胰岛细胞团中NF-κB和I-κB的阳性细胞数及胰岛细胞的总数。
1.7 统计学处理 采用SPSS11.5软件,计量资料结果以表示,两组间比较采用t检验,多组间比较采用方差分析。
2 结果
2.1 FBG 造模前各组大鼠FBG无统计学差异,造模后大鼠FBG较对照组明显升高(P<0.05)。经藻蓝蛋白治疗后,大鼠FBG较模型组显著下降(P<0.05)。见表1。
表1 各组大鼠FBG比较(,mmol/L)
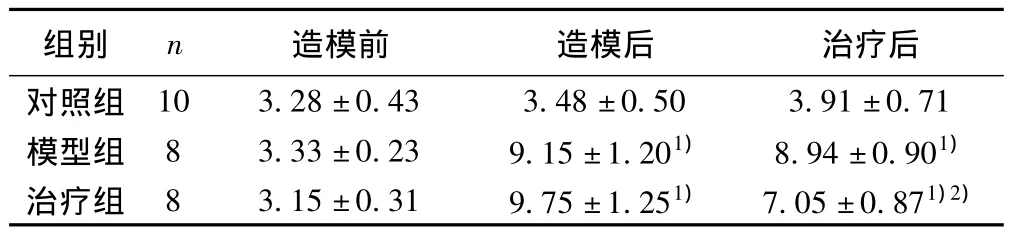
表1 各组大鼠FBG比较(,mmol/L)
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05
造模前 造模后 治疗后对照组组别 n 10 3.28±0.43 3.48±0.50 3.91±0.71模型组 8 3.33±0.23 9.15±1.201) 8.94±0.901)治疗组 8 3.15±0.31 9.75±1.251) 7.05±0.871)2)
2.2 胰岛细胞凋亡 对照组大鼠胰岛可见少量散在的凋亡阳性细胞,模型组大鼠胰岛边界模糊,阳性细胞较对照组明显增多(P<0.05),治疗组大鼠胰岛边界较清晰,凋亡阳性细胞较模型组显著减少(P<0.05)。见表2和图1。
表2 各组大鼠胰岛细胞AI、NF-κB和I-κB表达的比较()

表2 各组大鼠胰岛细胞AI、NF-κB和I-κB表达的比较()
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05
组别 n AI(%) NF-κB(%) I-κB(%)10 6.00±1.63 15.7±1.83 78.5±2.55模型组 8 20.75±2.501) 38.3±3.811) 31.2±4.801)治疗组 8 12.25±2.221)2) 20.6±3.201)2) 58.0±5.261)2)对照组
2.3 NF-κB和I-κB表达 对照组大鼠胰岛细胞质NF-κB表达较强,显棕黄色。糖尿病模型组大鼠胰岛细胞核NF-κB表达显著增强,细胞核呈明显棕黄色着色,细胞质几乎不着色。藻蓝蛋白治疗组大鼠胰岛细胞核NF-κB表达较模型组明显降低,细胞核呈淡黄色(图2和表2)。对照组大鼠胰岛细胞质呈深棕黄色着色,细胞核几乎不着色。糖尿病模型组大鼠胰岛细胞核、质表达明显减弱。藻蓝蛋白治疗组大鼠胰岛细胞质有棕黄色着色,较糖尿病组加深(图3和表2)。
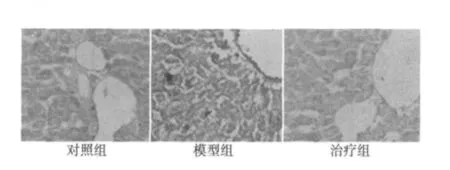
图1 各组大鼠胰岛凋亡细胞数量比较(TUNEL,×400)
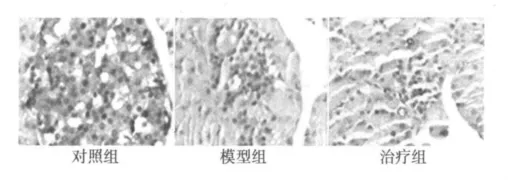
图2 各组大鼠胰岛细胞NF-κB的表达(SABC,×400)
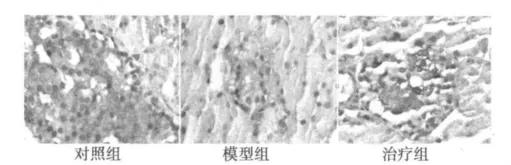
图3 各组大鼠胰岛细胞I-κB的表达(SABC,×400)
3 讨论
研究表明,大鼠胰腺是STZ毒性损伤的靶器官,STZ可以通过一氧化氮和自由基等途径损伤胰岛β细胞诱发糖尿病〔6〕,而自由基是激活NF-κB的因素之一。由此推测,糖尿病大鼠胰腺中有I-κB/NF-κB通路的活化。本实验NF-κB免疫组化结果可见,正常组大鼠胰岛细胞团中胰岛细胞质呈明显棕黄色着色,只局部胰岛细胞核有着色,而糖尿病大鼠胰岛细胞团中胰岛细胞核呈明显棕黄色着色,细胞质几乎不着色。I-κB免疫组化结果显示,正常组大鼠胰岛细胞质呈深棕黄色着色,细胞核几乎不着色,而糖尿病组大鼠胰岛细胞核、质几乎都不着色。这正体现了I-κB被降解后,激活的NF-κB从细胞质到细胞核的转移过程。藻蓝蛋白干预组大鼠NF-κB的免疫组化结果可见,胰岛细胞核着淡棕黄色,着色程度较糖尿病组明显减轻。I-κB的免疫组化结果显示,蓝藻蛋白干预组大鼠胰岛细胞质有棕黄色着色,着色程度较糖尿病组加深。表明药物干预后I-κB的活性可能有所恢复,NF-κB在胰岛细胞核中的表达降低。这提示藻蓝蛋白可能具有抑制I-κB/NF-κB通路活化的作用。
长期高血糖使胰岛素需求不断增加,β细胞处于持续活化状态,一方面削弱胰岛β细胞合成和分泌胰岛素的功能,使葡萄糖刺激的胰岛素分泌减少,甚至缺失;另一方面,长期高血糖加速β细胞凋亡,使有功能的β细胞数量减少,两者共同作用加重了胰岛β细胞功能的衰竭。导致β细胞凋亡的因素很多,例如胰淀素、葡萄糖、游离脂肪酸、细胞因子、一氧化氮、活性氧簇等〔7〕。沙鼠实验发现随着血糖的增高,β细胞的凋亡频率逐步上升〔8〕。本实验结果显示,造模成功后,大鼠 FBG显著升高,胰岛凋亡细胞是明显增多,经藻蓝蛋白治疗后,大鼠FBG较模型组显著下降、胰岛细胞凋亡数量明显减少。推测藻蓝蛋白可能作用于胰岛β细胞,保护胰岛β细胞,减少其凋亡,但其具体机制有待进一步研究。
1 Dandona P,Aljada A,Bandyopadhyay A.Inflammation:the link between insulin resistance,obesity and diabetes〔J〕.Trends Immunol,2004;25(1):4-7.
2 Festa A,D'Agostino R Jr,Howard G,et al.Chronic subclinical inflammation as part of the insulin resistance syndrome:the Insulin Resistance Atherosclerosis Study(IRAS)〔J〕.Circulation,2002;102(1):42-7.
3 Blaak EE.Fatty acid metabolism in obesity and type 2 diabetes mellitus〔J〕.Proc Nutr Soc,2003;62(6):753-60.
4 张冬梅,刘吉东,陈红兵,等.藻蓝蛋白对脑缺血再灌注后NF-κB和IL-6表达及神经细胞凋亡的影响〔J〕.中国海洋药物,2005;24(1):6-10.
5 郭啸华,志 红,李 恒,等.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点〔J〕.中国糖尿病杂志,2002;10(2):290-2.
6 Takasa N,Komiya I,Asawa T,et al.Streptozotocin and alloxan-induced H2O2generation and DNA fragmentation in pancreatic islets.H2O2as mediator for DNA fragmentation〔J〕.Diabetes,1991;40:1141-5.
7 Mandrup-Poulsen T.Apoptotic signal transduction pathways in diabetes〔J〕.Biochem Pharmacol,2003;66:1433-9.
8 Donath MY,Gross DJ,Cerasi E,et al.Hyperglycemia-induced beta-cell apoptosis in pancreatic islets of Psammomys obesus during development of diabetes〔J〕.Diabetes,1999;48:738-46.
