咪喹莫特对哮喘小鼠Toll样受体7及IL-12、IL-13水平的影响
2011-08-02陈苗苗李志洁郑州大学第二附属医院儿科河南郑州450014
陈苗苗 李志洁 (郑州大学第二附属医院儿科,河南 郑州 450014)
支气管哮喘是一种由多种细胞(嗜酸性粒细胞、肥大细胞、T淋巴细胞、中性粒细胞及气道上皮细胞等)和细胞组分参与的气道慢性炎症性疾病,其病理特点是嗜酸性粒细胞和淋巴细胞浸润,黏液分泌增多和气道狭窄等。哮喘的机制十分复杂,其中Th1与Th2平衡失调是哮喘的重要发病机制。近年研究发现,Toll样受体(toll-like receptors,TLRs)是一类I型跨膜蛋白介导的天然免疫模式识别受体,其中TLR7是其中的重要成员之一。M¨oller-Larsen等〔1〕研究发现TLR7基因与哮喘密切相关,TLR7能特异性识别人工合成的小分子免疫调节剂咪喹莫特,识别后能上调其表达并能进一步诱导Th1类细胞因子IL-12、抑制Th2类细胞因子IL-13的产生,以维持机体免疫功能的平衡。本文以哮喘小鼠为动物模型,利用逆转录-聚合酶链反应(RT-PCR)测定肺组织中TLR7 mRNA的表达水平,并测定肺泡灌洗液中IL-12和IL-13的浓度,旨在探讨咪喹莫特治疗哮喘的主要作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 4周龄清洁级雌性BALB/C纯系小鼠30只,体重15~20 g,购自郑州大学实验动物中心。
1.1.2 设备与制剂 咪喹莫特(上海特化医药有限公司),鸡卵白蛋白(OVA,美国Sigma公司),小鼠IL-12和IL-13 ELISA试剂盒(美国R&D公司)。小鼠TLR7引物序列,上游:cctcaaggctcagaagat,下游:cccactaacaccaccaat。Trizol、逆转录试剂盒、dNTP、Taq DNA聚合酶、Trans DNA Marker I(北京全式金生物有限公司),引物(北京三博远志生物技术有限责任公司),低温冰箱(SANYO公司),低温离心机(Sigma公司),无菌操作台(苏州净化设备有限公司),酶标仪(Multiskan MK3,Thermo Labsystems公司),PCR仪(珠海黑马医学仪器有限公司)。
1.2 方法
1.2.1 实验动物分组与模型建立 SPF级雌性BALB/C系小鼠30只随机分成3组,每组10只。B组(哮喘模型组):小鼠腹腔注射0.1 ml OVA致敏液(含OVA 100 μg和氢氧化铝凝胶400 μg),再以相同的剂量和方法在第7天和第14天各致敏一次,21 d后以10 g/L OVA溶液超声雾化激发,每天30 min,持续7 d。C组(咪喹莫特组):在哮喘组的基础上,在雾化吸入OVA溶液前1 h预先吸入1.5 g/L咪喹莫特混悬液30 min,连续7 d。A组(正常对照组):第0、7、14天给予小鼠腹腔注射生理盐水0.1 ml,21 d后以生理盐水溶液超声雾化激发,每天30 min,持续 7 d。
1.2.2 支气管肺泡灌洗(BAL)及支气管肺泡灌洗液(BALF)细胞分离与计数 在末次激发后24 h,各组小鼠予以100 g/L水合氯醛溶液400 mg/kg腹腔注射麻醉,立即打开胸腔,在环状软骨上用血管钳将气管固定并在其下作一个横行切口,置入连接注射器的硅胶管,每次缓慢注入生理盐水0.4 ml,分3次注入,每次灌洗完后立即回收置于高压灭菌过的EP管中,计量,并放于 -4℃冰箱储存,2 h内作细胞分离。BALF于2 000 r/min离心20 min,细胞沉淀用0.5 ml PBS液重悬,取0.1 ml在血细胞技术台测定细胞总数;取0.2 ml进行涂片,Wright-Giemsa染色,计数大于200个细胞作细胞分类计数。
1.2.3 三组小鼠BALF中IL-12、IL-13水平检测 采用小鼠IL-12、IL-13 ELISA检测试剂盒,按照试剂盒说明书进行操作,根据吸光度值计算出标本中所含各因子的含量。
1.2.4 小鼠肺组织病理改变 三组小鼠在末次激发后24 h,立即打开胸腔,取出左上叶肺组织,用4%中性多聚甲醛固定20 h,石蜡切片后HE染色,显微镜下观察肺组织的炎症变化。
1.2.5 小鼠肺组织TLR7 mRNA表达水平的检测 三组小鼠在末次激发后24 h,立即打开胸腔,取出右上叶肺组织,冻存,-80℃保存,待提取总RNA进行RT-PCR。小鼠肺组织RNA提取按Trizol说明书进行操作,RT-PCR条件如下:42℃ RT 30 min,85℃加热5 min。终止RT反应的同时进行扩增预变性,94℃预变性2 min,1 个循环;94℃变性 30 s,55℃ 退火 30 s,72℃延伸2 min,共35个循环;72℃延伸6 min。PCR产物在2%琼脂糖凝胶上,在10 V/cm电压下电泳30 min,在紫外线投射仪下观察电泳条带,用D-140图像记录分析系统进行分析,计算目的基因和β-actin的DNA条带灰度值比值。
1.3 统计学处理 采用SPSS11.5统计学软件,计量资料用表示,组间比较用单因素方差分析,数据间两两比较用q检验。
2 结果
2.1 HE染色及光镜观察肺组织病理改变 正常对照组小鼠气道上皮平整,肺泡腔内未见炎性渗出,黏膜下也未见炎症细胞浸润,气管平滑肌无增厚。哮喘模型组小鼠细支气管的管壁增厚,平滑肌增生,可见上皮细胞脱落、排列紊乱,周围组织水肿,血管通透性增加,血管和支气管周围组织可见大量炎性细胞浸润,以淋巴细胞为主。咪喹莫特组小鼠炎症程度较哮喘模型组减轻。见图1。
2.2 BALF中细胞计数与分类 哮喘模型组BALF中细胞主要由嗜酸性粒细胞和单核细胞组成,细胞总数及各种炎症细胞与正常对照组比较明显增加;咪喹莫特治疗组小鼠中的淋巴细胞和嗜酸性粒细胞比哮喘模型组显著减少。见表1。
表1 三组小鼠BALF总细胞数及细胞分类比较(n=10,)

表1 三组小鼠BALF总细胞数及细胞分类比较(n=10,)
与正常对照组比较:1)P<0.05;与哮喘模型组比较:2)P<0.05
嗜酸性粒细胞正常对照组 1.81±0.172) 89.18±5.432) 2.44±1.82 7.83±0.87 0.53±0.142)组别 细胞总数(×106/L)各种炎症细胞所占的比例(%)单核细胞 淋巴细胞 中性粒细胞哮喘模型组 8.86±0.851) 64.25±10.15 5.48±1.01 2.08±0.56 28.27±1.90咪喹莫特组 4.30±0.501)2) 79.38±8.121)2) 2.20±0.321) 8.46±0.66 9.84±1.251)2)
2.3 各组小鼠肺泡灌洗液中IL-12、IL-13水平 哮喘模型组小鼠肺泡灌洗液中IL-12水平较正常对照组降低,咪喹莫特组小鼠肺泡灌洗液中IL-12水平与哮喘模型组相比升高,但较正常对照组降低。哮喘模型组小鼠肺泡灌洗液中IL-13水平较正常对照组升高,咪喹莫特组小鼠肺泡灌洗液中IL-13与哮喘模型组比较降低,但较正常对照组升高。见表2。
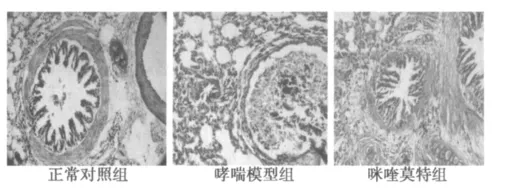
图1 三组小鼠肺组织病理切片(HE,×200)
表2 ELISA法检测三组小鼠BALF中IL-12、IL-13 水平 (pg/ml,n=10,)

表2 ELISA法检测三组小鼠BALF中IL-12、IL-13 水平 (pg/ml,n=10,)
与正常对照组比较:1)P<0.05;与哮喘模型组比较:2)P<0.01
IL-12 IL-13正常对照组 27.68±1.192)组别<0.01 <0.01 30.88±1.50哮喘模型组 20.26±2.121) 37.14±1.631)咪喹莫特组 25.23±1.571)2) 32.75±2.452)F值 37.72 27.78 P值
2.4 各组小鼠肺组织TLR7 mRNA的表达 哮喘模型组小鼠肺组织TLR7 mRNA的表达(0.133±0.021)低于正常对照组(0.239±0.036),咪喹莫特组小鼠肺组织TLR7 mRNA的表达(0.826±0.124)明显高于哮喘模型组及正常对照组。见图2。
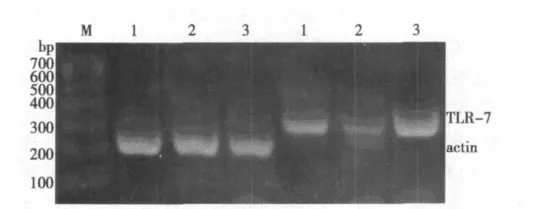
图2 小鼠肺组织TLR7 mRNA的表达
3 讨论
哮喘的发病机制尚不十分清楚,近年来国内外研究表明免疫失衡在哮喘的发病机制中起着重要的作用,其中辅助T细胞(Th)亚群Th1/Th2细胞失衡是导致哮喘发病的重要环节。Th细胞分泌的多种细胞因子与哮喘的气道炎症和气道高反应性关系密切,主要表现在Th1细胞功能减弱而Th2细胞功能增强。Th1细胞主要分泌IFN-γ、IL-12,Th2细胞主要分泌IL-4、IL-5、IL-13。IL-12是刺激Th1分化的最有力的细胞因子,能调节Th1/Th2免疫应答,促使Th0细胞向Th1分化,并促进多种细胞因子尤其是IFN-γ的分泌,抑制Th2细胞的功能,减少肺内嗜酸性粒细胞的浸润,降低气道的高反应性〔3〕。IL-13是一种多效性细胞因子,主要由Th2细胞产生,可诱导单粒巨噬细胞分化并延长其生存期,参与T、B淋巴细胞发育,调节Th1、Th2细胞功能;通过激活嗜酸性粒细胞,减少其凋亡,促进IgE分泌等机制,在哮喘等变态反应性疾病中发挥重要作用〔4〕。目前调整Th亚群的平衡成为开发哮喘治疗药物的重要方向,免疫治疗已成为开发哮喘药物治疗的热点。
TLR是新近发现的细胞跨膜受体,作为连接天然免疫与特异性免疫的关键元件,在急性炎症反应、细胞信号转导方面起重要作用,与哮喘炎症与气道重塑关系密切〔5〕。咪喹莫特(Imiquimod)是一种小分子干扰素诱导新型免疫调节剂,是Toll样受体7的特异性配体,主要由巨噬细胞、B细胞、单核细胞和树突状细胞等抗原递呈细胞所识别。它和这些细胞表面的TLR7特异性结合后,诱导Ⅰ型干扰素和Th1细胞因子IL-12等的产生〔6〕,抑制 Th2细胞因子 IL-4和 IL-13等分泌〔7〕,使原始 Th细胞向Th1细胞分化,提示咪喹莫特可能对治疗以Th2反应为主的支气管哮喘有效〔8〕。
本实验结果显示,哮喘小鼠支气管平滑肌增厚,血管和支气管周围组织可见大量炎性细胞浸润,以淋巴细胞为主;哮喘小鼠BALF中的IL-12水平降低而IL-13水平升高;这表明了Th1/Th2细胞免疫失衡是哮喘发病的关键机制,IL-12生成不足是哮喘发病的重要原因之一。Th1型细胞因子IFN-γ、IL-12减少和Th2型细胞因子IL-4、IL-13增多,将会增加感染呼吸道病毒的机会,促使哮喘加重〔9〕。实验结果还显示了哮喘小鼠肺组织中的TLR7 mRNA表达较正常组小鼠减弱,这也证实了Roponen等〔10〕研究中提到的Toll样受体7的功能降低增加了患呼吸道疾病如哮喘的机率。
本实验结果显示,咪喹莫特组小鼠肺组织TLR7 mRNA较哮喘组小鼠表达增加,进一步论证了国外Jongdae等的研究成果即咪喹莫特可以上调TLR7基因的表达〔11〕的观点。BALF中IL-12水平较哮喘组升高而IL-13降低,有利于Th1反应优势的形成。组织病理学提示咪喹莫特组小鼠支气管上皮组织增生及气道周围炎症细胞浸润较哮喘组显著减轻,BALF中单核细胞、淋巴细胞、嗜酸性粒细胞较哮喘组明显下降,提示该药可以在一定程度上减轻哮喘的气道炎症。可能的机制为:①咪喹莫特与TLR7特异性结合,通过Toll样受体7-MyD88依赖的信号系统诱导NF-κB的活性,促使TLR7 mRNA表达增加;②增加IL-12的水平,促进Th1的细胞应答反应,抑制Th2的体液免疫应答,使BALF中的嗜酸性粒细胞显著降低;③降低IL-13的水平,使嗜酸性粒细胞、单核细胞、淋巴细胞等趋化到炎症部位受阻,表明了TLR7的配体咪喹莫特对支气管哮喘有积极的保护作用。Du等〔12〕还发现在哮喘大鼠模型中,TLR7的配体 imiquimod通过降低血清中的IgE和Th2细胞因子IL-4、IL-5和IL-13来减轻哮喘的气道炎症和气道重塑。
综上所述,咪喹莫特在治疗支气管哮喘的实验研究中,通过上调TLR7 mRNA表达,改变Th1/Th2及其细胞因子的组成,抑制支气管及肺泡周围的炎症细胞尤其是下调嗜酸性粒细胞的浸润,即促进Th1细胞及其细胞因子IL-12,抑制Th2细胞及其细胞因子IL-13。因此雾化吸入一定浓度的咪喹莫特可能是治疗哮喘的一个新的免疫治疗手段,也为临床上治疗哮喘提供了一个新的靶点。
1Mo¨ller-Larsen S ,Nyegaard M,Haagerup A,et al.Association analysis identifies TLR7 and TLR8 as novel risk genes in asthma and related disorders〔J〕.,2008;63:1064-9.
2 Hansbro NG,Horvat JC,Wark PA,et al.Understanding the mechanisms of induced asthma:New therapeutic direction〔J〕.Pharmacol Ther,2008;117:313-53.
3 Matsuse H,Kong X,Hu J,et al.Intranasal IL-12 produces discrete pulmonary and systemic effects on allergic inflammation and airway reactivity〔J〕.Int Immunop-harmacol,2003;3(4):457-68.
4 沈慧芳,尹 柯.哮喘患者血清IL-12、IL-13及IgE的测定及意义〔J〕.中国现代医学杂志,2010;20(24):3796-801.
5 黄剑伟,莫碧文.Toll样受体与支气管哮喘〔J〕.中华哮喘杂志,2009;35:375-9.
6 Hudson J,Radzioch D,Camateros P,et al.Modulation of the allergic Asthma transcriptome following resiquimod treatment〔J〕. Physiol-Genomics,2009;38:303-18.
7 Camateros P,Tamaoka M,Hassan M,et al.Chronic asthma-induced airway remodeling is prevented by Toll-like receptor-7/8 ligand S2〔J〕.Am J Respir Crit Care Med,2007;175:1241-9.
8 金淑贤,殷凯生,卞 涛,等.咪喹莫特对小鼠哮喘模型气道炎症和STAT6表达的影响〔J〕.第四军医大学学报,2006;27(6):548-52.
9 Xatzipsalti M,Kyrana S,Tsolia M,et al.Rhinovirus viremia in children with respiratory infections〔J〕.Am J Respir Crit Care Med,2005;172:1037-40.
10 Roponen M,Yerkovich ST,Hollams E,et al.Toll-like receptor 7 function is reduced in adolescents with asthma〔J〕.Eur Respir J,2010;35(1):64-71.
11 Jongdae Lee,Tsung-Hsien Chuang,Vanessa Redecke,et al.Molecular basis for the immunostimulatory activity of guanine nucleoside analogs:Activation of Toll-Like receptor 7〔J〕.Nat Immunol,2003;100(11):196-200.
12 Du Q,Zhou LF,Chen Z,et al.Imiquimod,a toll-like receptor 7 ligand,inhibits airway remodeling in a murine model of chronic asthma〔J〕.Clin Exp Pharmacol Physiol,2009;36:43-8.
