芍药苷对脂肪组织释放游离脂肪酸及抗氧化作用的影响
2011-08-02刘雨娟蔺美玲张小郁郑天珍
刘雨娟 黄 征 蔺美玲 张小郁 郑天珍
(兰州大学基础医学院生理学与心理学研究所,甘肃 兰州 730000)
肥胖病的机制主要与人的气血多少,痰浊以及淤血有关。芍药能养血活血,柔肝止痛,敛阴收汗,属于滋阴药。芍药苷是从芍药中提取的最主要的生物活性成分。现代医学认为芍药苷具有多种药理活性,如解痉、镇痛、镇静及改善学习记忆的作用,还具有抗自由基损伤,抑制细胞内钙超载和抗KA神经毒性等多种生物学效果〔1〕。我们的前期工作已证明白芍水煎剂能显著抑制去卵巢肥胖大鼠的体重和血清甘油三酯(TG)水平的升高,同时可以改善大鼠体内脂代谢紊乱,清除过多的自由基,提高机体的抗氧化能力。但其化学成分芍药苷是否对脂肪组织有直接的影响,目前国内外尚未见报道。本实验观察其对离体脂肪组织释放游离脂肪酸(FFA)及抗氧化作用的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 实验材料 健康成年SD大鼠,体重(250±20)g。由兰州大学医学实验中心提供,动物等级为清洁级。芍药苷由陕西旭煌植物科技发展有限公司提供。异搏定为兰州制药厂产品。普萘洛尔(心得安)为北京第二制药厂产品。AC抑制剂(SQ22,536)和小牛血清白蛋白(BSA)由Sigma公司提供。盐酸肾上腺素为天津金耀氨基酸公司产品。丙二醛(MDA)和总抗氧化能力(T-AOC)检测的试剂盒由南京建成生物工程研究所提供。
1.2 方法 将SD大鼠脱臼处死,迅速剪取腹膜后脂肪组织块,每份(50±2.0)mg,放入37℃的含有0.04 g/ml小牛血清白蛋白的Krebs液中温育。温育液中可分别加入不同浓度的芍药苷及不同的阻断剂,加入的药物容量均为20 μl。温育过程中持续通入95%的O2和5%CO2的混合气体。90 min后,吸取温育液用一次提取比色法测定FFA的含量。用化学反应法检测MDA及T-AOC,检测方法均严格按照试剂盒说明操作。
1.3 实验分组 实验分为8组,分别为:①正常对照组(0.9%NaCl);②盐酸肾上腺素(10-6mol/L)组;③芍药苷低剂量(10-7mol/L)组;④芍药苷中剂量(10-6mol/L)组;⑤芍药苷高剂量(10-5mol/L)组;⑥心得安(10-5mol/L)+芍药苷(106mol/L)组;⑦ SQ22,536(10-5mol/L)+ 芍 药 苷(106mol/L)组;⑧维拉帕米(异搏定)(10-5mol/L)+芍药苷(10-6mol/L)组。
1.4 统计学处理 SPSS11.5软件处理实验数据,用表示,组间显著性差异采用单因素方差分析法。
2 结果
2.1 芍药苷对脂肪组织释放FFA的影响 与正常对照组相比〔(34.75±2.14)μmol/L〕,盐酸肾上腺素可明显促进脂肪组织释放FFA〔(192.74±18.43)μmol/L,P<0.001)〕。低浓度芍药苷(10-7mol/L)对脂肪组织释放FFA无明显的促进作用〔(36.60 ± 2.87)μmol/L〕。中、高浓度的芍药苷 (10-6,10-5mol/L)可分别促进脂肪组织释放 FFA〔(44.58±2.02)μmol/L,(54.21 ±2.81)μmol/L,P <0.01,P <0.001〕,且存在相应的剂量效应关系(r﹦0.839,P<0.01)。
2.2 阻断剂对芍药苷促进脂肪组织释放FFA的影响 芍药苷(10-6mol/L)分别和心得安(10-5mol/L)、SQ22,536(10-5mol/L)、异搏定(10-5mol/L)共同温育时,可分别降低芍药苷促进脂肪组织释放FFA的作用(54.21±2.81,37.91±2.13,36.57±1.56,36.81 ±1.38),与浓度 10-6mol/L 的芍药苷组相比P<0.05和P<0.01。
2.3 芍药苷及阻断剂加芍药苷对脂肪组织中MDA和T-AOC的影响 与正常对照组相比,盐酸肾上腺素和芍药苷可显著降低脂肪组织中MDA的含量(P均<0.001);明显增高T-AOC水平(P < 0.001,P < 0.01)。心得安(10-6mol/L)、SQ22,536(10-6mol/L)、异搏定 (10-6mol/L)分别和芍药苷(10-6mol/L)共同温育时,其降低MDA、提高T-AOC的作用可部分被抑制,与浓度为10-6mol/L的芍药苷组差异显著(P<0.001,P <0.05,P <0.01)。见表1。
表1 芍药苷及阻断剂加芍药苷对离体脂肪组织中MDA和T-AOC的影响(,n=8)
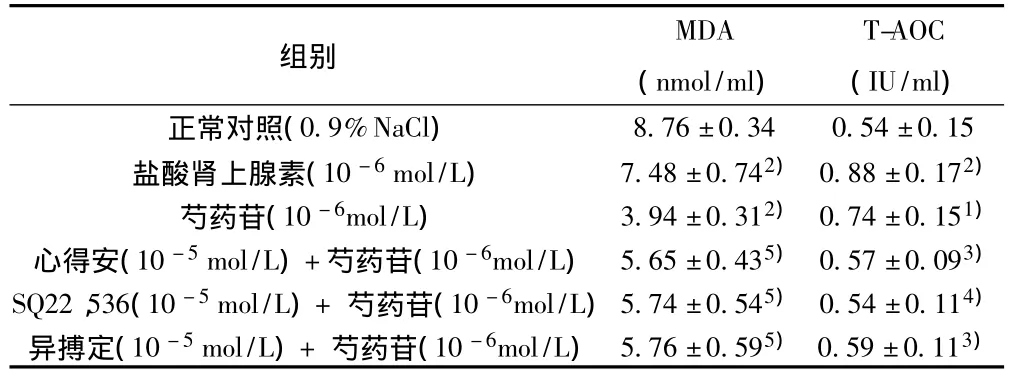
表1 芍药苷及阻断剂加芍药苷对离体脂肪组织中MDA和T-AOC的影响(,n=8)
与正常对照组比较:1)P<0.01,2)P<0.001;与10-6mol/L芍药苷组比较:3)P<0.05,4)P <0.01,5)P <0.001
组别MDA(nmol/ml)T-AOC(IU/ml)8.76±0.34 0.54±0.15盐酸肾上腺素(10-6mol/L) 7.48±0.742)0.88±0.172)芍药苷(10-6mol/L) 3.94±0.312)0.74±0.151)心得安(10-5mol/L)+芍药苷(10-6mol/L) 5.65±0.435)0.57±0.093)SQ22,536(10-5mol/L)+ 芍药苷(10-6mol/L)5.74±0.545)0.54±0.114)异搏定(10-5mol/L)+ 芍药苷(10-6mol/L)5.76±0.595)0.59±0.113)正常对照(0.9%NaCl)
3 讨论
FFA是贮存于脂肪细胞中的TG在激素敏感脂肪酶(HLS)的催化作用下水解生成。研究发现激素敏感脂肪酶还可能是TG水解的限速酶。在离体的脂肪组织中,脂肪动员过程主要由信号转导途径调控。在啮齿类动物中 β3肾上腺素受体(β3AR)主要分布于白色脂肪组织(WAT)和棕色脂肪组织(BAT)中。β3肾上腺素受体主要调节机体的脂肪分解和产热过程,β3AR激动剂通过刺激白色脂肪组织的脂解作用和棕色脂肪组织的非粟性产热,消耗贮脂,起到抗肥胖作用〔2〕。β3AR属于G蛋白偶联受体超家族,G蛋白贯通膜7次,并通过配体与受体结合,激活脂肪细胞内腺苷酸环化酶,增强环磷酰胺激活蛋白磷酸激酶A(PKA)的功效,PKA通过激活激素敏感性脂肪酶的磷酸化过程,活化激素敏感性脂肪酶,使TG分解生成FFA和甘油。大鼠脂肪细胞内存在的脂被蛋白能被蛋白激酶A磷酸化〔3〕。未磷酸化的脂被蛋白可能在脂滴表面形成一种“屏障”,阻止激素敏感性脂肪酶接触到脂滴内的TG,从而抑制脂肪分解,肾上腺素与脂肪细胞上β3AR结合后,激活cAMPPKA信号转导系统,引起脂被蛋白和激素敏感性脂酶同步磷酸化,进而导致TG水解。本实验结果发现用盐酸肾上腺素作用于脂肪组织时,可非常显著的促进FFA的释放,与上述理论是一致的。另外,本实验还发现芍药苷也可促进离体脂肪组织分解释放FFA,且存在相应的剂量效应关系;同时还能降低MDA含量,升高T-AOC水平。非选择性β肾上腺素受体阻断剂心得安和AC抑制剂(SQ22,536)可部分阻断芍药苷促进离体脂肪组织释放FFA,降低MDA含量,升高总抗水平的作用,据此可推测芍药苷的上述作用可能部分经由 β3AR,进而抑制cAMP-PKA信号转导途径来发挥作用。
细胞内钙离子的改变是细胞生理活动的重要物质基础,钙离子作为肌醇磷酯代谢途径中重要的第二信使在细胞内信号传导以及诱发一系列细胞功能事件中起重要作用。细胞内Ca2+来源于细胞外液Ca2+内流和细胞内钙库Ca2+释放(主要是肌质网,SR)。大量的证据表明,胞外Ca2+内流起决定性作用,Ca2+内流亦可激发细胞内钙库中Ca2+释放。L型钙通道是胞外Ca2+内流的主要通道。Ca2+信号通过参与环磷腺苷(cAMP)和磷脂酰二磷酸肌醇(PIP2)通路的级联反应,调节一些酶的活性〔4〕,即激活激素敏感性脂肪酶,进而促进TG水解生成FFA。异搏定可能会破坏细胞内的钙稳态,改变细胞对各种受体介导信号反应的能力〔5〕。有报道赤芍总苷能明显提高细胞内Ca2+浓度〔6〕。本实验选用L型钙通道阻断剂异搏定后,抑制了芍药苷促进离体脂肪组织释放FFA、降低MDA、升高T-AOC的作用,且芍药苷是赤芍总苷的主要化学成分,因此推测芍药苷的作用可能部分经L型钙通道起作用。
肥胖时血脂升高,脂质过氧化可使自由基产生增多及解偶联蛋白水平下降。MDA是脂质过氧化的终末反应产物之一。过多的脂质过氧化物可消耗细胞内谷胱甘肽和维生素E,导致机体酶促及非酶促防御体系的T-AOC减弱〔7〕。在本实验中,盐酸肾上腺素在促进脂肪组织释放FFA的同时,可降低MDA含量升高T-AOC。芍药苷亦具有此作用。说明芍药苷可清除脂肪组织过多的自由基,提高T-AOC。有研究发现肾上腺素是内源性的抗氧化剂,但同时又具有促氧化作用。芍药苷是否有促氧化作用,及促进FFA释放与其抗氧化能力之间是否存在因果关系尚需进一步探讨。
1 Wu YM,Xu HP,Wang CT,et al.Protective effects of paeoniflorin on cultured cortical neurons of mice〔J〕.Chin J Pharmacol Toxcol,2002;16(3):1722-51.
2 Emorine LJ,Feve B,Pairault J,et al.The human beta 3-adrenergic receptor relationship with atypical receptors〔J〕.Am J Clin Nutr,1992;55(2):215-8.
3 徐 冲,何金汗.脂滴包被蛋白(perilipin)调控脂肪分解〔J〕.生理科学进展,2006;37(3):221-4.
4 Dudek AZ,Kmak KL.Skin rash and bronchoalveolar histology correlates with clinical benefit in patients treated with gefitinib as a therapy for previously treated advanced or metastatic nonsmall cell lung cancer〔J〕.Lung Cancer Jan,2006;51(1):89-96.
5 Zernig G.Widening potential for Ca2+antagonists;Non-L-type Ca2+channel interaction〔J〕.Trends Pharmacol Sci,1990;11(1):38-44.
6 许惠玉,陈志伟.赤芍总苷诱导K562细胞凋亡及对线粒体膜电位和Ca2+的影响〔J〕.中国组织工程研究与临床康复,2008;12(16):3123-6.
7 Bezaire V,Seifert EL.Uncoupling protein-3:clues in an ongoing mitochondrial mystery〔J〕.Faseb J,2007;21(2):312-4.
