TIMP-3在肝癌组织中的表达及其与肿瘤侵袭转移的关系*
2011-08-02王亚峰周祥兵梁力建彭宝岗
周 奇,王亚峰,周祥兵,梁力建,彭宝岗
(中山大学第一附属医院肝胆外科,广东 广州 510080)
金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases,TIMPs)是一组具有特异性抑制基质金属蛋白酶(matrix metalloproteinases,MMPs)功能的活性因子。一些研究发现,TIMP-1及TIMP-2及其与基质金属蛋白酶MMP-2,MMP-9等的表达失衡在肝癌的侵袭、转移和复发过程中起重要作用[1-3]。但对TIMP-3在肝癌中的表达变化及其对肝癌的发生、转移等的影响还少有报道。本研究以临床收集的56例肝细胞癌患者,分别从肿瘤大小、肿瘤分化程度、肝外转移、门脉转移、淋巴转移等因素分析TIMP-3的表达水平差异;并以收集的原位癌组织、门脉癌栓组织、淋巴转移组织及正常肝组织标本为对象,分别利用RT-PCR法检测TIMP-3 mRNA和Western blotting法检测TIMP-3蛋白表达水平,结合临床病理资料分析其临床和病理意义,以期明确TIMP-3在肝细胞癌中的作用,并为临床诊断治疗提供依据。
资料和方法
1 研究对象
收集我院2009年10月-2010年10月间住院明确诊断的肝细胞癌患者56例;男44例,女12例,年龄30-73岁,平均年龄(49.5±10.5)岁;其中合并肝硬化者37例,Child分级:A级26例,B级30例;病理资料:肿瘤直径≤5 cm者25例,>5 cm者31例;按照Edmondson-Steiner标准,Ⅰ +Ⅱ级、Ⅲ+Ⅳ级分别有26例、30例;淋巴转移者21例;肝外转移者13例;门静脉癌栓者12例。对照组30例,为我院同期因肝内胆管结石或肝脏非肿瘤性病变住院行手术治疗的患者,其中男18例,女12例,年龄28-67岁,平均年龄(45.5±11.8)岁。
对其中手术的肝癌患者,术中获得标本包括原位肝癌组织30例、淋巴结转移灶30例、门脉癌栓组织30例。这30例中肝细胞癌组男24例,女6例,年龄32-71岁,平均年龄(49.11±13.14)岁;Child分级:A级13例,B级17例;肝细胞癌患者病理资料:肿瘤直径≤5 cm者12例,>5 cm者18例;按照Edmondson-Steiner标准,Ⅰ+Ⅱ级、Ⅲ+Ⅳ级分别有13例、17例。另取对照组中肝正常组织作为对照。
2 方法
2.1 取样方法 所有患者术前晨间空腹采静脉血2 mL,放入0.109 mol/L枸橼酸钠抗凝剂0.1 mL的试管中,充分混匀,1500 r/min离心10 min,血浆贮存于-70℃分批检测。手术组患者在术后标本离体时间少于15 min,无菌条件下切取1 cm×1 cm×1 cm大小组织,迅速放进液氮中,24 h后转入-70℃冰箱中保存。
2.2 ELISA 试剂为ADI酶标试剂盒,操作步骤严格按试剂盒说明书进行,每个样本均设双复孔。
2.3 RT -PCR DNA 分子量 marker:λDNA/EcoRⅠ+HindⅢ markers,λ DNA/HindⅢ markers均系上海索莱宝生物科技有限公司产品。Taq DNA聚合酶购自Promega。RNA提取试剂盒:Total RNA Extraction System购自Gibco-BRL。逆转录按Invitrogene试剂盒说明操作。TIMP-3 mRNA扩增特异引物序列为5’-GGA ATT CAT GAC CCC TTG GCT CGG G-3’和5’-GGA ATT CAG GGT CTG GCG CTC AGG G-3’[9],扩增产物长度为 648 bp,内参照为 GAPDH 序列。反应体积含1×PCR buffer,1.5 mmol/L MgCl2,0.2 mmol/L dNTPs,0.15 μmol/L TIMP - 3 primers,0.1 μmol/L GAPDH primers,1U Taq DNA 聚合酶,DNA模板2 μL。PCR循环参数为:95℃预变性5 min;95℃ 1 min,61 ℃ 50 s,72 ℃ 1 min,32 个循环后,72℃延伸5min。扩增产物行1.0%琼脂糖凝胶电泳,UVP凝胶成像系统观察并分析。用Image Tool图像分析软件分别测量TIMP-3和GAPDH的平均积分吸光度,用 TIMP-3/GAPDH的比值来表示TIMP-3 mRNA的表达量。
2.4 Western blotting 手术样本立即置于-80℃冻存。实验时每份样本取组织25 mg,用预冷的PBS漂洗2次,加入100 μL预冷的细胞裂解液,充分研磨,0℃放置30 min,4℃、12000 r/min离心15 min,取上清备用。将样品(50 μg)加入2×SDS凝胶加样缓冲液,100℃变性3-5 min,顺序加样,行 SDSPAGE电泳(12%分离胶,5%积层胶)。电泳结束后,经半干转膜仪(Bio-Rad)转膜1 h,转膜时电流限定5.5 mA/cm2膜。5%脱脂奶粉室温孵育膜1 h后,加入工作浓度为1∶1000的TIMP-3单克隆抗体(Oncogene),4℃孵育过夜。加Ⅱ抗(NEB),室温孵育膜1 h。化学发光、显影、定影。用Image Tool图像分析软件测量平均积分吸光度。
3 统计学处理
数据用SPSS 16.0软件处理,计量资料用均数±标准差()表示,采用方差分析和t检验,计数资料采用χ2检验。
结 果
1 血浆TIMP-3水平变化
1.1 肝细胞癌患者血浆TIMP-3显著低于对照组(77.48±9.54 vs 114.58±8.60),P <0.05。
1.2 肝细胞癌患者血浆TIMP-3在低分化肿瘤组及肝外转移组显著低于高分化肿瘤组及无肝外转移组(P<0.05),在肿瘤数目、肿瘤大小、包膜侵袭、淋巴转移及门脉转移组中无显著差异(P>0.05),见表1。
表1 肝细胞癌患者血浆TIMP-3水平与临床病理的关系Table1.The relationship between plasma TIMP-3 level and clinicopathological features()
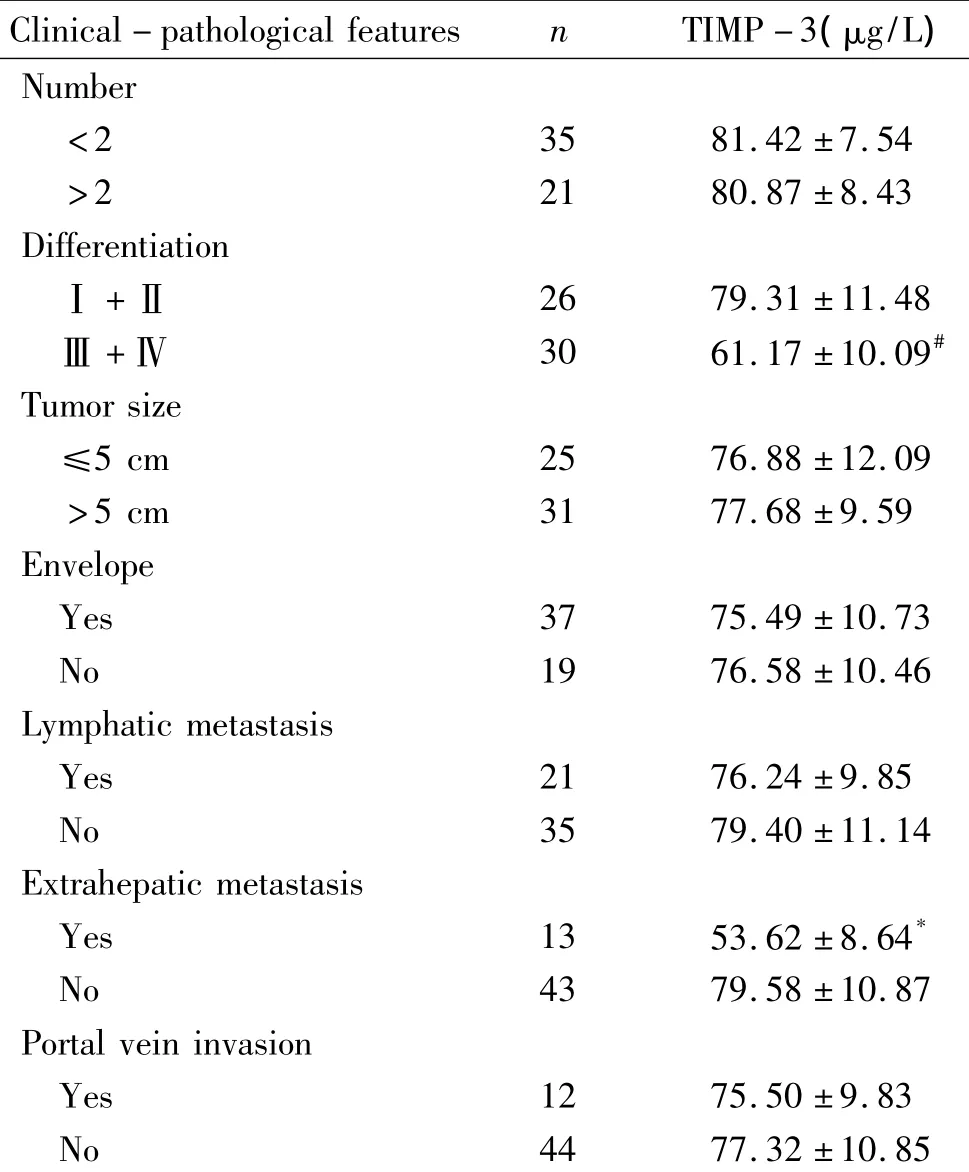
表1 肝细胞癌患者血浆TIMP-3水平与临床病理的关系Table1.The relationship between plasma TIMP-3 level and clinicopathological features()
*P<0.05 vs no extrahepatic metastasis;#P<0.05 vs low differentiation(Ⅰ+Ⅱ).
Clinical-pathological features n TIMP-3(μg/L)Number<2 35 81.42 ±7.54>2 21 80.87 ±8.43 DifferentiationⅠ +Ⅱ 26 79.31±11.48Ⅲ +Ⅳ 30 61.17±10.09#Tumor size≤5 cm 25 76.88 ±12.09>5 cm 31 77.68 ±9.59 Envelope Yes 37 75.49 ±10.73 No 19 76.58 ±10.46 Lymphatic metastasis Yes 21 76.24 ±9.85 No 35 79.40 ±11.14 Extrahepatic metastasis Yes 13 53.62 ±8.64*No 43 79.58 ±10.87 Portal vein invasion Yes 12 75.50 ±9.83 No 44 77.32 ±10.85
2 TIMP-3 mRNA表达变化
2.1 组织提取总RNA样品的鉴定 从实验样本组织中提取的总RNA经电泳,可见明显的28S、18S和5S条带,且28S的亮度大约是18S的2倍,说明所提取的总RNA基本没有降解,有较好的完整性。对RNA样品进行紫外分光光度分析,A260/A280=1.9,表明RNA具有较高的纯度,符合反转录要求。
2.2 肝细胞癌患者与对照组组织中TIMP-3 mRNA表达 TIMP-3和GAPDH RT-PCR电泳结果见图1,可见648 bp处出现一条带,癌组织、门脉癌栓组织、淋巴转移组织及正常肝组织均有表达,其中正常组织表达最为明显。
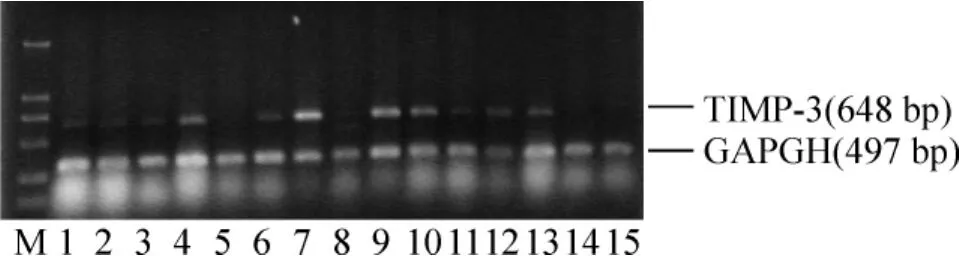
Figure1.Results of TIMP-3 RT-PCR product electrophoresis.M:DNA marker;Lane 1,6,10,14:hepatocellular carcinoma(HCC)in situ;Lane 3,8,12,15:portal vein tumor emboli;Lane 4,7,9,13:normal liver tissues;Lane 2,5,11:lymphatic metastasis.图1 TIMP-3 RT-PCR电泳结果
2.3 肝细胞癌患者与对照组组织中TIMP-3 mRNA阳性率比较 原位癌组织、门脉癌栓组织、淋巴转移组织和对照组中 TIMP-3 mRNA阳性率分别为60.00%(18/30)%、36.67%(11/30)、33.33%(10/30)和83.33%(25/30)。对照组正常肝组织中TIMP-3 mRNA阳性率显著高于原位癌组织(P<0.05)、门脉癌栓组织(P<0.01)和淋巴转移组织(P<0.01);原位癌组织中TIMP-3 mRNA阳性率显著高于门脉癌栓组织(P<0.05)和淋巴转移组织(P<0.05);TIMP-3 mRNA阳性率在门脉癌栓组织和淋巴转移组织间比较无显著差异(P>0.05)。
2.4 肝细胞癌患者与对照组组织中TIMP-3 mRNA相对表达强度定量分析 正常肝组织、原位肝癌组织、门脉癌栓组织和淋巴转移组织中TIMP-3 mRNA相对表达量分别为0.78±0.09、0.52±0.09、0.42±0.07和0.40±0.08。对照组正常肝组织中TIMP-3 mRNA相对表达强度显著高于原位肝癌组织(P<0.01)、门脉癌栓组织(P<0.01)及淋巴转移组织(P<0.01);原位癌组织中TIMP-3 mRNA相对表达强度显著高于门脉癌栓组织(P<0.01)和淋巴转移组织(P<0.01);而淋巴组织和门脉癌栓组织相比无显著差异(P>0.05)。
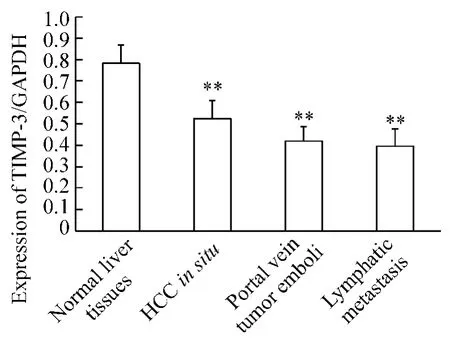
Figure2.Expression levels of TIMP-3 mRNA..n=30.**P <0.01 vs normal liver tissues.图2 TIMP-3 mRNA相对表达水平变化
2.5 肝细胞癌患者TIMP-3 mRNA相对表达强度与临床病理特征的关系 肝细胞癌患者TIMP-3 mRNA表达强度在低分化肿瘤组及侵袭转移组中显著低于高分化肿瘤组及无侵袭转移组(P<0.05)。其表达强度在性别、AFP、HBsAg、是否合并肝硬化、肿瘤大小和癌灶数目均无显著差异(P>0.05),见表2。
表2 肝细胞癌组织中TIMP-3 mRNA和蛋白相对表达强度与临床病理特征的关系Table2.The expression of mRNA and protein of TIMP-3 and clinicopathological features(.n=30)
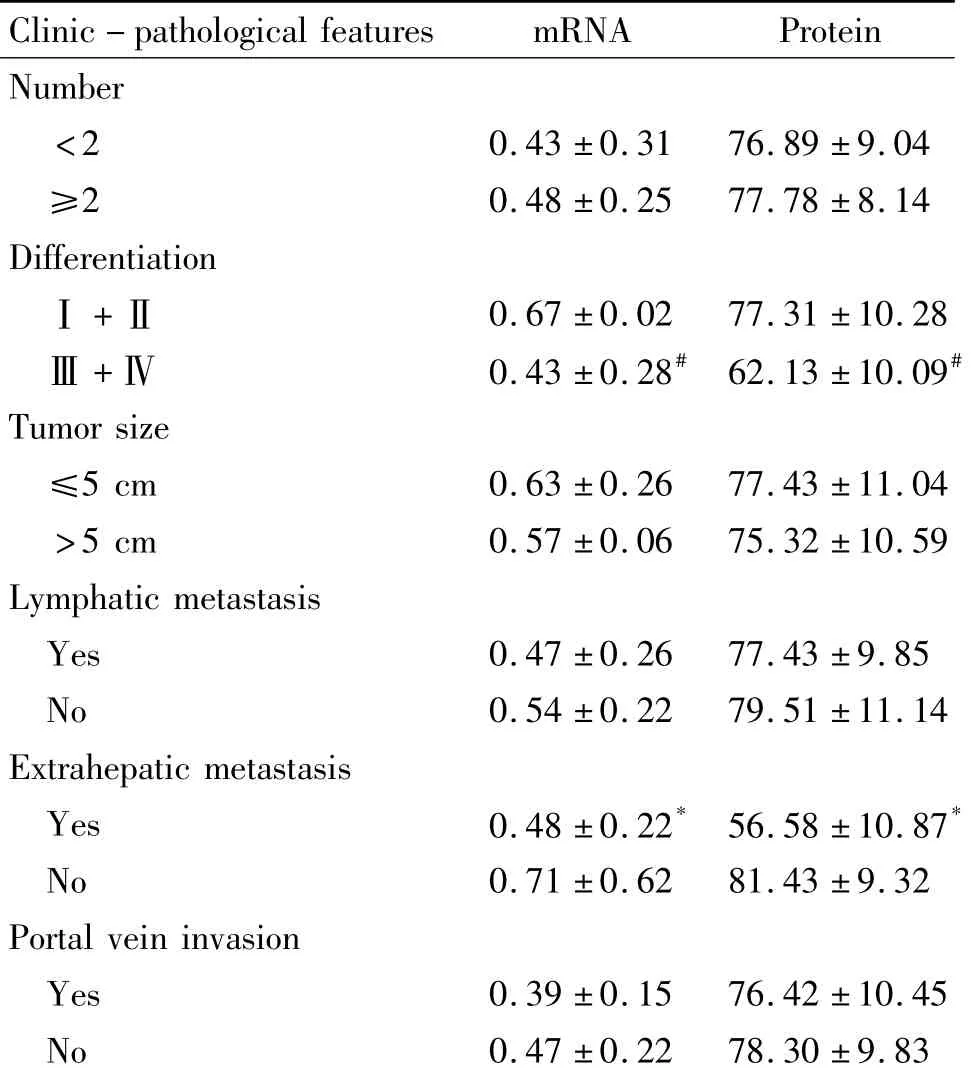
表2 肝细胞癌组织中TIMP-3 mRNA和蛋白相对表达强度与临床病理特征的关系Table2.The expression of mRNA and protein of TIMP-3 and clinicopathological features(.n=30)
*P<0.05 vs no extrahepatic metastasis;#P<0.05 vs low differentiation(Ⅰ+Ⅱ).
Clinic-pathological features mRNA Protein Number<2 0.43 ±0.31 76.89 ±9.04≥2 0.48 ±0.25 77.78 ±8.14 DifferentiationⅠ +Ⅱ 0.67 ±0.02 77.31 ±10.28Ⅲ +Ⅳ 0.43 ±0.28# 62.13 ±10.09#Tumor size≤5 cm 0.63 ±0.26 77.43 ±11.04>5 cm 0.57 ±0.06 75.32 ±10.59 Lymphatic metastasis Yes 0.47 ±0.26 77.43 ±9.85 No 0.54 ±0.22 79.51 ±11.14 Extrahepatic metastasis Yes 0.48 ±0.22* 56.58 ±10.87*No 0.71 ±0.62 81.43 ±9.32 Portal vein invasion Yes 0.39 ±0.15 76.42 ±10.45 No 0.47 ±0.22 78.30 ±9.83
3 TIMP-3蛋白表达变化
3.1 肝细胞癌患者与对照组组织中TIMP-3蛋白检测结果,可见24 kD处出现一条带,原位癌组织、门脉癌栓组织、淋巴转移组织及正常肝组织均有表达,见图3。
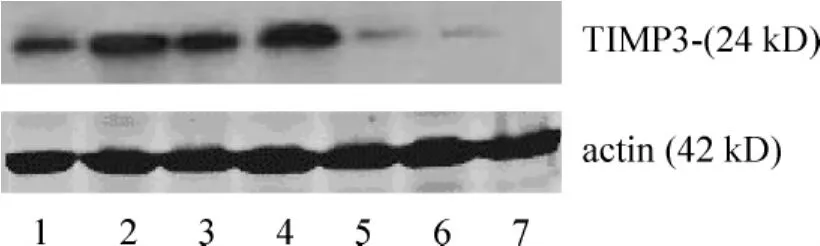
Figure3.Results of TIMP-3 protein expression examined by Western blotting.Lane 1,3:HCC in situ;Lane 5,6:portal vein tumor emboli;Lane 2,4:normal liver tissues;Lane 7:lymphatic metastasis.图3 Western blotting检测 TIMP-3蛋白表达
3.2 肝细胞癌患者与对照组组织中TIMP-3蛋白阳性率比较 原位肝癌组织、门脉癌栓组织、淋巴转移组织及正常对照组分别为63.33%(19/30)、40.00%(12/30)、36.67%(11/30)、86.67%(26/30)。对照组正常肝组织中TIMP-3蛋白阳性率显著高于原位肝癌组织(χ2=4.36,P<0.05)、门脉癌栓组织(χ2=14.07,P<0.01)和淋巴转移组织(χ2=15.86,P<0.01);原位肝癌组织显著高于门脉癌栓组织(χ2=4.27,P<0.05)及淋巴转移组织(χ2=4.16,P<0.05);而门脉癌栓组织中TIMP-3蛋白与淋巴转移组织比较无显著差异(χ2=1.566,P>0.05)。
3.3 肝细胞癌患者与对照组组织中TIMP-3蛋白相对表达强度定量分析 正常肝组织、原位肝细胞癌组织、门脉癌栓组织和淋巴转移组织TIMP-3蛋白的平均积分吸光度分别为115.08±8.60、77.04±8.83、64.43±3.80和62.80±3.73。对照正常肝组织中TIMP-3蛋白相对表达强度显著高于原位肝癌组织(P<0.01)、门脉癌栓组织(P<0.01)及淋巴转移组织(P<0.01);原位癌组织中TIMP-3蛋白相对表达强度显著高于门脉癌栓组织(P<0.01)和淋巴转移组织(P<0.01);而淋巴组织和门脉癌栓组织相比无显著差异(P>0.05)。见图4。
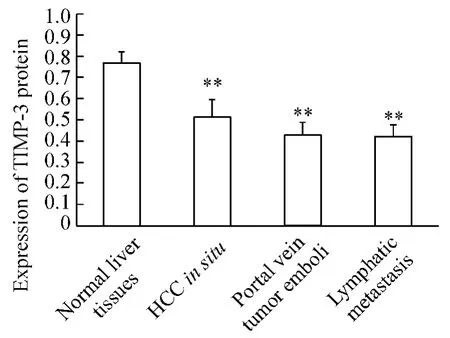
Figure4.Expression levels of TIMP-3 protein..n=30.**P <0.01 vs normal liver tissues.图4 TIMP-3蛋白相对表达水平变化
3.4 TIMP-3蛋白相对表达强度与临床病理特征的关系 肝细胞癌患者TIMP-3蛋白表达强度在低分化肿瘤组及侵袭转移组明显低于高分化肿瘤组及无侵袭转移组(P<0.05),其表达强度与性别、AFP、HBsAg、是否合并肝硬化、肿瘤大小和癌灶数目均无关(P>0.05),见表2。
讨 论
基质金属蛋白(水解)酶(MMP)是一组由11种酶组成的内蛋白酶家族,它可以清除胶原分子、明胶分子等一些生物大分子,可以降解胶原蛋白以及蛋白多糖,为新细胞的生长提供空间[4]。
金属蛋白酶组织抑制因子3(TIMP-3)是TIMP家族中特殊的一员,它属于非可溶性蛋白,只存在于细胞外基质中的。研究表明,TIMP-3除了发挥抑制MMPs功能的作用外,还可刺激细胞增殖及诱导细胞凋亡,抑制肿瘤的生长、侵袭和转移的作用[5-8]。本研究发现,与正常肝组织相比,肝细胞癌患者原位癌组织的TIMP-3表达水平下降,在门脉及淋巴等处的转移瘤组织中,TIMP-3的表达水平更低甚至缺如。这提示TIMP-3的表达下调与肝癌的转移高度相关。
在多种肿瘤细胞的研究中均发现存在着TIMP-3 表达的下调或丢失[9-12],而恢复其表达可以降低肿瘤细胞的侵袭、转移能力。如Ahonen等[12]通过腺病毒介导将TIMP-3基因转染至黑色素瘤细胞系SK-Mel-5和A2058,结果发现,转染阳性细胞对基底膜的侵袭能力明显降低,同时对Ⅰ、Ⅳ型胶原和纤连蛋白的粘附性下降。有关研究发现,TIMP-3高表达可以显著抑制宫颈癌细胞、头颈部鳞癌细胞以及肝癌细胞在体外对基底膜的侵袭,阻止肿瘤进行性发展[13-15]。Castagnino 等[16]的实验表明,上调TIMP-3可改善体外培养的平滑肌肉瘤细胞的分化程度,使肿瘤细胞的恶性表型减少,同时其生长速度及对基质的侵袭性均降低;而下调TIMP-3则会使该肿瘤细胞的增殖能力和对基质的侵袭性增强。这些资料均表明,TIMP-3可能是一种肿瘤抑制因子。但上述研究多为体外实验结果,本研究结果表明肝细胞癌患者血浆TIMP-3表达显著低于对照组,RT-PCR和Western blotting检测证实肝细胞癌患者的门脉癌栓组织和淋巴转移组织中TIMP-3 mRNA和蛋白阳性率及相对表达水平均明显低于原位癌组织和正常对照组,从血浆蛋白及组织基因水平两个方面说明TIMP-3的低表达可能促进了肝癌的侵袭和转移。
肿瘤细胞中TIMP-3表达水平降低的分子机制目前尚无明确的结论。有报道认为TIMP-3启动子的甲基化是其表达下降的原因。DNA甲基化是肿瘤组织常见的一种DNA修饰现象,与肿瘤组织的分化程度密切相关。本研究通过比较不同病理分化级别的肝癌组织中TIMP-3的表达水平,发现TIMP-3表达水平在分化程度比较低的肿瘤组织中明显降低,也支持上述观点。
[1]Wang ZD,Huang C,Li ZF,et al.Chrysanthemum indicum ethanolic extract inhibits invasion of hepatocellular carcinoma via regulation of MMP/TIMP balance as therapeutic target[J].Oncol Rep,2010,23(2):413 -421.
[2]EI Tayebi HM,Salah W,EI Sayed IH,et al.Expression of insulin- like growth factor-,matrix metalloproteinases,and their tissue inhibitors as predictive markers in theperipheral blood of HCC patients[J].Biomarkers,2011,16(4):346-354.
[3]叶 柯,王志明,张鸽文.MMP-2、TIMP-1在肝细胞癌中的表达及临床意义[J].细胞与分子免疫学杂志,2010,26(5):490 -491.
[4]何耀红,王 辰,庞宝森,等.基质金属蛋白酶及其抑制物在高碳酸血症大鼠肺组织中的表达[J].中国病理生理杂志,2010,26(1):116 -121.
[5]Brew K,Nagase H.The tissue inhibitors of metalloproteinases(TIMPs):an ancient family with structural and functional diversity[J].Biochim Biophys Acta,2010,1803(1):55-71.
[6]Kallio JP,Hopkins - Donaldson S,Baker AH,et al.TIMP-3 promotes apoptosis in nonadherent small cell lung carcinoma cells lacking functional death receptor pathway[J].Int J Cancer,2011,128(4):991 -996.
[7]Anania MC,Sensi M,Radaelli E,et al.TIMP -3 regulates migration,invasion and in vivo tumorigenicity of thyroid tumor cells[J].Oncogene,2011,30(27):3011 -3023.
[8]Chetty C,Lakka SS,Bhoopathi P,et al.Tissue inhibitor of metalloproteinase 3 suppresses tumor angiogenesis in matrix metalloproteinase 2 down - regulated lung cancer[J].Cancer Res,2008,68(12):4736 -4745.
[9]Gu P,Xing X,Tanzer M,et al.Frequent loss of TIMP - 3 expression in progression of esophageal and gastric adenocarcinomas[J].Neoplasia,2008,10(6):563 -572.
[10]Masson D,Rioux - Leclercq N,Fergelot P,et al.Loss of expression of TIMP-3 in clear cell renal cell carcinoma[J].Eur J Cancer,2010,46(8):1430 -1437.
[11]Ripley D,Tunuguntla R,Susi L,et al.Expression of matrix metalloprotein-26 and tissue inhibitors of metalloproteinase-3 and -4 in normal ovary and ovarian carcinoma[J].Int J Gynecol Cancer,2006,16(5):1794 -1800.
[12]Ahonen M,Poukkula M,Baker AH,et al.Tissue inhibitor of metalloproteinase-3 induces apoptosis in melanoma cells by stabilization of death receptors[J].Oncogene,2003,22(14):2121 -2134.
[13]Zhang Y,Qian H,Lin C,et al.Adenovirus carrying TIMP- 3:a potential tool for cervical cancer treatment[J].Gynecol Oncol,2008,108(1):234 -240.
[14]Kornfeld JW,Meder S,Wohlberg M,et al.Overexpression of TACE and TIMP-3 mRNA in head and neck cancer:association with tumor development and progression[J].Br J Cancer,2011,104(1):138 - 145.
[15]Okamoto Y,Nakano H.Dibutyryl cyclic AMP-induced enhancement of tissue inhibitor of metalloproteinase-3 expression and its possible relation to the invasive activity of the human hepatoma cell line PLC/PRF/5[J].Anticancer Res,1999,19(6B):5175 -5180.
[16]Castagnino P,Soriano JV,Montesano R,et al.Induction of tissue inhibitor of metalloproteinases-3 is a delayed early cellular response to hepatocyte growth factor[J].Oncogene,1998,17(4):481 -492
