黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元钙调蛋白表达的影响*
2011-08-02闫凤霞高维娟叶冬青任立群张雅丽侯志平
闫凤霞,钱 涛,高维娟,叶冬青,任立群,张雅丽,侯志平
(1承德医学院病理生理学教研室,河北 承德 067000;2河北省人民医院,河北 石家庄 050051;3河北化工医药职业技术学院,河北 石家庄 050026)
黄芪是中医药治疗缺血性脑血管病的常用药物,具有清除自由基、减轻脑水肿、对抗炎症介质、缓解钙离子超载、改善神经元能量代谢、降低兴奋性氨基酸毒性等作用[1]。本课题组前期实验证实,黄芪注射液可减轻全脑缺血再灌注损伤引起的大鼠海马神经元凋亡,并可抑制离体培养大鼠海马神经元因缺氧缺糖/复氧复糖所致的凋亡[2],但黄芪注射液抑制神经元凋亡的机制尚不清楚。目前已知,钙超载是引起细胞凋亡的重要因素之一,本研究通过对原代培养的大鼠海马神经元施加缺氧缺糖/复氧复糖因素,模拟脑缺血再灌注损伤过程,观察黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元钙调蛋白(calmodulin,CaM)表达的影响,探讨黄芪注射液抑制缺氧缺糖/复氧复糖大鼠海马神经元凋亡的分子机制。
材料和方法
1 材料
1.1 动物 SD大鼠,新生24 h之内,雌雄兼有,清洁级动物,由河北省实验动物中心提供,合格证号冀医动字第702003号。
1.2 试剂和仪器 兔抗caspase-3多克隆抗体(非激活)购于北京中杉金桥公司。Caspase-3蛋白免疫组化SP试剂盒和Western blotting试剂盒购于北京中杉金桥公司。BCA蛋白定量试剂盒购于上海申能博彩生物公司。CaM RT-PCR引物由上海生物工程有限公司设计,RT-PCR试剂盒购自大连宝生物公司。DNaseⅠ、多聚赖氨酸和阿糖胞苷购自Sigma。胎牛血清和马血清由HyClone生产。谷氨酰胺和胰蛋白酶购自华美生物工程公司。DMEM/F12培养基和B27由Gibco生产。黄芪注射液由成都地奥九泓制药厂生产。其它试剂为国产分析纯。主要仪器:HERAcell 150型CO2培养箱由Heraeus生产;Leica DMIL 090-135.001型倒置显微镜由Wetzlar GmbH生产;TDL-40B离心机购自上海安亭科学仪器制造厂。DYY-6B型稳压稳流电泳仪购自北京六一仪器厂。
2 方法
2.1 海马神经细胞的分离及培养 参照Brewer等[3]的方法并做少许改良,取新生24 h内的SD大鼠海马组织,6.25 mmol/L胰蛋白酶消化,马血清终止消化后将组织块混合液移入离心管,加D-Hanks液1000 r/min离心5 min,去上清后加DMEM/F12溶液7 mL,吹打离散组织,制成细胞悬液,以200目滤网过滤。取细胞悬液在100倍倒置显微镜下计数,以 5×108/L密度接种在含有种植培养液(DMEM/F12培养基添加0.012 mol/L胎牛血清、0.014 mol/L马血清、0.1 g/L谷氨酰胺、0.1 U/L青霉素和0.1 g/L链霉素)的培养皿或培养瓶中。2 d后用无血清培养液(DMEM/F12添加2%B27)代替种植液。培养第4 d换液时添加0.005 g/L阿糖胞苷以抑制胶质细胞生长,24 h后替换成新鲜无血清培养液。
2.2 缺氧缺糖/复氧复糖模型的建立与实验分组参照Bossenmeyer等[4]的方法建立缺氧缺糖/复氧复糖细胞模型:取原代培养8 d的大鼠海马神经细胞,用无糖Earle's液冲洗2遍,然后加入与正常对照组培养液等体积的无糖Earle's液,随即把培养皿(瓶)置于37℃温箱中的缺氧装置里,快速通入高纯氮气1 min以排尽缺氧装置中的空气,再使排气水瓶中的气体匀速缓慢连续排出。缺氧缺糖30 min后,换正常无血清培养液继续在37℃、5%CO2培养箱内培养。大鼠海马神经细胞随机分为4组:正常对照组、缺氧缺糖/复氧复糖组、黄芪注射液溶剂对照组和黄芪注射液组。缺氧缺糖/复氧复糖组模型制备方法同上;正常对照组正常培养,不进行任何处理;黄芪注射液组于缺氧缺糖同时加入黄芪注射液,终浓度为0.5 g生药/L,直至细胞培养结束;黄芪注射液溶剂对照组处理方法与黄芪注射液组相同,只是将黄芪注射液换为pH值7.4的等量黄芪注射液溶剂即无菌去离子水。各组在复氧复糖后0 h、0.5 h、2 h、6 h、24 h、48 h、72 h 和 120 h 检测海马神经细胞caspase-3和CaM的表达。
2.3 免疫组织化学染色法检测caspase-3的表达细胞用99.5%丙酮4℃固定10 min,PBS洗3遍,3%H2O2阻断内源性过氧化物酶10 min,再用PBS洗3遍后放在湿盒中,用山羊血清封闭60 min,兔抗磷酸化caspase-3多克隆抗体(1∶100稀释)4℃过夜,PBS洗3遍,生物素标记的Ⅱ抗和辣根过氧化物酶依次在37℃下作用20 min,PBS洗后用DAB显色,镜下观察核中出现黄色颗粒及胞浆黄染后及时终止,苏木素复染7 min后用氨水反蓝5 min,梯度乙醇脱水、二甲苯透明2次(各10 min)、中性树胶封固。PBS代替Ⅰ抗作阴性对照。阳性细胞胞浆和突起呈棕黄色,胞核有黄色颗粒。阳性细胞计数方法:高倍镜下计数5个非连续视野阳性细胞数之和,每组重复6次。并用图像分析软件Quantity One对各组细胞图片进行分析,计算其A值。
2.4 蛋白免疫印迹法检测细胞内CaM的表达 收集细胞,用细胞裂解液(RIPA∶PMSF=100∶1)裂解、振荡,12000 r/min 4℃离心20 min,提取胞浆蛋白,用BCA法进行蛋白定量。取100 μg样品,加入蛋白体积1/4的loading buffer上样缓冲液混匀,在100℃沸水中煮7 min,同时65℃水中孵育蛋白分子量标记(marker),以12%SDS聚丙烯酰胺凝胶电泳分离,分离的蛋白用半干电转移法转移到事先用甲醇激活的PVDF膜上,用配好的5%脱脂奶粉封闭液封闭,4℃过夜后加入用封闭液稀释的兔抗磷酸化CaM多克隆抗体(1∶100稀释)室温摇床放置2 h。洗膜液洗3次,首次15min,后2次各10 min,用生物素标记的Ⅱ抗(1∶14000稀释)孵育1 h,洗膜液洗后用DAB法显色。以β-actin为内参照。实验重复6次,目的条带为16.7 kD。用Quantity One软件对各时点蛋白条带灰度值进行分析。
2.5 RT-PCR检测细胞CaM mRNA的表达 收集细胞,用Trizol一步法提取RNA,按ExscriptTMRT reagent kit说明逆转录为cDNA。CaM cDNA上游引物5'-TGCGGCGTTACACGA CCTT -3',下游引物5'-CAAAGCCAGTGGCACT CATTCTC - 3',扩增片段长度为200 bp;内参照 β-actin的上游引物5'-GGACTTCGAGCAAGAGATGG-3',下游引物 5'-ACATCTGCTGGAAGGTGGAC-3',扩增片段长度为509 bp[5]。按照 PCR Amplification kit说明进行反应,扩增条件:95℃预变性3 min;94℃ 40 s,54℃40 s,72℃ 40 s,循环30次,最后72℃ 3 min。用质量分数为115%的琼脂糖凝胶电泳鉴定PCR产物,以β-actin为内参照,实验重复6次。用凝胶分析软件Quantity One进行半定量分析,目的条带在115 bp处。
3 统计学处理
结 果
1 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马caspase-3阳性神经元形态学的影响
免疫组织化学结果显示:正常对照组大鼠海马神经元核规整,细胞突起明显,有少许细胞胞浆黄染。缺氧缺糖/复氧复糖组大鼠海马神经元核皱缩、突起回缩,大量细胞胞浆黄染,胞核内有黄色颗粒,阴性对照组未见胞浆和突起黄染的阳性神经元;与正常对照组相比,除0 h和0.5 h之外,缺氧缺糖/复氧复糖组各时点海马caspase-3阳性神经元数目、占神经元总数的百分率及平均吸光度值均明显增多(P<0.05),于24 h达到高峰。黄芪注射液溶剂对照组海马神经元亦可见到明显的核皱缩、突起回缩和胞浆黄染,海马caspase-3阳性神经元数目、占神经元总数的百分率及平均吸光度值的变化趋势均与缺氧缺糖/复氧复糖组相一致(P>0.05)。黄芪注射液组大鼠海马神经元有轻微核皱缩,可见部分神经元胞浆黄染,除0 h和0.5 h之外,各时点阳性神经元数目,占神经元总数的百分率及平均吸光度值均比缺氧缺糖/复氧复糖组显著减少(P<0.05)。随着复氧复糖时间的延长,缺氧缺糖/复氧复糖组、黄芪注射液溶剂对照组及黄芪注射液组均可见到阳性神经元胞核中黄色颗粒逐渐增多,于24 h达到高峰,见图1-4。

Figure1.Caspase-3 expression in hippocampal neurons of rats defected by SP immunohistochemical staining method(×400).A:normal group;B:hypoxia/hypoglycemia and reoxygenation group;C:Astragalus injection solution group;D:Astragalus injection group.图1 免疫组化SP染色法检测海马神经元caspase-3的表达
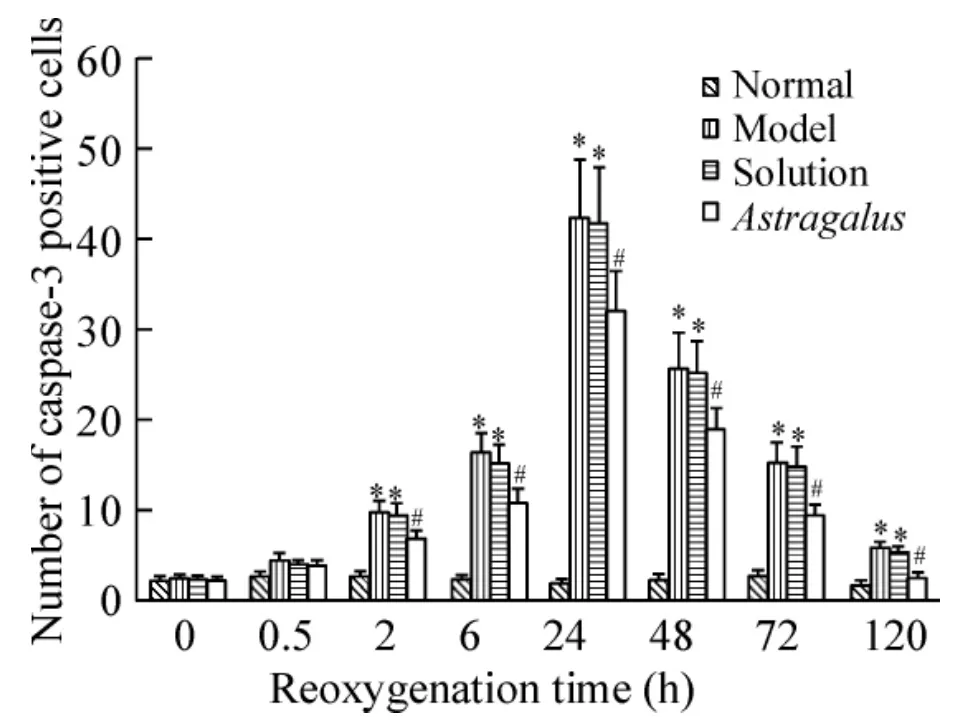
Figure2.The effect of Astragalus injection on the numbers of caspase-3 positive neurons after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats..n=6.*P<0.05 vs normal;#P<0.05 vs model and solution.图2 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马caspase-3阳性神经元数目的影响
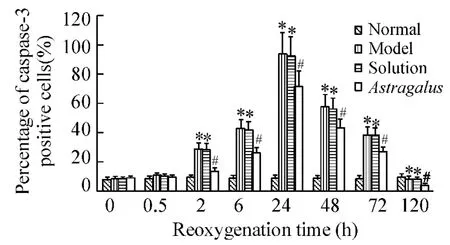
Figure3.The effect of Astragalus injection on the percentage of caspase-3 positive neurons after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats..n=6.*P<0.05 vs normal;#P<0.05 vs model and solution.图3 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马caspase-3阳性神经元百分率的影响
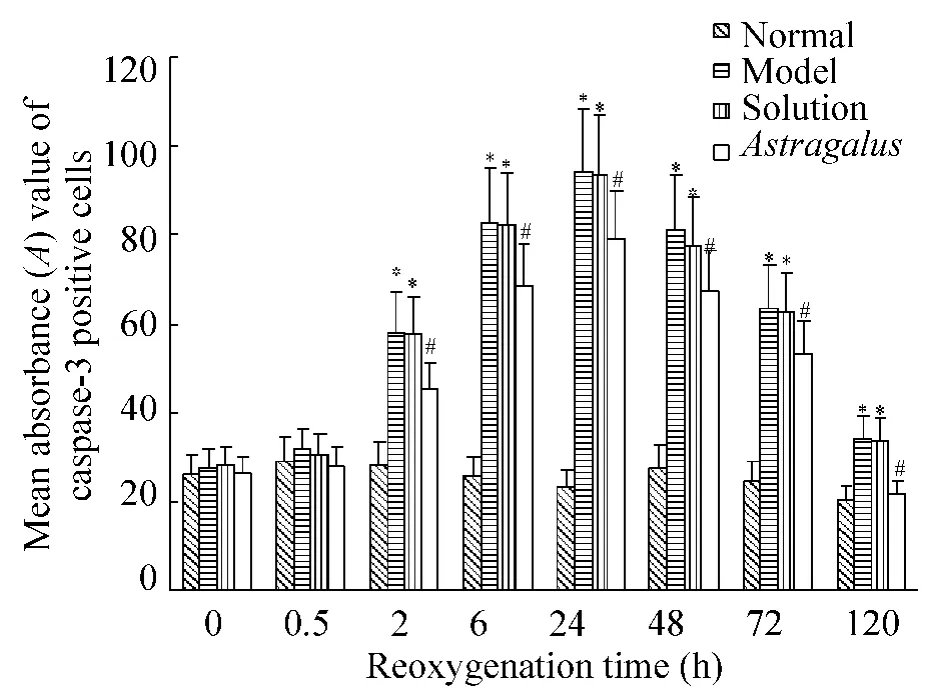
Figure4.The effect of Astragalus injection on mean absorbance(A)value of caspase-3 positive neurons after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats..n=6.*P<0.05 vs normal;#P<0.05 vs model and solution.图4 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马caspase-3阳性神经元平均吸光度值的影响
2 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元CaM蛋白表达的影响
Western blotting结果显示,各时点缺氧缺糖/复氧复糖组海马神经元CaM蛋白的平均吸光度值均较正常对照组明显升高(P<0.05);与缺氧缺糖/复氧复糖组相比,黄芪注射液溶剂对照组各时点CaM蛋白的平均吸光度值无明显变化(P>0.05),而黄芪注射液组在各个时点CaM蛋白的平均吸光度值明显降低(P <0.05),见图5。
3 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元CaM mRNA表达的影响
RT-PCR结果显示,各时点缺氧缺糖/复氧复糖组海马神经元CaM mRNA的平均吸光度值均较正常对照组明显升高(P<0.05);与缺氧缺糖/复氧复糖组相比,黄芪注射液溶剂对照组各时点CaM mRNA的平均吸光度值无明显变化(P>0.05),而黄芪注射液组在各个时点CaM mRNA的平均吸光度值明显降低(P<0.05),见图6。
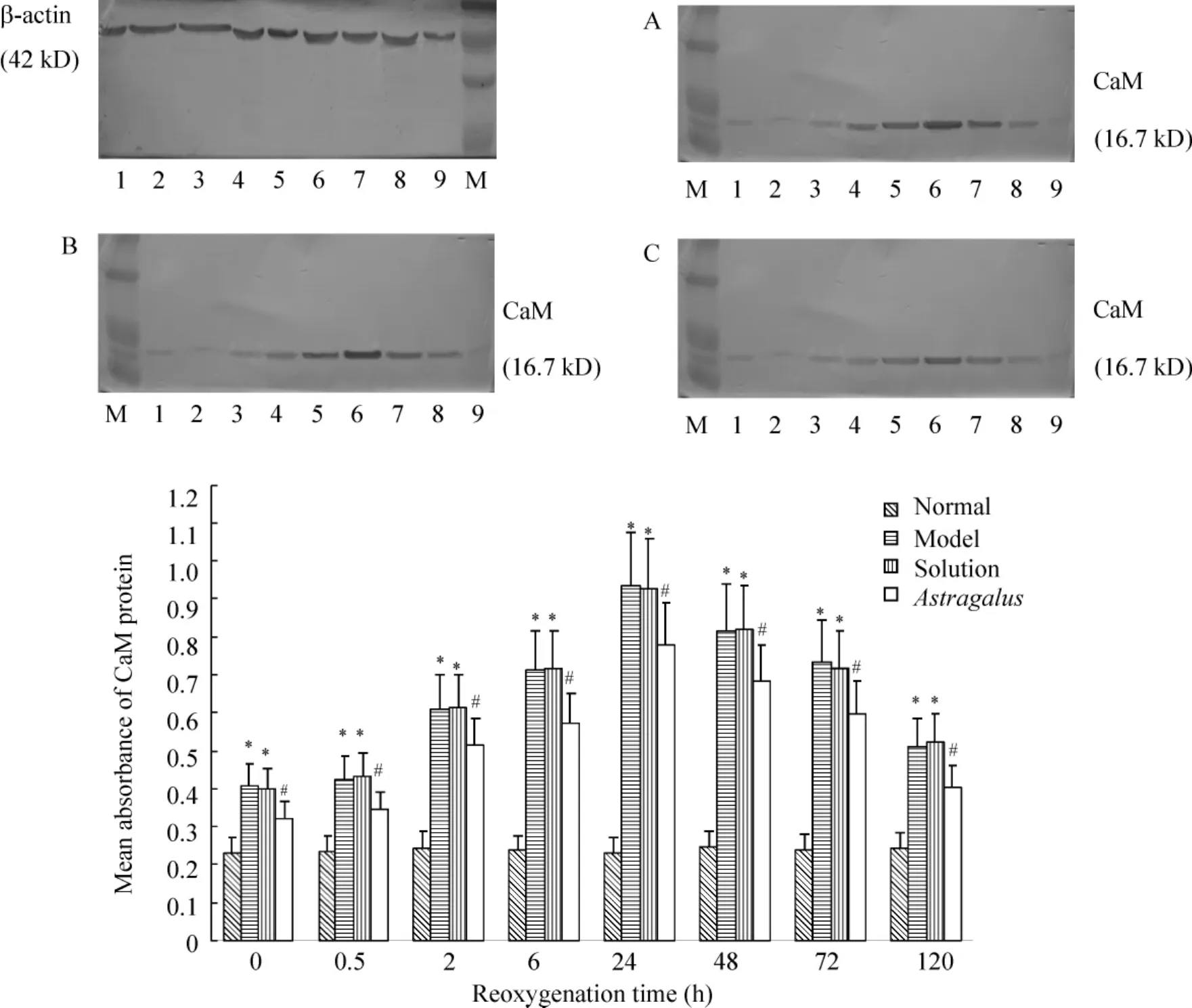
Figure5.The effect of Astragalus injection on expression of CaM protein after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats.A:model group;B:solution group;C:Astragalus group.M:marker control;1:normal control;2:0 h;3:0.5 h;4:2 h;5:6 h;6:24 h;7:48 h;8:72 h;9:120 h..n=6.*P<0.05 vs normal;#P<0.05 vs model and solution.图5 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元CaM表达的影响
讨 论
脑缺血再灌注损伤是一个复杂的病理生理过程,其导致神经元凋亡的机制涉及多个环节,钙离子超载、自由基、能量代谢障碍等都参与了脑缺血再灌注损伤过程。这些因素之间相互构成网络式联系调控着神经元凋亡的进程。
Ca2+是细胞内重要的第2信使,Ca2+通过与特异性的Ca2+结合蛋白相互作用而发挥其功能。目前已发现与Ca2+结合的蛋白大概有100多种,而CaM是其中最重要的一种[6]。Ca2+与CaM 结合后会激活CaM,活化的CaM再激活其下游多个信号途径,如蛋白激酶C、促分裂原活化蛋白激酶、磷酸化酶激酶、腺苷酸环化酶等,缺氧缺糖/复氧复糖后神经元内由于能量代谢障碍引起胞膜及内置网膜Ca2+通道开放,进而发生Ca2+超载会导致Ca2+/CaM依赖性激酶的持续性的激活,如Ca2+/CaMKⅡ、一氧化氮合酶、神经钙蛋白等,而Ca2+/CaMKⅡ调节神经细胞的死亡过程[7]。有报道称,神经钙调蛋白的抑制剂也能够减弱缺血后再灌注诱导的细胞毒性损伤[8]。JNK3作为MAPK的成员可被其上游 Ca2+/CaM依赖性激酶的激活,进而启动下游caspase级联反应,发挥其承上启下作用;同时JNK3通过线粒体途径激活caspase-3时引起线粒体膜通透性改变,使Ca2+大量释放入胞浆而加重钙超载,再次激活CaM和Ca2+/CaM依赖性激酶而活化JNK3形成恶性循环。
在脑缺血再灌注过程中,特别是缺血再灌注早期的氧自由基大量生成,利用其脂质过氧化作用,破坏神经元细胞膜,形成小裂隙,以及形成新的钙通道,造成大量Ca2+内流。研究发现,氧自由基清除剂SOD和CAT均可以降低细胞内Ca2+[9]。高浓度的细胞内Ca2+很容易激活磷脂酶和钙敏感性蛋白酶。磷脂酶A2和蛋白激酶C的活化可导致花生四烯酸形成,后者通过环氧化酶作用产生大量 H2O2和·OH。氧自由基还可以作用于线粒体膜,造成Ca2+顺浓度梯度进入线粒体,使线粒体内钙超载造成氧化磷酸化障碍,反过来又促进了自由基的生成[10]和Ca2+超载,这两者相互联系,协同作用,形成恶性循环,与前述恶性循环形成网络,最终导致神经元不可逆损伤。如果应用药物进行干预打断恶性循环就能减少神经元的凋亡。
细胞凋亡过程中caspase-3处于核心位置,凋亡的最后实施通过caspase-3的激活而实现[11]。缺血再灌注损伤引起的氧自由基增加、钙离子超载等损伤因素激活的凋亡信号转导的线粒体途径、死亡因子及其受体途径、内质网途径最终都会导致caspase-3活化,caspase-3被激活后可裂解其底物蛋白激酶C、多聚腺苷二磷酸核糖聚合酶,使损伤DNA的修复不能进行;活化的caspase-3可直接激活其它的 caspases(caspase-2,-8,-7,-6等),通过裂解DNA依赖的蛋白激酶、肌动蛋白、模板、甾醇调控的要素结合蛋白家族及异核核糖核苷蛋白家族,使DNA的损伤不能正常修复,引起核固缩,DNA裂解,凋亡小体形成。此外,活化的caspase-3可直接诱导线粒体凋亡途径,加速Bcl-2降解,加速线粒体功能障碍和细胞色素C释放,使凋亡信号不断放大,涉及范围不断增加,最终引起细胞凋亡[12-15]。Caspase-3是caspase级联“瀑布”下游最关键的凋亡蛋白酶,在各种因素启动的凋亡程序中起最后的枢纽作用[15]。研究表明caspase-3 mRNA表达在再灌注期先于凋亡发生,并且其表达时程较长,是检测缺血再灌注凋亡的敏感指标。
本实验证实:黄芪注射液可抑制缺氧缺糖/复氧复糖后海马神经元caspase-3蛋白,从而抑制缺氧缺糖/复氧复糖大鼠海马神经元的凋亡,而其机制可能是抑制CaM的生成及钙超载。
[1]罗玉敏,秦 震.黄芪甲甙对缺血脑组织 GSH-px,MDA含量的影响[J].中国临床神经科学,1998,6(3):146-148.
[2]张雅丽,高维娟,闫凤霞,等.黄芪注射液抑制缺氧缺糖后复氧复糖大鼠海马神经细胞凋亡的研究[J].中国老年学杂志,2009,29(7):793 -796.
[3]Brewer GJ,Torricelli JR,Evege EK,et al.Optimized survival of hippocampal neurons in B27-supplemented NeurobasalTM,a new serum -free medium combination[J].J Neurosci Res,1993,35(5):567 -576.
[4]Bossenmeyer C,Chihab R,Muller S,et al.Hypoxia/reoxygenation induces apoptosis through biphasic induction of protein synthesis in cultured rat brain neurons[J].Brain Res,1998,787(1):107 -116.
[5]赵艳梅,吴 宁,李 锦,等.慢性吗啡依赖及戒断对大鼠不同脑区NSF附着蛋白表达的影响[J].中国药理学通报,2008,24(5):616 -621.
[6]Gifford JL,Walsh MP,Vogel HJ.Structures and metalion-binding properties of the Ca2+-binding helix-loophe- lix EF - hand motifs[J].Biochem J,2007,405(2):199-221.
[7]Armstrong SC ,Latham CA ,Shivell CL ,et al.Ischemic loss of sarcolemmal dystrophin and spectrin:Correlationwith myocardial injury[J].Mol Cell Cardiol,2001,33(15):1165-1172.
[8]Toshiyuki SH,Takamori YS.DY29760e,a novel calmodulin antagonist,reduces infarction after permanent focal cerebral ischemia in rats[J].Pharmacology,2004,71(2):38-45.
[9]Dixon IM,Kanek M,Hata T,et al.Alterations incardiac membrane Ca2+transport during oxidative stress[J].Mol Cell Biochem,1990,99(2):125 -133.
[10]Goldhaber JI,Qayyum MS.Oxygen free radicals and excitation - contraction coupling[J].Antioxid Redox Signal,2000,2(1):55 -64.
[11]Thompson CB.Apoptosis in the pathogenesis and treatment of disease[J].Science,1995,267(5203):1456-1462.
[12]Ferri KF,Kroemer G.Organelle-specific initiation of celldeath pathways[J].Nat Cell Biol,2001,3(11):E255-E263.
[13]Springer JE,Azbill RD,Nottingham SA,et al.Calcineurin-mediated BAD dephosphorylation activates the caspase-3 apoptotic cascade in traumatic spinal cord injury[J].J Neurosci,2000,20(19):7246 -7251.
[14]Graham SH,Chen J.Programmed cell death in cerebral ischemia[J].J Cereb Blood Flow Metab,2001,21(2):99-109.
[15]Earnshaw WC,Martins LM,Kaufmann SH.Mammalian caspases:Structure,activation,substrates,and functions during apoptosis[J].Annu Rev Biochem,1999,68(21):383-424.
