大鼠侧脑室注射链脲佐菌素导致脑内能量减少及tau蛋白磷酸化增多
2011-08-02褚文政王晓彤于国平钱采韻
褚文政 王晓彤 佴 玉 于国平 钱采韻
(青岛大学医学院附属烟台毓磺顶医院神经内科,山东 烟台 264000)
散发性阿尔茨海默病(Sporadic Alzheimer's disease,SAD)的病因及发病机制至今不清,通常认为与遗传和环境因素有关。早期的脑葡萄糖代谢异常与痴呆症状明显相关。神经元的糖代谢异常归因于胰岛素/胰岛素受体(insulin/insulin receptor,I/IR)信号系统功能紊乱,ATP减少和I/IR功能紊乱均与β淀粉样蛋白(Aβ)沉积和tau蛋白过度磷酸化密切相关。已发现链脲佐菌素(Streptozotocin,STZ)侧脑室注射(intracerebroventricular injection,icv)可导致脑内胰岛素受体磷酸化能力及内在酪氨酸激酶活性下降,从而引起I/IR转导功能紊乱,进一步引起脑内葡萄糖代谢功能障碍及其他与SAD类似的病理变化。本研究试图验证侧脑室注射STZ后是否可导致脑内能量减少及tau蛋白磷酸化增多等与SAD相似的病理变化。
1 材料与方法
1.1 材料
1.1.1 动物和分组 成年雄性SD大鼠44只,体重250~320 g,由广东省实验动物中心提供,按随机数字表法分为STZ组和生理盐水(NS)组,每组22只。每只动物术前、术后第10、21天分别用快速血糖仪测尾静脉血糖,术前,术后无差别。
1.1.2 主要试剂 STZ(美国Introvengen公司);ATP酶检测试剂盒(南京建成公司)。5'-ATP钠盐(美国 Sigma公司)。tau-PSer202,tau-PSer396(美国 Biosource 公司),tau-PSer404(美国Santa Cruz公司)。Western印迹试剂盒(美国 Roche公司)。SABC显色试剂盒(福建迈新公司)。
1.1.3 主要仪器 大鼠脑立体定向仪(SN3日本);微量注射仪,微量血糖仪(美国强生公司);液相色谱仪(美国Water公司)。电泳仪及图像采集分析系统(美国Bio-Rad公司);高速冷冻离心机(德国Eppendorf公司)。紫外分光光度仪:UV-120-02型(日本津岛公司);JVC ky-F30B 3-CCD彩色图像摄录输入仪(日本)。
1.2 方法
1.2.1 模型制作 大鼠经10%水合氯醛(3 ml/kg)麻醉后,固定于SN3型脑立体定向仪。常规消毒皮肤,正中矢状切口,分离骨膜,锥颅器钻开颅骨,暴露硬脑膜。微量注射器每侧侧脑室注射STZ 10 μl(约3 mg/kg,注射前将STZ溶于生理盐水,浓度10%)。坐标参照文献〔1〕:前囟后1.5 mm,矢状缝左右旁开1.5 mm,脑表面下3.5 mm。第3天重复注射,剂量同前。对照组以等量NS代替STZ,其余操作相同。术后常规饲养21 d。
1.2.2 高效液相法检测大鼠脑海马区ATP含量 分别取STZ组和NS组大鼠各8只,麻醉取脑,冰上分离海马,每50 mg加入0.5 ml高氯酸,冰上匀浆,取上清,4℃离心10 000 r/min,5 min,再取上清,0.5 mol/ml氢氧化钠调pH至7.6~7.8;低温离心5 min,上清液氮保存,分析前取出解冻,20 μl上样。色谱条件:色谱柱:hypersil液相色谱柱(BDSC)18不锈钢柱(5 μm,ID4.6×30 cm);流动相:150 mmol/L磷酸二氢钾(pH6.45),流速0.8 ml/min;紫外检测波长为254 nm;色谱行为:保留时间约17 min;标准曲线:ATP 2.2 ~ 55 μg/ml,Y=29 246.2X-18 246.2,r=0.999 7。
1.2.3 免疫组织化学检测海马 tau-PSer202、tau-PSer396、tau-PSer404阳性细胞表达 建模后21 d,分别取STZ组和NS组大鼠各8只,常规麻醉,灌注,取脑,连续冰冻切片,片厚5 μm。行SABC免疫组织化学检查,一抗为兔抗大鼠1∶100 tau-PS-er202、1∶200 tau-PSer396、1∶100 tau-PSer404。阴性对照用磷酸盐缓冲液(PBS)代替一抗。二氨基联苯胺(DAB)显色,阳性细胞呈棕黄色。
1.2.4 Western印 迹 检 测 海 马 tau-PSer202、tau-PSer396、tau-PSer404表达 取STZ组大鼠和NS组大鼠各6只,麻醉,断头取脑,冰上分离海马,估计体积,加入2倍体积的预冷细胞裂解液,4℃离心,测蛋白浓度(Bradford法检测),将上清液蛋白浓度调整为2.5 μg/μl。样品变性后,于8%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶上样,每孔上样 20 μl及 Marker 8 μl,4℃过夜。将蛋白转到聚偏二氟乙烯(PVDF)膜上。封闭后,加入兔抗大鼠 tau-PSer202(1∶6 000)、tau-PSer396(1∶4 000)和 tau-PSer404(1∶800)抗体,4℃过夜。以 β-actin(1∶3 000)作内参照。辣根过氧化物酶标记山羊抗兔IgG1∶2 000,辣根过氧化物酶标记的抗生物素1∶1 000,室温轻摇40 min。用增强化学发光试剂(ECL)显色。暗室中用X感光胶片曝光10 s~5 min,显影1 min,定影3 min。根据发光的速度和强度,适当调整曝光时间,晾干后观片、拍照。应用AlphaImager 2200计算机全自动图像分析软件测量曝光后 X胶片上 tau-PSer202、tau-PSer396和tau-PSer404显色条带的面积(AREA)和平均光密度值(AVG),获得光密度值积分(IDV=AREA×AVG),分别取 tau-PSer202、tau-PSer396和tau-PSer404的IDV值与内参照β-actin的IDV值比较,即得到其蛋白表达的相对百分含量。
1.3 统计学分析 应用SPSS11.5统计软件进行分析,结果以表示,组间差异比较应用t检验及方差分析。
2 结果
2.1 两组ATP含量的比较 STZ组和NS组海马区ATP含量比较有显著性差异〔(4.33±1.70)vs(8.62±3.11),P<0.05〕。
2.2 海马区tau-PSer202、tau-PSer396和tau-PSer404阳性细胞表达STZ组和NS组分别取相同部位切片,计数每张切片海马区相近部位随机5个视野(10×20)下阳性细胞平均数。STZ组大鼠海马区tau-PSer202、tau-PSer396和tau-PSer404阳性细胞数较NS组明显增多,着色位于胞体与突起交接处及轴突处明显,细胞形态没有显著变化。NS组大鼠脑内很少 tau-PSer202、tau-PSer396和tau-PSer404阳性细胞。经Alpha imager 2200图像分析软件计数,差别有显著意义(P<0.05)。提示侧脑室注射STZ后可引起tau蛋白在这3个Ser位点上的的磷酸化增多。见表1,图1。
2.3 海马区tau-PSer202、tau-PSer396、tau-PSer404蛋白含量检测
STZ组tau-PSer202、tau-PSer396和tau-PSer404在海马部位表达明显增多,NS组也有少量表达,两者相对含量比较有显著差别(P<0.05)。多克隆抗体且tau蛋白存在异构体,在SDS凝胶上可表现2条或2条以上相近条带,分子量约55~65 kD。见表2,图2。
表1 两组大鼠海马区tau-PSer202、tau-PSer396、tau-PSer404阳性细胞表达(,n=8)

表1 两组大鼠海马区tau-PSer202、tau-PSer396、tau-PSer404阳性细胞表达(,n=8)
与NS组比较:1)P<0.05;下表同
组别 tau-PSer202 tau-PSer396 tau-PSer404 STZ组 152.53±72.1 261.6±52.61) 155.14±118.11)4.95±2.67 4.05±1.85 5.55±3.28 NS组
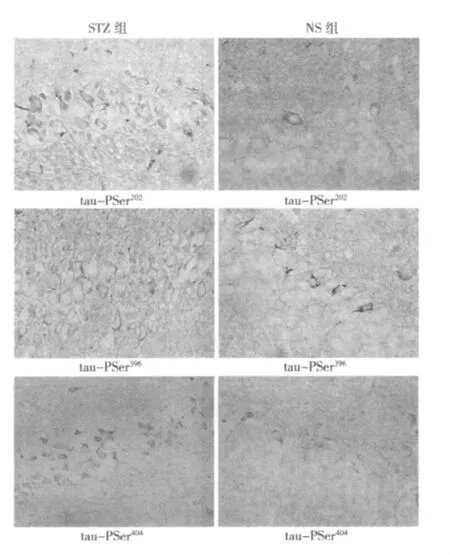
图1 STZ和NS组大鼠海马区tau-PSer202、tau-PSer396、tau-PSer404阳性细胞表达(DAB染色,×400)
表2 两组大鼠海马部位tau-PSer202、tau-PSer396和tau-PSer404相对含量(,n=6)
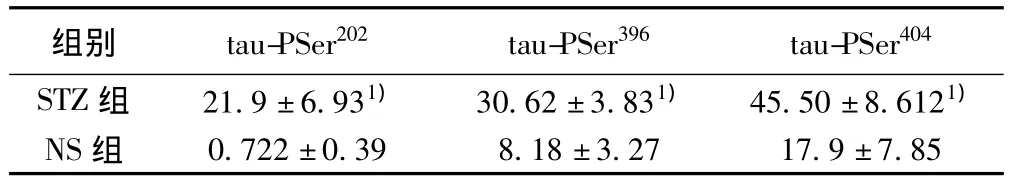
表2 两组大鼠海马部位tau-PSer202、tau-PSer396和tau-PSer404相对含量(,n=6)
组别 tau-PSer202 tau-PSer396 tau-PSer 404 STZ组 21.9±6.931) 30.62±3.831) 45.50±8.6121)NS组0.722±0.39 8.18±3.27 17.9±7.85

图2 两组大鼠海马部位tau-PSer202、tau-PSer396和tau-PSer404蛋白Western印迹表达结果
3 讨论
阿尔茨海默病(AD)患者脑葡萄糖代谢和细胞能量产生明显受损〔3〕。在SAD初期,葡萄糖代谢紊乱引起 ATP减少约50%,并随病程进展而加重;而ATP对于维持大部分细胞和分子水平功能至关重要〔4〕,ATP减少可使细胞离子转运异常,膜对离子通透性改变,甚至造成细胞内Ca2+超载,神经细胞变性或兴奋性传递受影响,诱导细胞的凋亡及坏死〔5~7〕。伴随ATP的减少,细胞线粒体受损严重,线粒体氧化磷酸化功能下降〔5,8〕。
在胎脑中tau蛋白约有6~8个磷酸化位点,在成人脑中约有2~3个磷酸化位点,其磷酸化水平可受发育调节。某些病理情况下tau蛋白可以异常磷酸化〔9〕。过度磷酸化的tau蛋白促进微管蛋白聚集和组装能力降低,导致微管稳定性下降,影响胞体和轴突间的细胞物质转运,进一步影响细胞功能或导致细胞死亡。tau蛋白在色氨酸和苏氨酸位点上的磷酸化受几种蛋白激酶和蛋白磷酸脂酶调控。促使tau蛋白磷酸化的激酶中包括ATP-dependent胰激肽原酶(PK)erk36和PKerk40、糖原合成激酶(GSK)-3β 和3α,都是受 I/IR 系统控制的〔10〕。ATP减少也可以激活PKerk36和PKerk40〔11〕;I/IR系统缺陷可以激活 GSK-3β活性,均可引起 tau 的磷酸化〔9,10,12,13〕。tau 蛋白可有多种异构体,通过不同的mRNA剪接而产生,模拟分子量约55~62 kD。
本文STZ组大鼠21 d后经免疫组化检测海马区tau-PSer202、tau-PSer396和tau-PSer404阳性表达均比NS组明显,染色位于胞质及胞体与突触结合处和轴突明显。经Western印迹检测两组海马tau-PSer202、tau-PSer396和tau-PSer404含量也有显著性差异。提示了STZ侧脑室注射后可能通过干扰I/IR系统,导致一些控制tau蛋白磷酸化和去磷酸化的酶活性变化,以及ATP的减少都可以促进tau的异常磷酸化。Hong等〔10〕在细胞水平已经证实I/IR系统可以通过磷脂酰肌醇3-激酶(PIK-3)途径抑制GSK-3β而调控tau蛋白的磷酸化水平。本文从大体模型证实用STZ干扰I/IR系统也可以导致tau蛋白的异常磷酸化,进一步提示I/IR系统功能紊乱在SAD发病中可能发挥了一定作用。
1 包新民,舒斯云.大鼠脑立体定向图谱〔M〕.北京:人民卫生出版社,1991:30-5.
2 Clark JB,Nicklas WJ.The metabolism of rat brain mitochondria.Preparation and characterization〔J〕.J Biol Chem,1970;245(18):4724-31.
3 Hoyer S.Oxidative metabolism deficiencies in brains of patients with Alzheimers disease〔J〕.Acta Neurol Scand Suppl,1996;165:18-24.
4 Hoyer S.Glucose metabolism and insulin receptor signal transduction in Alzheimer disease〔J〕.Eur J Pharmacol,2004;490(1-3):115-25.
5 Kaur G,Bhardwaj SK.The impact of diabetes on CNS.Role of bioenergetic defects〔J〕.Mol Chem Neuropathol,1998;35(1-3):119-31.
6 Stokes DL,Delavoie F,Rice WJ,et al.Structural studies of a stabilized phosphoenzyme intermediate of Ca2+-ATPase〔J〕.J Biol Chem,2005;280(18):18063-72.
7 Torlinska T,Grochowalska A.Age-related changes of NA(+),K(+)-ATPase,Ca(+2)-ATPase and Mg(+2)-ATPase activities in rat brain synaptosomes〔J〕.J Physiol Pharmacol,2004;55(2):457-65.
8 Labak M,Foniok T,Kirk D,et al.Metabolic changes in rat brain following intracerebroventricular injections of streptozotocin:a model of sporadic Alzheimer's disease〔J〕.Acta Neurochir Suppl,2007;106(1):177-81.
9 Plaschke K,Kopitz J,Siegelin M,et al.Insulin-resistant brain state after intracerebroventricular streptozotocin injection exacerbates Alzheimer-like changes in Tg2576 AbetaPP-overexpressing mice〔J〕.J Alzheimers Dis,2010;19(2):691-704.
10 Hong M,Lee VM.Insulin and insulin-like growth factor-1 regulate tau phosphorylation in cultured human neurons〔J〕.J Biol Chem,1997;272(31):19547-53.
11 Giasson BI,Cromlish JA,Athlan ES,et al.Activation of cyclic AMP-dependent protein kinase in okadaic acid-treated neurons potentiates neurofilament fragmentation and stimulates phosphorylation of Ser2 in the low-molecular-mass neurofilament subunit〔J〕.J Neurochem,1996;66(3):1207-13.
12 Ke YD,Delerue F,Gladbach A,et al.Experimental diabetes mellitus exacerbates tau pathology in a transgenic mouse model of Alzheimer's disease〔J〕.PLoS One,2009;4(11):7917.
13 Mandelkow EM,Drewes G,Biernat J,et al.Glycogen synthase kinase-3 and the Alzheimer-like state of microtubule-associated protein tau〔J〕.FEBS Lett,1992;314(3):315-21.
