吲哚美辛通过Akt/GSK3β/NAG-1信号通路诱导胃癌细胞的凋亡*
2011-08-02庞瑞萍胡品津曾志荣
庞瑞萍, 胡品津, 曾志荣, 陈 为
(中山大学1中山医学院生理教研室,2第一附属医院消化内科,广东 广州 510080)
流行病学研究表明长期使用非甾体类消炎药(non -steroidal anti- inflammatory drugs,NSAIDs)可预防结肠癌、食管癌、胃癌等肿瘤的发生[1,2]。许多临床前实验也证实此观点[3,4]。尽管目前NSAIDs在消化道肿瘤防治中的作用已被广泛认可,但其作用机制尚未完全阐明。传统观点认为NSAIDs是通过抑制环氧合酶(cyclooxygenase,COX)而发挥抑制肿瘤的作用,但越来越多的研究表明非COX依赖途径在其中也发挥了很重要的作用[5]。现已证实,除COX外,还有10多个靶点可介导NSAIDs的作用[6],如核因子 κB(nuclear factor κB,NF - κB)、3 - 磷酸肌醇依赖性激酶1(3-phosphoinositide-dependent kinase 1,PDK1)/Akt、过氧化物酶体增殖子活化受体(peroxisome proliferator - activated receptor,PPAR)、NSAID活化基因(non-steroidal anti-inflammatory drug-activated gene,NAG-1)等。其中磷脂酰肌醇3激酶/蛋白激酶B/Akt(phosphatidylinositol 3-kinase/protein kinase B/Akt,PI3K/PKB/Akt)通路既可调节细胞增殖和存活,又可以调节糖原合成,而这些都是肿瘤预防和治疗的重要靶点[7,8]。我们前期的研究发现COX抑制剂可抑制胃癌细胞的增殖,诱导胃癌细胞凋亡[9];在体实验表明COX抑制剂可明显抑制大鼠胃腺癌的发生[10]。进一步研究我们发现,COX抑制剂的上述作用与COX-2的表达并无明显关系[9,11]。本研究从细胞学角度观察吲哚美辛对胃癌细胞株生长的作用,并在此基础上探讨了吲哚美辛的作用与Akt/GSK3β/NAG-1信号通路的关系。
材料和方法
1 材料和方法
1.1 细胞培养 胃癌细胞株MGC-803由中科院上海细胞所赠送。细胞用含10%新生小牛血清(Hyclone)的DMEM培养基(Gibco)于37℃、5%CO2的培养箱内培养。以0.125%胰蛋白酶+0.020%EDTA(Sigma)消化传代。
1.2 蛋白表达的检测 蛋白表达测定按我们已报道的方法进行[9]。即细胞经各种处理后,用冰浴的PBS洗涤2遍,随后加入裂解缓冲液(150 mmol/L NaCl,50 mmol/L Tris - HCl,1 g/L SDS,0.2 g/L NaN3,5 mg/L aprotinin,1.0 mmol/L PMSF,1.0 g/L NP40,5.0 g/L 脱氧胆酸钠,pH 8.0),混匀后冰浴30 min,刮取细胞。样品经4℃、12000×g离心5 min后,取上清即蛋白提取液。蛋白定量后分别通过SDS-PAGE电泳分离蛋白和电转使蛋白转移至PVDF膜。用PBST洗脱PVDF膜5 min后,室温下封闭1 h。加入不同稀释的Ⅰ抗,室温温育2 h或4℃过夜。经PBST洗3次后加入相对应的Ⅱ抗,室温孵育2 h。PBST洗脱后经曝光、显影和定影,吸光度值(absorbance,A)通过凝胶成像系统及相应软件分析。
1.3 MTT法测定吲哚美辛对胃癌细胞活力的影响按我们已报道的方法进行[9]。将细胞(105cells/well)接种于96孔板,24 h后,依不同处理因素处理相应时间后,加入5 g/L MTT(四甲基偶氮唑盐,上海生物工程公司)10 μL/well,培养箱内继续孵育,4 h后吸去培养基,加入 DMSO(Sigma)100 μL/well,置酶标仪上(测定波长570 nm)测定A值。细胞活力(%)=(处理组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.4 吲哚美辛诱导胃癌细胞凋亡的检测 细胞凋亡检测按我们已报道的方法进行[9]。①Hoechst 33258核染色法 细胞经处理后,用多聚甲醛液(40 g/L,Sigma)固定10 min,蒸馏水洗涤后加入5 mg/L Hoechst33258(Promega),10 min后蒸馏水洗细胞2次,自然干燥后,细胞置于荧光显微镜下(340 nm激发光)观察并拍照。②流式细胞仪检测 细胞(1×109/L)用PBS洗2次,以70%乙醇(4℃)固定过夜。离心弃乙醇,细胞重悬于含有50 mg/L碘化丙啶和50 mg/L RNase A的染色液中避光染色30 min。以流式细胞仪测定,每样品计数12000个细胞,记录荧光强度值并以相应软件处理结果,计算凋亡率。
2 统计学处理
结 果
1 吲哚美辛对胃癌细胞株MGC-803活力的影响
MTT检测结果显示100-600 μmol/L吲哚美辛处理MGC-803细胞12、24和48 h后,细胞的活力随剂量增加和时间延长而降低,见图1。

Figure 1.Effects of indomethacin on viability of MGC-803 cells.MGC -803 cells were treated with indomethacin(100 -600 μmol/L)or DMSO vehicle(0.1%)for 12,24 and 48 h.The cell viability showed a concentration-and time-dependent reduction..n=6.*P <0.05,**P <0.01 vs DMSO.图1 吲哚美辛对MGC-803细胞活力的影响
2 吲哚美辛诱导MGC-803细胞的凋亡
Hoechst 33258核染色法结果表明,未加吲哚美辛的MGC-803细胞,胞核较大,浅染,呈弥散均匀荧光;500 μmol/L吲哚美辛处理12 h后胞核形态变得不规则,呈条纹状或裂隙状,并见部分细胞的染色质浓缩;处理24 h后染色质进一步凝集;处理48 h后,可见染色质裂解呈块状,见图2。
流式细胞术检测发现500 μmol/L吲哚美辛处理后各组均出现明显的凋亡峰。对照组细胞凋亡百分率为(3.9±1.6)%,吲哚美辛处理12、24和48 h组细胞凋亡率分别为(19.6±3.5)%、(38.8±6.1)%和(56.6±9.7)%,P <0.01,见图3。
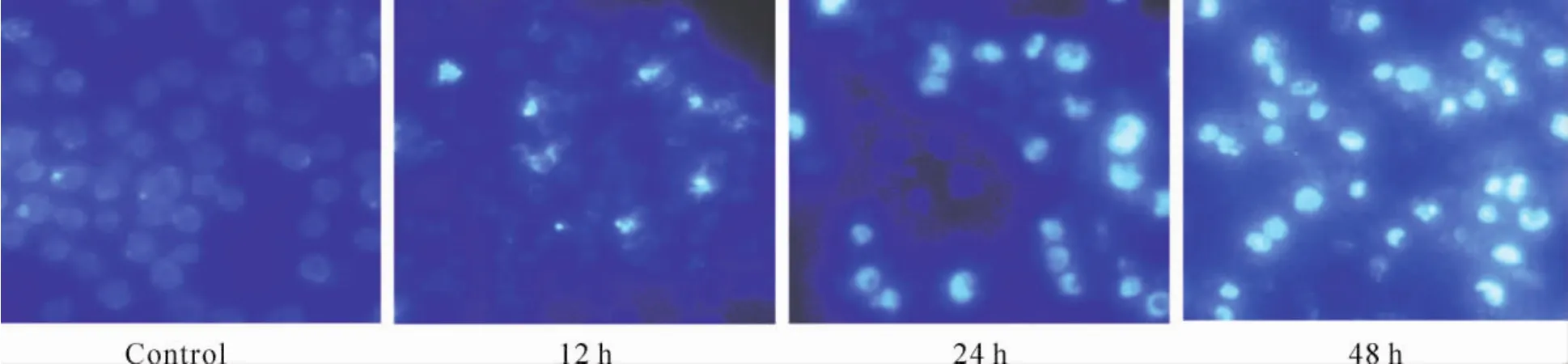
Figure 2.Morphological changes of MGC -803 cells induced by indomethacin(×400).After treated with 500 μmol/L indomethacin for 12,24 and 48 h,apoptotic bodies could be observed under fluorescent microscope.图2 吲哚美辛作用后MGC-803细胞形态学的变化
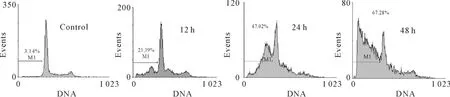
Figure 3.MGC -803 cell apoptosis after treatment with indomethacin(500 μmol/L)for 12,24 and 48 h analyzed by flow cytometry.图3 流式细胞术检测吲哚美辛处理后MGC-803细胞的凋亡率
3 吲哚美辛诱导caspase-3的活化
500 μmol/L吲哚美辛处理细胞12、24和48 h后,caspase-3酶原被激活,蛋白免疫印迹显示17 kD的活化caspase-3片段,其作用存在时间依赖性,见图4A。广谱caspase抑制剂zVAD-fmk 100 μmol/L可明显抑制吲哚美辛引起的caspase-3酶原的活化,见图4B。而且zVAD-fmk 100 μmol/L预处理后可显著降低吲哚美辛诱导的细胞凋亡作用,见图4C。这提示吲哚美辛主要通过caspase通路诱导胃癌细胞的凋亡。
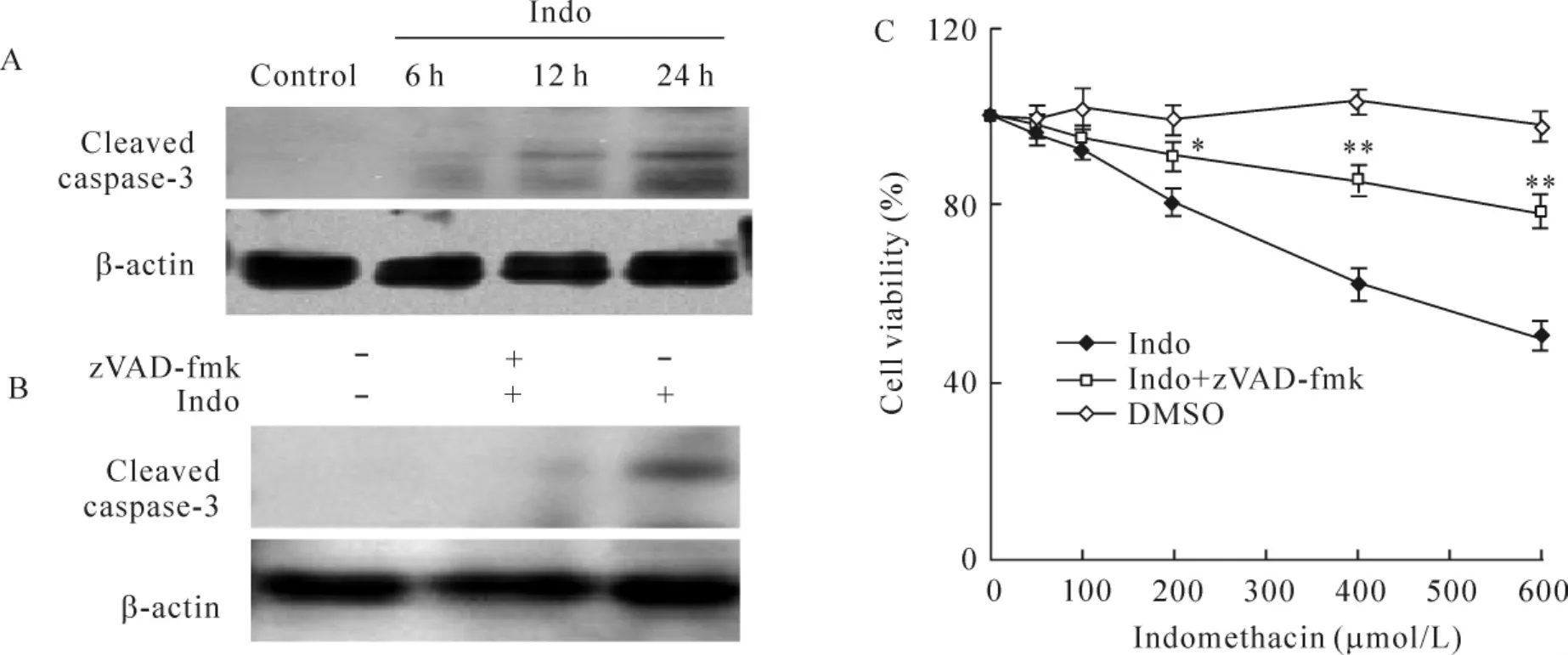
Figure 4.Effects of z-VAD-fmk on indomethacin-induced apoptosis.MGC -803 cells were treated with 500 μmol/L indomethacin for 6,12 and 24 h(A)or 24 h in the presence or absence of 100 μmol/L z-VAD-fmk(z-VAD -fmk was added to the cells 2 h prior to indomethacin treatment;DMSO vehicle concentration:0.1%)(B).Proteins were extracted and used for the detection of caspase-3 cleavage by Western blotting.C:indomethacin-induced reduction of cell viability was partially prevented by pretreatment with z-VAD-fmk.Indo:indomethacin..n=6.*P<0.05,**P<0.01 vs indomethacin group.图4 广谱caspase抑制剂z-VAD-fmk对吲哚美辛诱导MGC-803细胞凋亡的作用
4 吲哚美辛对Akt和GSK3β磷酸化的影响
吲哚美辛(500 μmol/L)作用于MGC-803细胞后,总Akt蛋白表达无明显变化,而Ser473位点磷酸化Akt的表达水平明显降低,见图5A、C。
吲哚美辛作用后,细胞总GSK3β的表达无显著变化,而GSK3β Ser9磷酸化水平降低,见图5B、D。
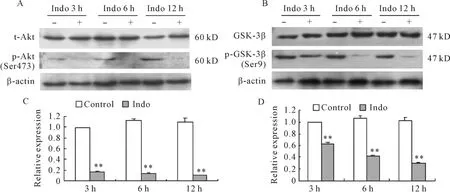
Figure 5.Effects of indomethacin on the phosphorylation of Akt and GSK3β in MGC -803 cells.Indomethacin(500 μmol/L)treatment inhibited the phosphorylation of Akt(Ser473)(A,C)and GSK3β (Ser9)(B,D)in MGC -803 cells,but did not change the total Akt and GSK3β.Indo:indomethacin..n=4.**P<0.01 vs corresponding control.图5 吲哚美辛对MGC-803细胞Akt和GSK3β磷酸化的影响
5 吲哚美辛通过PI3K/Akt/GSK3β信号通路诱导NAG-1的表达
吲哚美辛可以增加NAG-1的表达,而单独应用PI3K抑制剂 LY294002(20 μmol/L)和 Akt抑制剂1L-6-hydroxymethyl-chiro-inositol 2(R)-2-O -octadecylcarbonate(10 μmol/L)处理后,也可增加NAG-1蛋白表达。预先加入 GSK3β抑制剂SB216763(10 μmol/L)孵育1 h可完全取消PI3K抑制剂和Akt抑制剂诱导NAG-1表达的作用,见图6A、C。PI3K 抑制剂 LY294002(20 μmol/L)和 Akt抑制剂(10 μmol/L)预孵育 1 h 后再加入500 μmol/L吲哚美辛,NAG-1的表达水平与单用吲哚美辛相比无显著差异。而预先加入 GSK3β抑制剂SB216763(10 μmol/L)孵育1 h,则完全取消吲哚美辛诱导NAG-1表达的作用,见图6B、D。
6 GSK3β抑制剂对吲哚美辛诱导胃癌细胞凋亡的影响
预先加入SB216763(10 μmol/L)孵育1 h可显著抑制吲哚美辛诱导细胞凋亡的作用,见图7。
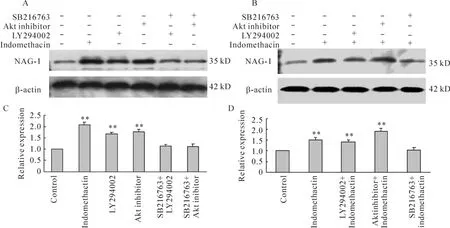
Figure 6.Effects of PI3K,Akt and GSK3β inhibitors on NAG -1 expression induced by indomethacin in MGC -803 cells.MGC -803 cells were treated with 20 μmol/L LY294002,a specific PI3K inhibitor,or 10 μmol/L 1L -6 - hydroxymethyl- chiro - inositol 2(R)-2-O -octadecylcarbonate,a selective Akt inhibitor,or pre-addition of 10 μmol/L SB216763,a selective GSK3β inhibitor for 12 h in the presence(B,D)or absence(A,C)of 500 μmol/L indomethacin.The cell lysates were harvested for Western blotting analysis using anti-NAG-1 antibody..n=5.**P<0.01 vs control.图6 PI3K、Akt和GSK3β抑制剂对吲哚美辛诱导MGC-803细胞NAG-1表达的影响
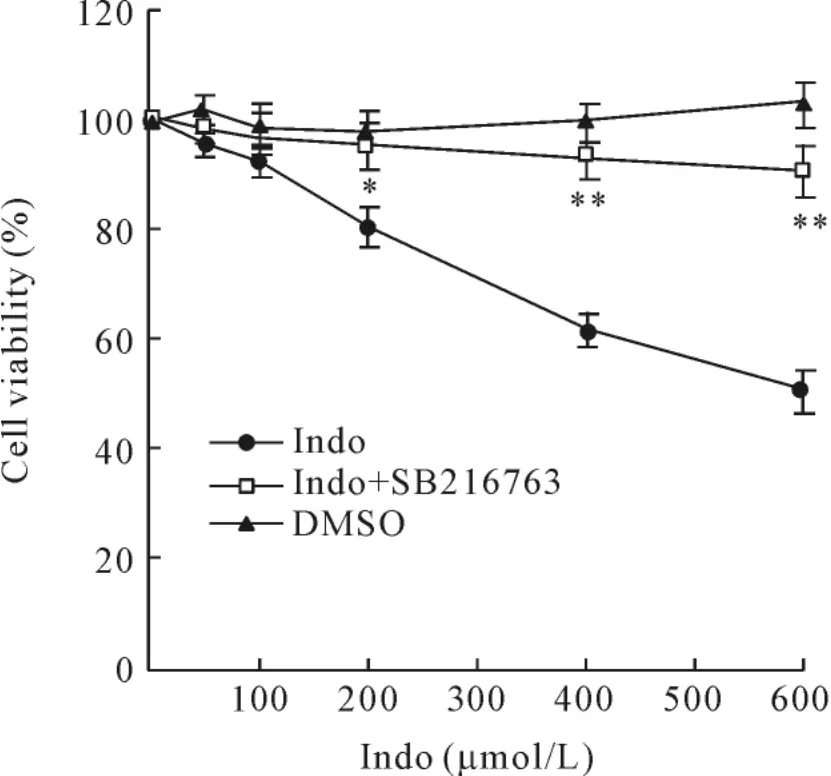
Figure 7.GSK3β inhibitor blocks the indomethacin-induced inhibition of cells growth.Indomethacin-induced reduction of cell viability was prevented by pretreatment with 10 μmol/L SB216763(SB216763 was added to the cells 1 h prior to indomethacin treatment;DMSO vehicle concentration:0.1%).Indo:indomethacin..n=6.*P<0.05,**P<0.01 vs indomethacin group.图7 GSK3β抑制剂可阻断吲哚美辛诱导的细胞凋亡作用
讨 论
Akt(PKB)是细胞存活和凋亡的重要调节因子,Akt的磷酸化可保护多种类型细胞的凋亡。越来越多的证据显示Akt可通过促进细胞的增殖和抑制细胞凋亡参与肿瘤的发生和发展[12]。在肺癌和肝癌细胞,研究表明Akt的磷酸化参与了COX-2介导的促细胞存活过程[12,13]。Akt的磷酸化位点包括催化结构域的Thr308位点和调节结构域的Ser473位点。Thr308位点的磷酸化只能部分激活Akt,只有2个位点的磷酸化才能使Akt充分活化。已有研究表明,NSAIDs诱导前列腺癌、肝细胞肝癌等的凋亡作用与抑制Akt Thr308和Ser473位点的磷酸化水平相关[14,15]。在人结肠癌细胞株 HT -29 细胞,celecoxib诱导细胞凋亡作用同时Akt和GSK3β磷酸化水平均被明显抑制[16]。活化后的Akt主要通过对含有丝氨酸/苏氨酸残基的底物磷酸化而发挥作用。GSK3β是Akt的重要底物之一,它作为细胞凋亡的上游调节因子,参与调控多种细胞的凋亡过程[17]。在基础状态下,GSK3β即有较高的活性。Akt通过磷酸化GSK3β的Ser9而抑制其活性。最近有报道认为celecoxib可通过抑制PI3K/Akt/GSK3β通路诱导结肠癌细胞的凋亡[18]。本实验中,我们在MGC-803细胞检测到基础状态Akt Ser473位点和GSK3β Ser9位点的磷酸化,吲哚美辛可明显抑制 Akt Ser473和GSK3β Ser9的磷酸化水平,而对总的 Akt和总GSK3β表达水平无影响。进一步研究发现,GSK3β选择性抑制剂 SB216763可几乎完全逆转吲哚美辛诱导MGC-803细胞凋亡的作用。这些结果说明吲哚美辛是通过Akt/GSK3β信号通路诱导MGC-803细胞凋亡。但GSK3β的信号下游底物尚未明了。
NAG-1又称为巨噬细胞抑制因子1(macrophage inhibitory factor 1,MIF-1)、生长分化因子15(growth differentiation factor 15,GDF-15)等,属于转化生长因子β(transforming growth factor β,TGF-β)超家族成员。已有的研究表明,NAG-1过表达可抑制乳腺癌细胞、上皮肿瘤细胞和前列腺癌细胞的增殖[18,19],而且 NAG -1 过表达的人结肠癌和胶质瘤细胞种植于裸鼠后,其成瘤能力明显降低[20,21]。进一步研究显示,NAG-1过表达可引起前列腺癌细胞产生 caspase依赖性的凋亡[22]。这些结果提示NAG-1与肿瘤的发生密切相关。但NAG-1的调控机制尚未完全清楚。已知NSAIDs可诱导NAG-1蛋白表达的上调。已有研究认为NSAIDs主要是通过早期生长反应基因-1(early growth response gene-1,EGR -1)上调 NAG -1的表达[23]。最近有研究提示 NAG -1的表达受 PI3K/Akt/GSK3β[24]信号通路调控。我们的实验发现,在MGC-803细胞,吲哚美辛可诱导NAG-1的表达上调。单用PI3K抑制剂和Akt抑制剂亦可明显上调NAG-1的表达,预先加入GSK3β抑制剂则完全取消PI3K抑制剂和Akt抑制剂对 NAG-1的作用,提示 PI3K/Akt/GSK3β信号通路参与调控MGC-803细胞NAG-1的表达。我们的结果与结肠癌细胞上的研究结果相一致[23]。如预先加入GSK3β抑制剂则可取消吲哚美辛上调NAG-1表达的作用,而在PI3K抑制剂和Akt抑制剂作用的基础上,吲哚美辛对NAG-1表达的上调作用与单用吲哚美辛相比并无差异。提示在胃癌细胞株MGC-803细胞,吲哚美辛主要是通过Akt/GSK3β信号通路上调NAG-1的表达。
综上所述,我们的结果表明,在胃癌细胞株MGC-803细胞,非选择性COX抑制剂吲哚美辛主要是通过Akt/GSK3β信号通路上调NAG-1的表达,进而诱导细胞的凋亡。
[1]Kelloff GJ,Boone CW,Crowell JA,et al.Chemopreventive drug development:perspectives and progress[J].Cancer Epidemiol Biomarkers Prev,1994,3(1):85 -98.
[2]Rothwell PM,Fowkes FG,Belch JF,et al.Effect of daily aspirin on long-term risk of death due to cancer:analysis of individual patient data from randomised trials[J].Lancet,2011,377(9759):31 -41.
[3]Dubois RN,Abramson SB,Crofford L,et al.Cyclooxygenase in biology and disease[J].FASEB J,1998,12(12):1063-1073.
[4]D'Arca D,LeNoir J,Wildemore B,et al.Prevention of urinary bladder cancer in the FHIT knock-out mouse with Rofecoxib,a Cox - 2 inhibitor[J].Urol Oncol,2010,28(2):189-194.
[5]Tegeder I,Pfeilschifter J,Geisslinger G.Cyclooxygenase- independent actions of cyclooxygenase inhibitors[J].FASEB J,2001,15(12):2057 -2072.
[6]Soh JW,Weinstein IB.Role of COX -independent targets of NSAIDs and related compounds in cancer prevention and treatment[J].Prog Exp Tumor Res,2003,37:261 - 285.
[7]Carracedo A,Pandolfi PP.The PTEN-PI3K pathway:of feedbacks and cross - talks[J].Oncogene,2008,27(41):5527-5541.
[8]LoPiccolo J,Blumenthal GM,Bernstein WB,et al.Targeting the PI3K/Akt/mTOR pathway:effective combinations and clinical considerations[J].Drug Resist Updat,2008,11(1 -2):32 -50.
[9]庞瑞萍,胡品津,曾志荣,等.塞来昔布诱导不表达环氧合酶-2的胃癌细胞凋亡研究[J].中国病理生理杂志,2006,22(5):842 -845.
[10]Hu PJ,Yu J,Zeng ZR,et al.Chemoprevention of gastric cancer by celecoxib in rats[J].Gut,2004,53(2):195-200.
[11]Yu J,Tang BD,Leung WK,et al.Different cell kinetic changes in rat stomach cancer after treatment with celecoxib or indomethacin:implications on chemoprevention[J].World J Gastroenterol,2005,11(1):41 - 45.
[12]Sánchez- Alcázar JA,Bradbury DA,Pang L,et al.Cyclooxygenase(COX)inhibitors induce apoptosis in nonsmall cell lung cancer through cyclooxygenase independent pathways[J].Lung Cancer,2003,40(1):33 - 44.
[13]Vivanco I,Sawyers CL.The phosphatidylinositol 3-kinase - AKT pathway in human cancer[J].Nat Rev Cancer,2002,2(7):489 -501.
[14]Kulp SK,Yang YT,Hung CC,et al.3-Phosphoinositide-dependent protein kinase-1/Akt signaling represents a major cyclooxygenase-2-independent target for celecoxib in prostate cancer cells[J].Cancer Res,2004,64(4):1444-1451.
[15]Leng J,Han C,Demetris AJ,et al.Cyclooxygenase - 2 promotes hepatocellular carcinoma cell growth through Akt activation:evidence for Akt inhibition in celecoxib-induced apoptosis[J].Hepatology,2003,38(3):756 -758.
[16]Arico S,Pattingre S,Bauvy C,et al.Celecoxib induces apoptosis by inhibiting 3-phosphoinositide-dependent protein kinase-1 activity in the human colon cancer HT-29 cell line[J].J Biol Chem,2002,277(31):27613 -27621.
[17]Bijur GN,Jope RS.Proapoptotic stimuli induce nuclear accumulation of glycogen synthase kinase-3β[J].J Biol Chem,2001,276(40):37436 -37442.
[18]Li PX,Wong J,Ayed A,et al.Placental transforming growth factor-β is a downstream mediator of the growth arrest and apoptotic response of tumor cells to DNA damage and p53 overexpression[J].J Biol Chem,2000,275(26):20127-20135.
[19]Tan M,Wang Y,Guan K,et al.PTGF - β,a type β transforming growth factor(TGF-β)superfamily member,is a p53 target gene that inhibits tumor cell growth via TGF - β signaling pathway[J].Proc Natl Acad Sci USA,2000,97(1):109 -114.
[20]Baek SJ,Kim KS,Nixon JB,et al.Cyclooxygenase inhibitors regulate the expression of a TGF-β superfamily member that has proapoptotic and antitumorigenic activities[J].Mol Pharmacol,2001,59(4):901 -908.
[21]Albertoni M,Shaw PH,Nozaki M,et al.Anoxia induces macrophage inhibitory cytokine-1(MIC-1)in glioblastoma cells independently of p53 and HIF -1[J].Oncogene,2002,21(27):4212 -4219.
[22]Liu T,Bauskin AR,Zaunders J,et al.Macrophage inhibitory cytokine 1 reduces cell adhesion and induces apoptosis in prostate cancer cells[J].Cancer Res,2003,63(16):5034-5040.
[23]Baek SJ,Kim JS,Moore SM,et al.Cyclooxygenase inhibitors induce the expression of the tumor suppressor gene EGR-1,which results in the up-regulation of NAG-1,an antitumorigenic protein[J].Mol Pharmacol,2005,67(2):356-364.
[24]Yamaguchi K,Lee SH,Eling TE,et al.Identification of nonsteroidal anti-inflammatory drug-activated gene(NAG-1)as a novel downstream target of phosphatidylinositol 3-kinase/AKT/GSK -3β pathway[J].J Biol Chem,2004,279(48):49617 -49623.
