曲美他嗪与帕瑞昔布联合给药对急性心肌梗死期大鼠心脏的保护作用
2011-08-02李悦山
罗 文, 李悦山
(广州医学院药理学教研室,广东 广州 510182)
急性心肌梗死后,临床上主要的治疗思路是“尽快溶栓再灌注”,但是对于缺血引发的心肌细胞凋亡[1],目前没有相应的治疗方法。环氧化酶2(cyclooxygenase 2,COX-2)作为一种重要的炎症反应介质,在正常的心肌细胞中含量非常低,但是当受到缺血、缺氧等刺激时会诱导性表达增高,在心肌缺血性损伤中发挥重要调节作用[4-10]。目前,关于COX-2是心肌缺血损伤过程中的保护因子还是有害因子争论较大。曲美他嗪(trimetazidine,TMZ)是一种新型的细胞保护剂,能优化缺血时心肌细胞的能量代谢,在早期缺血/再灌注损伤中有抗细胞凋亡的作用[3],而在急性心肌梗死中是否同样具有抗心肌细胞凋亡的作用未见报道。本研究选用大鼠急性心肌梗死模型,使用改善心肌能量代谢的TMZ和选择性COX-2抑制剂帕瑞昔布钠(parecoxib sodium)分别单独给药和联合给药治疗,观察它们是否能对急性心肌梗死大鼠心脏细胞发挥保护作用,并初步探讨其机制。
材料和方法
1 材料
1.1 主要试剂 注射用帕瑞昔布钠(美国辉瑞制药有限公司),盐酸曲美他嗪片(天津施维雅制药有限公司)。总RNA提取试剂Trizol(TaKaRa),RT试剂盒(广州莱德尔公司),PCR loading dye mix(TaKa-Ra)。GAPDH(glyceraldehyde-3-phosphate dehydrogenase)、Bcl-2(B -cell leukemia/lymphoma -2)、Bax(Bcl-2 -associated protein X)引物均由Invitrogen合成。COX -2、Bax、Bcl-2、cleaved caspase-3(CC-3)Ⅰ抗购于 Santa Cruz。Caspase-3分光光度法检测试剂盒购于南京凯基生物。DNA ladder凋亡检测试剂盒购于碧云天生物技术研究所。
1.2 动物 健康雄性SD大鼠80只,250-300 g,雌雄不限,购于广东省医学实验动物中心。
2 方法
2.1 动物模型制备 大鼠麻醉后,使用气管插管辅助呼吸。观察正常心电图。开胸暴露心脏后,用6-0丝线结扎冠状动脉左前降支(left anterior descending,LAD)。以出现ST段与结扎前相比上抬大于0.20 mV 和/或 T 波变宽大于 0.12 mV[5]、心脏左前壁明显变白等缺血变化作为结扎成功的标志。整个手术过程均保持无菌操作。术后24 h给予足量水和饲料。未见ST段上抬的大鼠弃去。假手术组只穿线,不结扎,其它操作同模型组一致。
2.2 实验分组及给药流程 66只大鼠被分为:假手术组(sham):10只,大鼠只穿线,不结扎;急性心肌梗死模型组(acute myocardial ischemia,AMI):14只,AMI+生理盐水腹腔注射或生理盐水灌胃;曲美他嗪治疗组(AMI+TMZ):14只,AMI+曲美他嗪灌胃给药(20 mg·kg-1·d-1);帕瑞昔布钠治疗组(AMI+parecoxib):14只,AMI+帕瑞昔布钠腹腔注射给药(0.75 mg·kg-1·d-1);曲美他嗪和帕瑞昔布钠联合治疗组(AMI+TMZ+parecoxib):14只,AMI+曲美他嗪灌胃给药(20 mg·kg-1·d-1)+帕瑞昔布钠腹腔注射给药(0.75 mg·kg-1·d-1)。所有大鼠常规给食物和饮水。从造模第3 d至第7 d给药,术后第8 d开始采集数据。
2.3 心功能的测定 取术后第8 d的各组大鼠,麻醉后辅助呼吸。常规右侧颈总动脉插管,采用Pclab-3804科研型生物信号采集系统测量心率(heart rate,HR)、左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末期压(left ventricular end-diastolic pressure,LVEDP)、左室内压最大上升速率(maximum of increase rate of left ventricular pressure,+dp/dtmax)和左室内压最大下降速率(maximum of decrease rate of left ventricular pressure,-dp/dtmax)。
2.4 检测心肌梗死面积 大鼠迅速处死取心脏,剪去左右心房和右心室,记录左心室重量。将心脏横切至5-6片,置于 TTC(2,3,5-triphenyltetrazolium chlorid)缓冲液中37℃避光孵育20 min,可见梗死区呈灰白色,非梗死区呈深红色。在解剖镜下将梗死区和非梗死区分离开来,分别称重。梗死比例以梗死心肌重量与左心室重量之比表示。
2.5 DNA ladder检测心肌梗死周边区细胞凋亡程度 具体步骤参考碧云天细胞凋亡DNA ladder抽提试剂盒。提取出的DNA用1%琼脂糖凝胶电泳分析,拍照记录。
2.6 RT-PCR检测心肌组织中bax与bcl-2 mRNA含量 提取心肌梗死周边区总RNA后,进行逆转录和PCR反应。将所得的bax、bcl-2及GAPDH的PCR产物电泳后拍照,结果进行灰度值分析。具体步骤、引物序列和退火温度参见文献。
2.7 心肌梗死周边区caspase-3活化检测 参照凯基生物的caspase-3分光光度法检测试剂盒说明书,通过酶标仪检测吸光度值,分析caspase-3的活化程度。
2.8 Western blotting检测心肌梗死周边区COX-2、Bax、Bcl-2、CC-3蛋白水平 提取心肌组织总蛋白后,BCA法测定蛋白浓度。电泳,转膜,脱脂奶粉封闭,孵育Ⅰ抗(1∶1000)4℃过夜,或 GAPDH(1∶1000)室温2 h,Ⅱ抗(1∶1000)室温孵育 2 h,曝光,结果用图像分析系统进行分析。
3 统计学处理
结 果
1 联合给药治疗对大鼠心功能的影响
大鼠冠状动脉左前降支结扎后,Vmax、LVSP、+dp/dtmax、LVEDP、- dp/dtmax均下降(P <0.05)。与AMI组相比,帕瑞昔布钠给药治疗1周后,LVSP与+dp/dtmax均显著升高(P<0.05);LVEDP与-dp/dtmax也上升,但是差异无显著(P>0.05)。而TMZ给药治疗 1 周后,Vmax、LVSP、+dp/dtmax、LVEDP、-dp/dtmax的变化均差异显著(P<0.05)。联合治疗组的心功能恢复程度要优于单独给药,见表1、2。
表1 各组大鼠心脏收缩功能指标Table 1.The contractile function of heart in each group(.n=10)
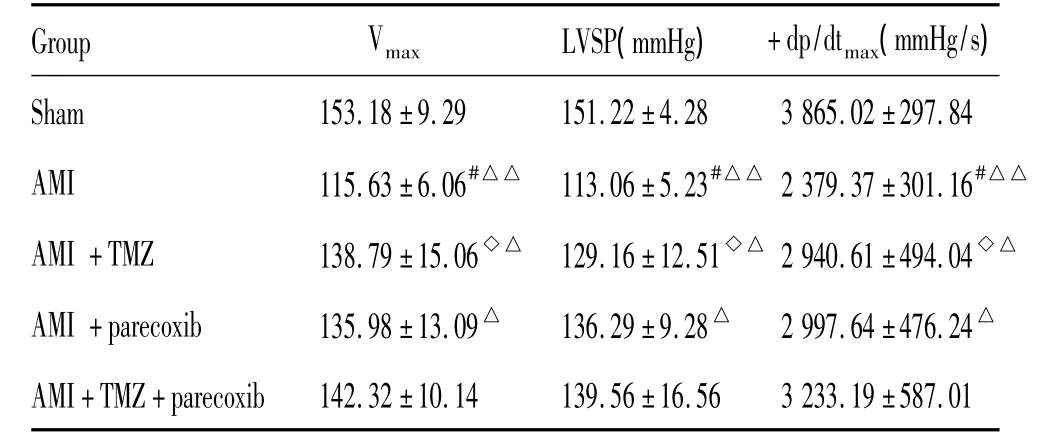
表1 各组大鼠心脏收缩功能指标Table 1.The contractile function of heart in each group(.n=10)
#P <0.05 vs sham;◇P <0.05 vs AMI;△P <0.05,△△P <0.01 vs AMI+TMZ+parecoxib.
Sham 153.18±9.29 151.22±4.28 3865.02±297.8456 3233.19 ±587.01 AMI 115.63±6.06#△△ 113.06±5.23#△△ 2379.37±301.16#△△AMI+TMZ 138.79±15.06◇△ 129.16±12.51◇△ 2940.61±494.04◇△AMI+parecoxib 135.98±13.09△ 136.29±9.28△ 2997.64±476.24△AMI+TMZ+parecoxib 142.32±10.14 139.56±16.
表2 各组大鼠心脏舒张功能指标Table 2.The diastolic function of heart in each group(.n=10)

表2 各组大鼠心脏舒张功能指标Table 2.The diastolic function of heart in each group(.n=10)
#P<0.05 vs sham;◇P<0.05 vs AMI;△P <0.05,△△P <0.01 vs AMI+TMZ+parecoxib.
Group LVEDP(mmHg) -dp/dtmax(mmHg/s).17 Sham 37.21 ±4.28 4143.71 ±162.31 AMI 15.13 ±10.06#△△ 2411.79 ±239.43#△AMI+TMZ 25.05 ±15.51◇△ 3118.49 ±144.23◇AMI+parecoxib 17.86 ±9.28△ 2499.11 ±530.28△AMI+TMZ+parecoxib 29.14 ±14.42 3379.37 ±501△△
2 联合给药治疗对大鼠心肌梗死面积的影响
TMZ组与AMI组比较,梗死面积显著减小(P<0.01);parecoxib治疗组与AMI组相比,梗死面积比例有缩小的趋势,但是无显著差异(P>0.05)。TMZ+parecoxib联合治疗组与AMI组比较,梗死面积比例缩小(P<0.01),与parecoxib治疗组相比,梗死面积比例缩小(P<0.01),与TMZ组相比,梗死面积比例缩小(P<0.05),见表3。
表3 各组大鼠心肌梗死面积比例Table 3.The rate of infarct size of heart in each group(.n=3)
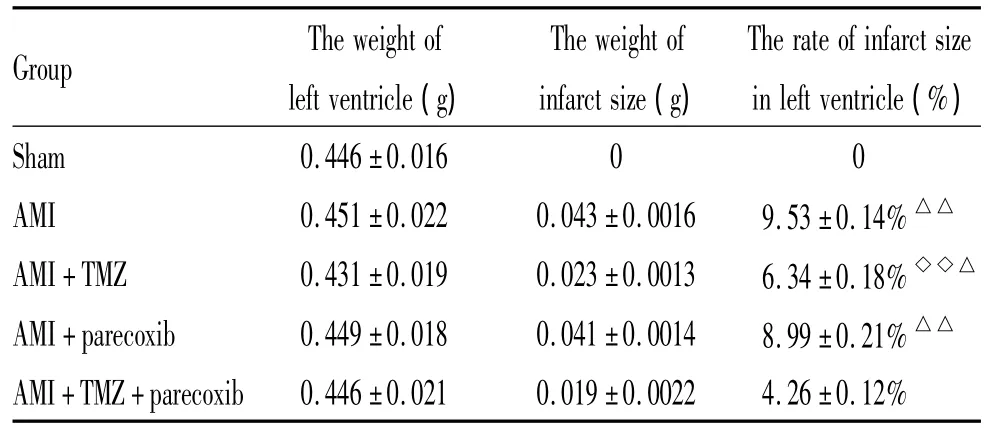
表3 各组大鼠心肌梗死面积比例Table 3.The rate of infarct size of heart in each group(.n=3)
◇◇P <0.01 vs AMI;△P <0.05,△△P <0.01 vs AMI+TMZ+parecoxib.
Group The weight of left ventricle(g)The weight of infarct size(g)The rate of infarct size in left ventricle(%)2 4.26±0.12%Sham 0.446 ±0.016 0 0 AMI 0.451±0.022 0.043±0.0016 9.53±0.14% △△AMI+TMZ 0.431±0.019 0.023±0.0013 6.34±0.18% ◇◇△AMI+parecoxib 0.449±0.018 0.041±0.0014 8.99±0.21% △△AMI+TMZ+parecoxib 0.446 ±0.021 0.019 ±0.002
3 联合给药治疗对心肌梗死周边区细胞凋亡的影响
与sham组相比,AMI组出现明显的ladder,说明梗死确实能引起心肌细胞出现明显的凋亡。TMZ和parecoxib单独给药组的ladder条带化程度减弱,说明二者单独治疗均能不同程度地抑制细胞凋亡,而联合给药治疗组的抑制作用更加明显,说明二者具有一定的协同诱导凋亡的作用,见图1。

Figure 1.DNA ladder pattern in the infarct border zone of rat heart.M:DNA marker;Lane 1:sham;Lane 2:AMI:Lane 3:AMI+TMZ;Lane 4:AMI+parecoxib;Lane 5:AMI+TMZ+parecoxib.图1 各组大鼠心梗周边区细胞凋亡DNA ladder图
4 联合给药治疗对心肌梗死周边区caspase-3活化程度的影响
与sham组相比,AMI组大鼠心肌梗死周边区的caspase-3活化程度明显增高(P<0.01);parecoxib组与AMI组相比,caspase-3的活化程度下降(P<0.05);TMZ治疗组与AMI组相比,caspase-3的活化程度也下降(P<0.05);而parecoxib和TMZ联合治疗组与AMI组相比,caspase-3活化程度显著下降(P<0.01),联合给药治疗比单独给药治疗的效果更明显,见表4。
表4 各组大鼠心肌梗死周边区caspase-3活化程度Table 4.The activation of caspase-3 in the infarct border zone of heart in each group(%..n=4)

表4 各组大鼠心肌梗死周边区caspase-3活化程度Table 4.The activation of caspase-3 in the infarct border zone of heart in each group(%..n=4)
##P <0.01 vs sham;△P <0.05,△△P <0.01 vs AMI.
Group Caspase-3 activation Sham 100 AMI 150.73 ±12.81##AMI+TMZ 138.03 ±17.51△AMI+parecoxib 134.23 ±10.11△AMI+TMZ+parecoxib 122.69 ±13.72△△
5 联合给药对心肌梗死周边区bax mRNA与bcl-2 mRNA表达的影响
与sham组相比,AMI组的bax/bcl-2 mRNA表达比例升高(P<0.01);与sham组相比,parecoxib或TMZ单独给药时,bax/bcl-2的比例下降(P<0.05);而parecoxib和TMZ联合治疗组能显著逆转AMI引起的bax/bcl-2表达比例增高(P<0.05),联合给药治疗效果优于单独给药治疗,见图2。
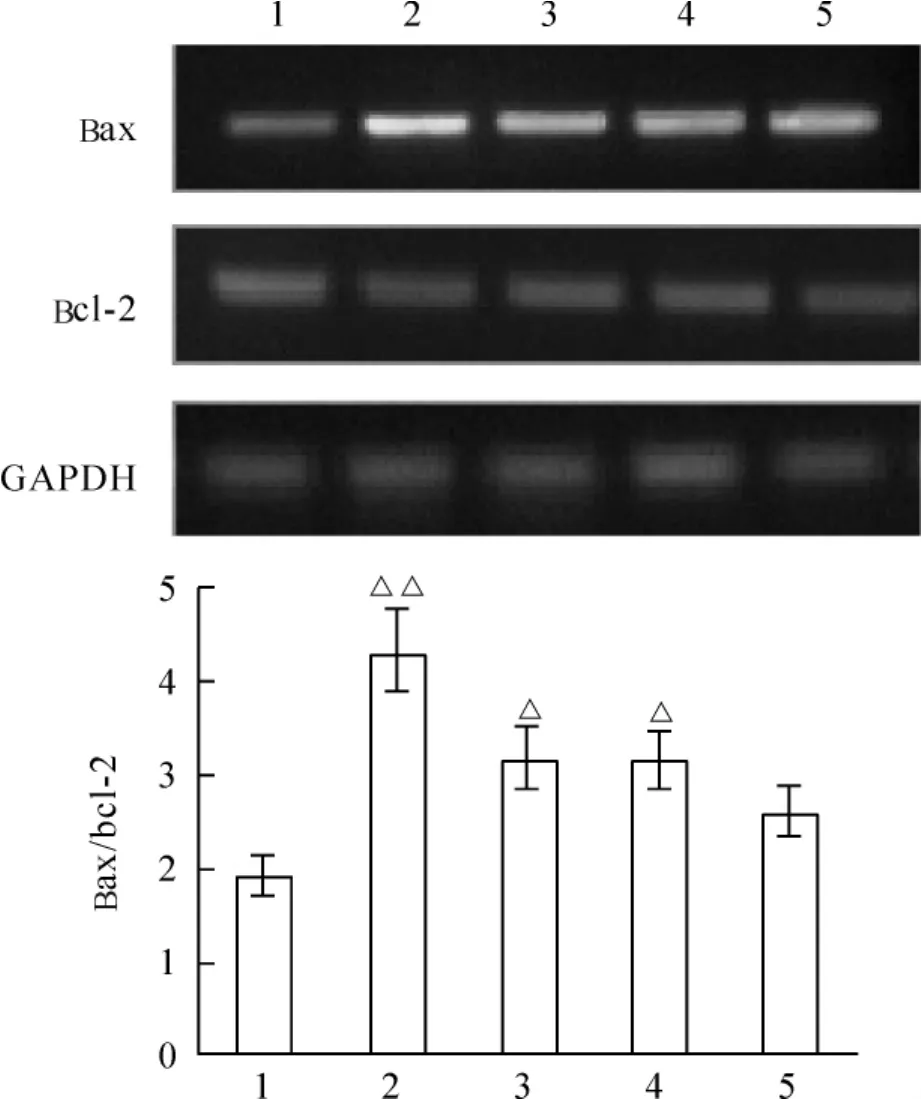
Figure 2.Bax,bcl-2 and GAPDH mRNA expression in the infarct border zone of the rat heart in each group.Lane 1:sham;Lane 2:AMI:Lane 3:AMI+TMZ:Lane 4:AMI+parecoxib;Lane 5:AMI+TMZ+parecoxib..n=4.△P <0.05,△△P <0.01 vs Lane 5.图2 各组大鼠心肌bax、bcl-2与GAPDH mRNA含量
6 联合给药治疗对心肌梗死周边区COX-2、Bax、Bcl-2和cleaved caspase-3蛋白表达的影响
COX-2蛋白在假手术组的大鼠心肌组织中几乎不表达。AMI组与sham组相比,COX-2蛋白表达升高(P<0.01);parecoxib治疗组和联合治疗组分别与AMI组相比,COX-2的表达均下降(P<0.01);TMZ治疗组COX-2与AMI组相比,表达变化不明显(P>0.05),见图3。
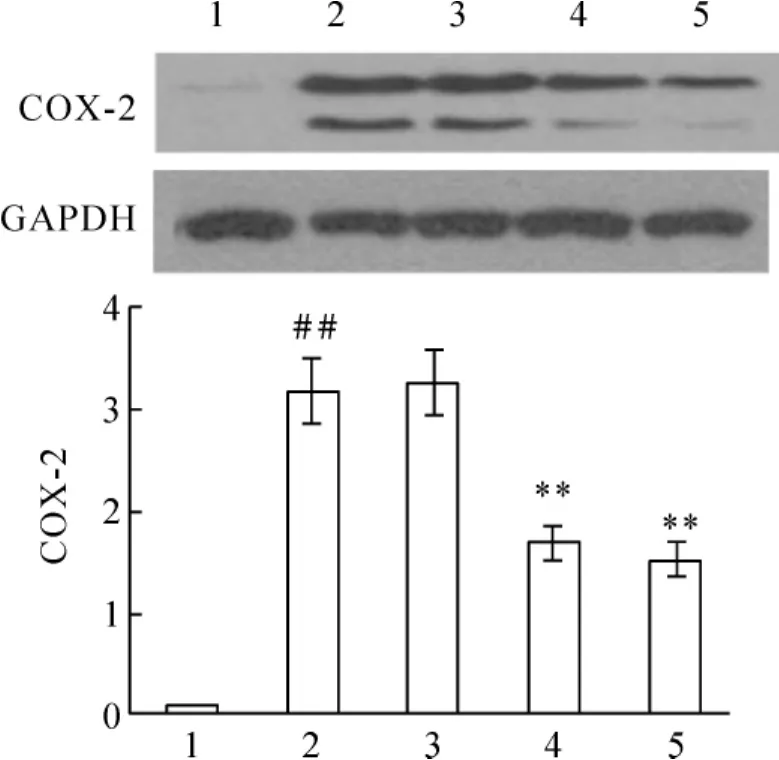
Figure 3.COX-2 and GAPDH protein levels in the infarct border zone of the rat heart in each group.Lane 1:sham;Lane 2:AMI;Lane 3:AMI+TMZ;Lane 4:AMI+parecoxib;Lane 5:AMI+TMZ+parecoxib..n=6.##P <0.01 vs Lane 1;**P <0.01 vs Lane 2.图3 各组大鼠心梗周边区心肌COX-2和GAPDH蛋白含量
各组大鼠心肌组织中Bax、Bcl-2的蛋白表达变化趋势与mRNA表达趋势相似。AMI组与sham组相比,Bax/Bcl-2蛋白表达比例升高(P<0.01);与sham组相比,parecoxib或TMZ单独给药治疗时,Bax/Bcl-2的比例均下降(P<0.05);而 parecoxib和TMZ联合治疗组能显著逆转AMI引起的Bax/Bcl-2表达比例增高(P<0.05),联合给药治疗效果优于单独给药治疗,见图4。
Cleaved caspase-3(CC-3)蛋白在假手术组的大鼠心肌组织中几乎不表达。AMI组与sham组相比,cleaved caspase-3蛋白表达升高(P<0.01);parecoxib治疗组和TMZ治疗组分别与AMI组相比,cleaved caspase-3的蛋白表达均下降(P<0.01);联合给药治疗组与AMI组相比,cleaved caspase-3蛋白表达下降(P<0.01),联合给药治疗组分别与parecoxib治疗组和TMZ治疗组相比,cleaved caspase-3蛋白表达下降(P<0.01)。联合给药治疗抑制caspase-3蛋白表达的效果优于分别单独给药治疗,见图5。
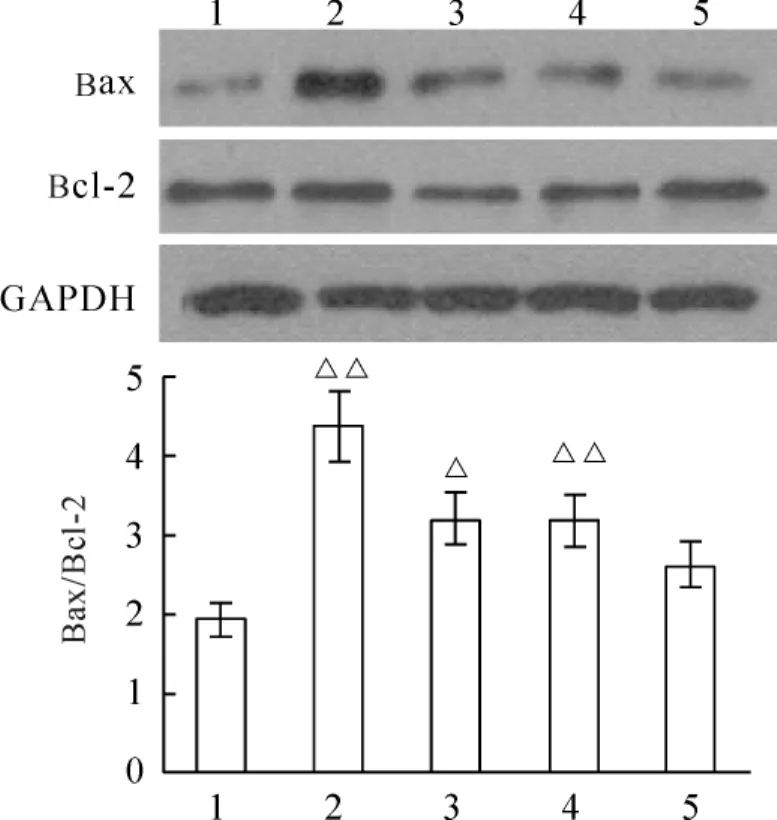
Figure 4.Bax,Bcl-2 and GAPDH protein levels in the infarct border zone of the rat heart in each group.Lane 1:sham;Lane 2:AMI;Lane 3:AMI+TMZ;Lane 4:AMI+parecoxib;Lane 5:AMI+TMZ+parecoxib..n=6.△P <0.05,△△P <0.01 vs Lane 5.图4 各组大鼠心肌Bax、Bcl-2和GAPDH蛋白含量

Figure 5.Cleaved caspase-3(CC-3)and GAPDH protein levels in the infarct border zone of the rat heart in cach group.Lane 1:sham;Lane 2:AMI;Lane 3:AMI+TMZ;Lane 4:AMI+parecoxib;Lane 5:AMI+TMZ+parecoxib..n=6.△△P<0.01 vs Lane 5.图5 各组大鼠心梗周边区心肌cleaced caspase-3(CC-3)和GAPDH蛋白含量
讨 论
本实验利用大鼠模拟人急性心肌梗死模型,通过给予帕瑞昔布钠和曲美他嗪,首次观察到:帕瑞昔布钠与曲美他嗪联合给药具有一定协同保护缺血心肌的作用,具体表现为改善心功能、缩小心肌梗死面积,其机制可能与共同抑制心肌细胞凋亡有关。
关于COX-2在各种病理状态下发挥作用的研究由来已久。在肿瘤组织、脑组织和肾脏组织中均发现有缺血缺氧引起的诱导性COX-2表达持续增高[4-10]。但是关于COX-2在不同状态下发挥的作用则争论较大。在多种肿瘤组织中,抑制COX-2可以促进肿瘤细胞凋亡,发挥抑制肿瘤形成的作用[4]。在缺血引起的脑组织损伤模型中,给予选择性COX-2抑制剂或者敲除(knockout)COX-2基因,这种损伤作用会明显减轻[6]。而在心肌组织中,Mobert等[7]在豚鼠缺血再灌注模型中使用COX-2抑制剂,心肌细胞结构和功能方面的损伤均加重。但是更多的研究结果显示,诱导性COX-2的表达增高对缺血心肌中发挥了不利的作用,抑制COX-2能有效地保护心肌[8-11]。
在我们的实验中,大鼠冠脉左前降支结扎后,出现了心脏左前壁梗死,反映心肌收缩功能的LVSP、+dp/dtmax和反映舒张功能的 LVEDP、-dp/dtmax均显著下降,以及出现明显的心肌细胞凋亡。而且,AMI组与sham组相比,心肌中COX-2蛋白表达显著增高(P<0.01),说明 AMI能够诱导心肌细胞COX-2表达。帕瑞昔布钠治疗1周后,与AMI组相比,在降低COX-2蛋白表达的同时,心肌收缩功能(LVSP和+dp/dtmax)明显恢复(P<0.05),心肌细胞DNA ladder条带化程度显著减弱,只是心肌梗死面积变化不明显。由此我们推测,在大鼠急性心肌缺血早期,诱导产生的COX-2参与了心肌损伤的过程,发挥了加重损伤的作用,抑制COX-2能产生一定的心肌保护作用。
曲美他嗪是一种细胞保护剂,是目前唯一经临床多中心研究证实有抗心绞痛作用的代谢药物[2]。它能够在不引起血流动力学改变或血管舒缩的前提下,在细胞水平发挥抗缺血的作用,主要表现为维持线粒体功能、增加ATP合成和对抗氧自由基损伤的作用[12]。我们的实验发现,AMI大鼠接受曲美他嗪治疗1周后,心肌的收缩功能、舒张功能、梗死面积和细胞凋亡率都有好转趋势,且差异均显著(P<0.05)。
帕瑞昔布钠和曲美他嗪联合给药1周后,心肌梗死大鼠的心肌收缩功能(LVSP和+dp/dtmax)显著增强(P<0.05),且联合治疗效果优于单独治疗(P<0.05)。值得一提的是,帕瑞昔布钠无法逆转心肌的梗死面积,联合给药治疗后梗死面积显著减小,且效果优于曲美他嗪单独给药治疗(P<0.05);帕瑞昔布钠不能明显改善心肌舒张功能,联合给药治疗后也显著改善(P<0.05)。由此我们推测,帕瑞昔布钠与曲美他嗪联合治疗在心肌缺血急性期具有一定的协同保护缺血心肌的作用。
在我们的实验中,心肌梗死大鼠的心肌细胞发生了明显的凋亡,同时,死亡受体通路中的caspase-3活化程度显著增高(P<0.01),活化态的caspase-3(cleaved caspase-3,CC-3)蛋白表达也显著升高(P<0.01);线粒体信号通路中Bax/Bcl-2 mRNA和蛋白表达比例也增高(P<0.01)。联合给药治疗1周后,细胞凋亡被明显抑制,与此同时,caspase-3的活性程度明显降低(P<0.05),CC-3蛋白表达下降(P<0.01),Bax/Bcl-2 mRNA和蛋白表达比例均下降(P<0.05),且联合治疗效果优于单独给药治疗。由此可知,曲美他嗪和帕瑞昔布钠联合治疗在死亡受体通路和线粒体通路引发的细胞凋亡中,均具有一定的协同抑制细胞凋亡作用。这可能是联合给药治疗发挥心肌保护作用的机制之一。但是COX-2抑制剂以及联合曲美他嗪保护心肌组织的具体机制,尚需更多的实验加以探明,在此提出一些可能的建议:(1)诸多实验证实,COX-2能通过改变心肌细胞内的钙循环,改变心肌组织的变力状态(inotropic state),进而改变心肌细胞的结构和功能[13];(2)前列腺素(prostaglandins,PGs)的生成和释放能够引起炎性因子和生长因子的表达增高,抑制COX-2可以抑制PGs的生成,并最终减轻炎症渗出和损伤[14];(3)COX-2介导的氧化损伤已经被证实对心肌组织的功能和结构有十分不利的影响[15]。
综上所述,我们证实曲美他嗪和帕瑞昔布钠联合治疗对急性心肌梗死大鼠的心脏具有一定的协同保护作用。这对研究选择性COX-2抑制剂在急性心肌缺血性疾病的作用,具有十分重要的意义,为缺血性心肌病的治疗提供了新的思路。
[1]Abbate A,Santini D,Biondi-Zoccai GG,et al.Cyclooxygenase-2(COX-2)expression at the site of recent myocardial infarction:friend or foe?[J].Heart,2004,90(4):440-443.
[2]Fox K,Ardissino D,Buszman P,et al.Guidelines on the management of stable angina pectoris:executive summary[J].Eur Heart J,2006,27(11):1341 -1381.
[3]梁文武,尹瑞兴,刘唐威,等.曲美他嗪对新西兰白兔缺血/再灌注心肌细胞凋亡的影响[J].广西医学,2006,28(4):481 -484.
[4]Masferrer JL,Leahy KM,Koki AT,et al.Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors[J].Cancer Res,2000,60(5):1306 -1315.
[5]卢喜烈.ST段抬高的临床意义[J].临床心电学杂志,2005,14(3):164 -165.
[6]Takadera T,Yumoto H,Tozuka Y,et al.Prostaglandin E2induces caspase-dependent apoptosis in rat cortical cells[J].Neurosci Lett,2002,317(2):61 -64.
[7]Jacqueline M,Bernhard F.Cyclooxygenase inhibition aggravates ischemia-reperfusion injury in the perfused guinea pig heart:involvement of isoprostanes[J].J Am Coll Cardiol,1998,31(7):1687 -1694.
[8]Antonio A,Fadi N,Salloum,et al.Improvement of cardiac function with parecoxib,A cyclo-oxygenase-2 inhibitor,in a rat model of ischemic heart failure[J].J Cardiovasc Pharmacol,2007,49(6):416 -418.
[9]Fadi NS,Nicholas N,Ignacio M,et al.Parecoxib inhibits apoptosis in acute myocardial infarction due to permanent coronary ligation but not due to ischemia-reperfusion[J].J Cardiovasc Pharmacol,2009,53(6):495 -498.
[10]Shinmura K,Xuan YT,Tang XL,et al.Inducible nitric oxide synthase modulates cyclooxygenase-2 activity in the heart of conscious rabbits during the late phase of ischemic preconditioning[J].Circ Res,2002,90(5):602 -608.
[11]Abbate A,Limana F,Capogrossi MC,et al.Cyclooxygenase-2(COX-2)inhibition reduces apoptosis in acute myocardial infarction[J].Apoptosis,2006,11(6):1061 -1063.
[12]Morin D,Elimadi A,Sapena R,et al.Evidence for the existence of[3H]-trimetazidine binding sites involved in the regulation of the mitochondrial permeability transition pore[J].Br J Pharmacol,1998,123(7):1385 - 1394.
[13]Damron DS,Summers BA.Arachidonic acid enhances contraction and intracellular Ca2+transients in individual rat ventricular myocytes[J].Am J Physiol,1997,272(1 Pt 2):H350-H359.
[14]Seibert K,Zhang Y,Leahy K,et al.Pharmacological and biochemical demonstration of the role of cyclooxygenase 2 in inflammation and pain[J].Pro Natl Acad Sci USA,1994,91(25):12013-12017.
[15]Agha AM,ElKhatib AS,AlZuhair H.Modulation of oxidant status by meloxicam in experimentally induced arthritis[J].Pharmacol Res,1999,40(4):385 -392.
