寒冷刺激致小鼠上呼吸道黏膜免疫功能低下模型的研究*
2011-08-02段小花吴盛友李秀芳
李 娴, 雷 娜, 段小花, 吴盛友, 李秀芳, 林 青
(云南中医学院药理教研室,云南 昆明 650500)
流行病学研究提示,急性上呼吸道感染(acute upper respiratory infections,AURI)在一年四季均有发生,但冬季较为多发,究其原因,一方面,机体受到寒冷刺激,致使呼吸道毛细血管阻力增高,渗透性降低,分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)明显减少[1],溶菌酶的活力降低;另一方面,由于冬季干燥,鼻黏膜容易发生细小的破裂,易导致细菌、病毒等入侵[2]。
黏膜免疫系统分布于人体的呼吸道、消化道等处,是机体防止细菌、病毒等病原微生物进入人体的第一道防线,研究显示[3],呼吸道黏膜免疫功能低下与AURI反复发作有关。发生AURI时,在病原微生物的刺激下,激活局部黏膜免疫应答,促使SIgA的合成与分泌增加,SIgA可通过中和病毒,以及抑制病原体与黏膜上皮细胞的接触,同时可与溶菌酶、补体共同作用,引起细菌溶解[4],从而发挥上呼吸道黏膜的保护作用。呼吸道局部SIgA含量及溶菌酶的活力降低是AURI发生的重要条件,并可导致上呼吸道感染迁延不愈,进一步发展为支气管炎、肺炎乃至更严重的全身感染[5]。当气温下降时,鼻腔局部温度降低到32℃左右,适合细菌和病毒的繁衍生长,也为病原体入侵提供了有利条件[6],当这些细菌、病毒感染上呼吸道后,人体产生的免疫力较弱且短暂[7],反复上呼吸道感染患者的细胞免疫功能受损,如果不加干预,其免疫功能会因反复感染进一步下降[8],逐步导致AURI及其它并发症的发生。由此可见,寒冷刺激与上呼吸道黏膜免疫功能低下的发生密切相关。而关于复制上呼吸道黏膜免疫功能低下模型的方法,就作者所查文献,未见相关报道。因此,建立黏膜免疫低下模型具有重要的理论和现实意义,于是,我们展开了相关研究。
材料和方法
1 材料
1.1 动物 昆明种健康小鼠,雌雄各半,清洁级,体重18-22 g,由四川省医学科学院实验动物研究所提供,合格证号为SCXK(川)2004-16,批号为 Dossy2010-05。
1.2 药品与试剂 硝酸毛果芸香碱注射液,规格:1 mL∶2 mg,批号为1002081(天津金耀氨基酸有限公司);小鼠分泌型免疫球蛋白A(SIgA)ELISA试剂盒,规格:96 T,批号为QRCT-3013321021102EIAUTL(ADL公司);溶菌酶测试盒,规格:30 T,批号为20100526(南京建成生物工程研究所)。
1.3 仪器 紫外分光光度计UV-2550(日本岛津公司);DNM-9602G酶标分析仪(北京普朗新技术有限公司)。
2 方法
2.1 观察小鼠置于-20℃寒冷环境中不同时段的生存状况及唾液分泌情况 按参考文献[9,10],将小鼠随机分为5组,即对照组、模型1组和模型2组、模型3组和模型4组,每组10只,雌雄各半。除对照组外,将其余4组小鼠分别放入-20℃寒冷环境中5 min(模型1组)、10 min(模型2组)、15 min(模型3组)和20 min(模型4组),观察小鼠生存状况及小鼠唾液分泌情况。
2.2 观察小鼠置于-20℃寒冷环境中不同时段唾液中SIgA含量及溶菌酶活性的变化 将小鼠随机分为4组,即对照组、模型1组、模型2组和模型3组,每组10只,雌雄各半。除对照组外,将模型1-3组小鼠分别放入-20℃寒冷环境中5 min(模型1组)、10 min(模型2组)和15 min(模型3组),寒冷刺激后在室温下适应60 min,每只腹腔注射0.1%毛果芸香碱注射液,2 min后用移液枪取小鼠唾液于Eppendorf管中,-40℃保存。采用双抗体夹心法测定小鼠唾液中SIgA含量,并采用自身对照法测定溶菌酶活性。
3 统计学处理
结 果
1 小鼠置于-20℃寒冷环境中不同时段的生存状况及唾液分泌情况
实验结果显示,模型4组中有50%的小鼠出现死亡,其余小鼠蜷缩颤抖,状态不佳,唾液分泌量较少,无法满足后期唾液中SIgA和溶菌酶活性检测的需要,故不宜作为研究模型使用。模型1组小鼠出现蜷缩,偶尔小范围爬动;模型2组小鼠蜷缩,出现扎堆现象,较少有爬动;模型3组小鼠蜷缩颤抖、扎堆,无爬动。由于模型3组的寒冷刺激时间较长,小鼠受凉较久,唾液分泌量恢复至正常较慢,故将其置于室温中,收集并测定 15 min、30 min、45 min、60 min 小鼠唾液分泌量,而其它各组受凉时间较该组短,因此以该组恢复时间为准。结果表明60 min时模型小鼠唾液开始正常分泌,与对照组比较无显著差异,较易取得实验用唾液,因此以模型3组小鼠置于室温中60 min时作为唾液收集最佳时间,见表1。
表1 寒冷刺激后模型3组小鼠在室温中各时段的唾液分泌情况Table 1.The content of saliva secretion of mice of different room-temperature periods in the third model group after 15 min cold stimulation(.n=10)

表1 寒冷刺激后模型3组小鼠在室温中各时段的唾液分泌情况Table 1.The content of saliva secretion of mice of different room-temperature periods in the third model group after 15 min cold stimulation(.n=10)
▲▲P <0.01 vs control group.
)Control - 203.33 ±31.41 Model 3 15 73.33 ±17.51▲▲30 105.00 ±18.71▲▲45 141.67 ±14.72▲▲60 198.33 ±23.17
2 小鼠置于-20℃寒冷环境中不同时段唾液中SIgA含量及溶菌酶活性的情况
结果显示,模型3组小鼠与对照组比较,SIgA含量较低(P<0.05),溶菌酶活性也显著低于对照组(P <0.01),差异显著;模型2组溶菌酶活性低于对照组(P<0.05),而SIgA含量与对照组比较,有降低趋势而无显著差异(P>0.05);模型1组各项指标与对照组比较,均无显著差异(P>0.05)。以上结果提示,对小鼠进行15 min的-20℃寒冷刺激能降低小鼠唾液中SIgA含量及溶菌酶活性,见表2。
表2 寒冷刺激对小鼠唾液中SIgA含量和溶菌酶的影响Table 2.Effect of cold stimulation on SIgA content and lysozyme activity in saliva of mice(.n=10)
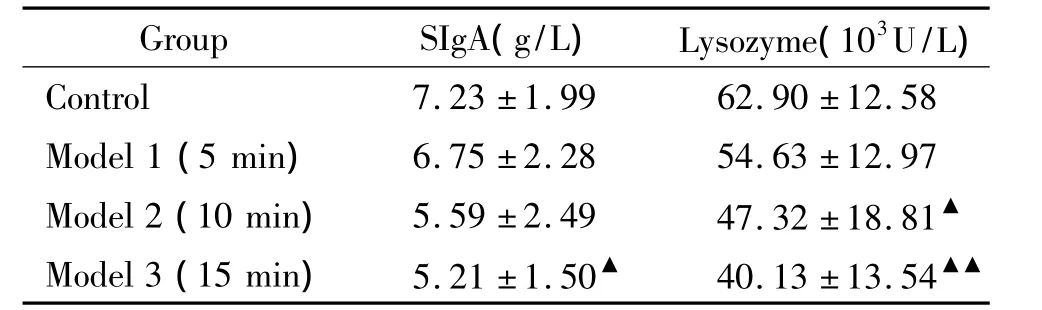
表2 寒冷刺激对小鼠唾液中SIgA含量和溶菌酶的影响Table 2.Effect of cold stimulation on SIgA content and lysozyme activity in saliva of mice(.n=10)
▲P <0.05,▲▲P <0.01 vs control group.
Group SIgA(g/L) Lysozyme(103U/L)Control 7.23 ±1.99 62.90 ±12.58 Model 1(5 min) 6.75 ±2.28 54.63 ±12.97 Model 2(10 min) 5.59 ±2.49 47.32 ±18.81▲Model 3(15 min) 5.21 ±1.50▲ 40.13 ±13.54▲▲
讨 论
AURI是指各种病原引起的上呼吸道急性炎症,临床主要包括普通感冒、流行性感冒、病毒性咽炎、喉炎、支气管炎、疱疹性咽峡炎、细菌性咽-扁桃体炎等疾病,典型症状为发热、鼻塞、咽喉肿痛[1]。老年人、小儿、先天体弱者和病后体虚者等免疫力低下人群,患AURI的几率较正常人大,且病情反反复复,不易痊愈。世界卫生组织已证实,免疫力低下是反复罹患AURI的根本原因[11],而目前的治疗措施尚难于从根本上治疗AURI。以流行性感冒(简称流感)为例,是目前人类还不能有效控制的世界性传染病,而决定流感流行的基本因素是流感病毒抗原变异与人群免疫状态。近年来的研究表明,流感病毒的表面抗原不断发生变异,所以在世界各地都有不同程度的暴发和流行[12]。呼吸道为开放性器官,与包括过敏原和生物毒素在内的外界环境保持连续不断的接触,而如今大气污染严重,大气中有害物质的浓度日益升高,因此对呼吸道黏膜的危害也越来越大,甚至导致黏膜上皮纤毛脱落和纤毛清除功能下降[13],从而使上呼吸道局部黏膜免疫功能降低,以至人体免疫力下降,使很多人处于亚健康状态[14]。2003年初发生的非典型肺炎以及近年来的甲型流感,其蔓延速度和较高的感染率、死亡率重新引起人们对呼吸道感染疾病的高度重视。目前,临床上治疗AURI大多从解除症状着手,普遍采用退热、消炎等手段,以使用抗生素和解热镇痛药对症处理为主,未能从根本解决问题。如能通过增强机体黏膜免疫力,从而增强机体自身的抗病能力,是防治AURI的有效途径之一。因此从黏膜免疫研究出发,展开对AURI的防治和药物研究无疑具有重要的理论价值及临床意义。
SIgA是黏膜免疫系统的主要效应分子,在呼吸道黏膜局部免疫中起重要防御作用,有效地防止呼吸道疾病的发生。Hewson-Bower等[15]研究发现呼吸道黏膜中较低的SIgA浓度会增加机体对AURI的易感性,高浓度的SIgA水平与上呼吸道抗感染能力直接相关。而溶菌酶为体液中的非特异性杀菌物质,由成熟的单核细胞和中性粒细胞释放,在多种组织、黏膜分泌液中都含有溶菌酶,测定它在体液或分泌物中的活性可作为了解机体防御功能的一个重要指标[16]。因此,该研究选用唾液中的SIgA含量及溶菌酶活性作为反映动物呼吸道黏膜免疫功能的关键性指标进行相关研究。
该研究根据人体受凉后会引起局部黏膜免疫下降的事实及易发生AURI的现象,选择-20℃作为寒冷刺激的温度,探讨建立了动物寒冷刺激后呼吸道黏膜免疫功能低下模型。结果显示,小鼠置于-20℃寒冷环境中刺激20 min会引起大量动物死亡,可能是由于寒冷刺激时间过长,导致动物冻死,因此放弃该时间段。小鼠置于-20℃寒冷环境中刺激15 min,能使小鼠唾液中SIgA含量和溶菌酶活性明显低于空白对照组小鼠,成功建立寒冷刺激致黏膜免疫功能低下小鼠模型。在该研究中还发现,寒冷刺激后小鼠应进行60 min室温恢复,期间自由饮水,才能使模型小鼠的唾液分泌状况与正常组小鼠无显著差异,为取唾液的最佳状态。
该研究所建立的寒冷刺激致黏膜免疫功能低下小鼠模型,造价低廉,造模时间短,成功率高,可满足一般呼吸道黏膜免疫低下药物药效学研究需要,值得在相关研究中推广。
[1]钱桂生.急性上呼吸道感染[J].高校保健医学研究与实践,2005,2(1):4 -5.
[2]Davis SS.Nasal vaccines[J].Adv Drug Deliv Rev,2001,51(1-3):21-42.
[3]曾常茜.分泌型IgA在黏膜抗感染中的作用[J].北华大学学报(自然科学版),2005,6(1):33 -35.
[4]邱全瑛,关洪全.医学免疫学与病原生物学[M].第1版.北京:科学出版社,2005.182 -184.
[5]龚非力.医学免疫学[M].第2版.北京:科学出版社,2004.33 -34.
[6]夏廉博.医疗气象学:天气、气候对健康的影响[M].第1 版.北京:知识出版社,1984.32 -34.
[7]常 静,张 颖,毛 兵,等.柴葛清热颗粒治疗急性上呼吸道感染风热证的双盲随机对照临床试验[J].中西医结合学报,2007,5(2):141 -146.
[8]仝战旗,钱 妍,林明雄,等.“防感1号”预防老年人反复上呼吸道感染的临床研究[J].中华医院感染学杂志,2006,16(9):1004 -1006.
[9]邵 黎,朱晓松,孙长伟,等.小鼠耗竭性游泳及寒冷对应激免疫抑制蛋白的不同作用[J].北京医科大学学报,1997,29(4):323 -325.
[10]Bing C,Frankish HM,Pickavance L,et al.Hyperphagia in cold-exposed rats is accompanied by decreased plasma leptin but unchanged hypothalamic NPY[J].Am J Physiol,1998,274(1 Pt 2):R62 - R68.
[11]张 莹,于长水.抵御反复感冒增强免疫是关键[J].开卷有益(求医问药),2005,(12):33.
[12]张忠华.自然人群中流感抗体水平调查及抗原变异分析[J].中华临床医学,2009,19(11):58 -59.
[13]张劲农.呼吸道黏膜防御机制与慢性阻塞性肺部疾病[J].华中医学杂志,2006,30(5):375 -377.
[14]赵益业,林燕钊,赵彩琼,等.亚健康状态的神经内分泌机制及中医养生学防治[J].江苏中医药,2008,40(10):9-11.
[15]Hewson-Bower B,Drummond PD.Secretory immunoglobulin a increases during relaxation in children with and without recurrent upper respiratory tract infections[J].J Dev Behav Pediatr,1996,17(5):311 -316.
[16]韩剑星,李 瑛.唾液溶菌酶与口腔常见病关系的研究进展[J].国际口腔医学杂志,2006,33(4):284 -285.
