人肺组织体外感染模型的建立及NTHi诱导炎症反应的机制研究*
2011-08-02夏靖燕程玉生王选锭
刁 然, 夏靖燕, 徐 峰△, 程玉生, 杨 燕, 王选锭
(浙江大学医学院附属二院1呼吸科,2肿瘤放疗科3感染管理科,浙江 杭州 310009)
大量研究证实不可分型流感嗜血杆菌(nontypeable Haemophilus influenzae,NTHi)是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)急性加重最重要的病原体[1]。肺部感染 NTHi后,导致中性粒细胞、巨噬细胞等炎性细胞在气道和肺实质的聚集和炎症细胞因子释放,造成肺实质损伤,甚至引起组织的破坏和重构,从而促进COPD的发生发展。因此研究NTHi所诱导的炎症反应过程对COPD的防治具有重要意义。目前有关NTHi分子发病机制研究多采用小鼠模型或体外细胞模型。建立人肺组织体外感染模型来研究细菌与肺组织互相作用的细胞和分子机制,将更能反映人体内的真实情况。本研究将利用人NTHi肺组织体外急性感染模型(acute NTHi infection model,AHIM)来阐明 Toll样受体2(Toll-like receptor 2,TLR2)-p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)- 核因子 κB(nuclear factor κB,NF - κB)信号通路在介导细菌炎症反应中的作用。
材料和方法
1 主要材料
NTHi为浙江大学医学院附属第二医院检验中心的临床分离株[1];羟乙基哌嗪乙磺酸-谷氨酸介导的具有保护作用的有机溶剂(HEPES-glutamic acid buffer- mediated organic solvent protection effect,HOPE)为德国Borstel研究中心赠送;RPMI-1640为Gibco产品;TLR2单抗购自Imgenex;GAPDH抗体购自eBioscience;SB203580(p38 MAPK抑制剂)购自Calbiochem;PDTC(NF-κB抑制剂)购自Sigma;电泳迁移率检测(EMSA)试剂盒购自Pierce;酶联免疫吸附(ELISA)试剂盒购自R&D。
2 体外肺组织NTHi感染模型
从5例因肺部孤立肿块而接受胸科手术的成年患者的手术标本中切取距肿块5 cm外的正常肺组织。肺组织块大小约1 cm×1 cm×1 cm。置于24孔组织培养板中培养。每块肺组织加入800 μL的RPMI-1640培养液。肺组织块与1010CFU/L的NTHi置37℃、5%CO2培养箱共孵育4 h和24 h后,组织块置于HOPE溶液中4℃固定48 h。
3 实时定量RT-PCR检测TLR2 mRNA
检测肺组织TLR2 mRNA的表达,取肺组织约50 mg,加入1 mL Trizol后置于组织匀浆器中碾成匀浆。匀浆移入无RNase的Eppendorff管。参照RNA抽提试剂盒说明操作。取RNA 2 μg,加oligo dT、逆转录酶等逆转录为cDNA。PCR扩增TLR2和18S rRNA mRNA。TLR2引物序列:正义链5'-CCATTCCCCAGCGCTTT-3';反义链5'-CCGCTGAGCCTCGTCCAT-3';18SrRNA引物序列:正义链5'-TCAAGAACGAAAGTCGGAGG-3';反义链5'-GGACATCTAAGGGCATCACA -3'[2]。计算 2 组标本间TLR2基因表达的相对差异:AHIM组/Medium组=2- ΔΔCp;ΔΔCp=(CpTLR2-AHIM- Cp18SrRNA-AHIM)-(CpTLR2-Medium-Cp18S rRNA-Medium)。
4 Western blotting检测AHIM中磷酸化p38 MAPK的表达
取30 μg组织蛋白,经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电转至硝酸纤维膜,脱脂奶粉封闭。Ⅰ抗为小鼠抗人TLR2抗体(1∶1500)或兔抗人磷酸化p38 MAPK抗体(1∶1000),Ⅱ抗为辣根过氧化物酶标记的羊抗鼠IgG(1∶4000)或羊抗兔IgG(1∶4000),增强化学发光法显色。分别以GAPDH或p38 MAPK表达量作内参照。
5 电泳迁移率检测(EMSA)检测NF-κB
严格按EMSA检测试剂盒操作。取组织核蛋白5 μg上样,NF-κB 的探针序列为:5'-AGTTGAGGGGACTTTCCCAGGC-3',结合反应检测体系为:10 × binding buffer 2 μL,1 g/L poly(dI·dC)1 μL,50%glycerol 1 μL,NP -401 μL,100 mmol/L MgCl21 μL,biotin end - labeled target DNA 2 μL,ddH2O补足20 μL。非变性聚丙烯酰胺凝胶中100 V电泳80 min,100 V转膜60 min,70℃固定1 h。化学发光法检测生物素标记DNA。
6 AHIM炎症反应的调控研究
肺组织(1 cm×1 cm×1 cm)预先与抗TLR单抗(anti- TLR2∶5 mg/L)、MAPK 抑制剂(SB203580:20 μmol/L)或 NF - κB 抑制剂(PDTC:25 μmol/L)孵育2 h。然后加NTHi(1010CFU/L)刺激24 h,收集组织上清,置于-20℃,待测ELISA。
7 酶联免疫吸附试验(ELISA)检测IL-8
采用双抗夹心ELISA法测定,操作步骤见R&D公司说明。IL-8测定灵敏度为31.2 ng/L。
8 统计学处理
采用SPSS 11.5统计软件处理,数据以均数±标准差()表示,行配对t检验或单因素方差分析(One-way ANOVA)。
结 果
1 AHIM中TLR2的表达
肺组织感染NTHi 4 h和24 h后,TLR2 mRNA和蛋白表达都明显上调,见图1。
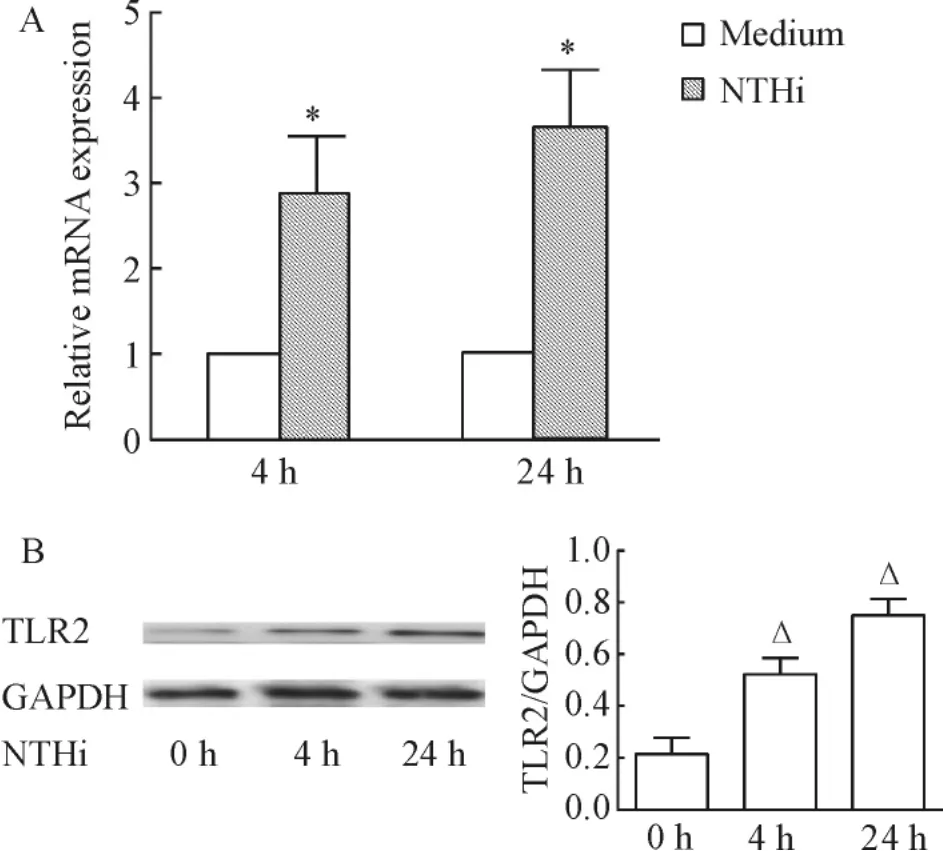
Figure 1.Enhanced expression of TLR2 mRNA(A)and protein(B)was found in lung tissues infected with NTHi 4 h and 24 h after stimulation..n=3-5.*P<0.05 vs medium group;△P <0.05 vs 0 h.图1 NTHi刺激4 h和24 h后,肺组织TLR2表达明显增加
2 AHIM中磷酸化p38 MAPK蛋白的表达
Western blotting检测发现,NTHi刺激肺组织4 h,AHIM中磷酸化p38 MAPK蛋白表达较刺激前明显增强,见图2。
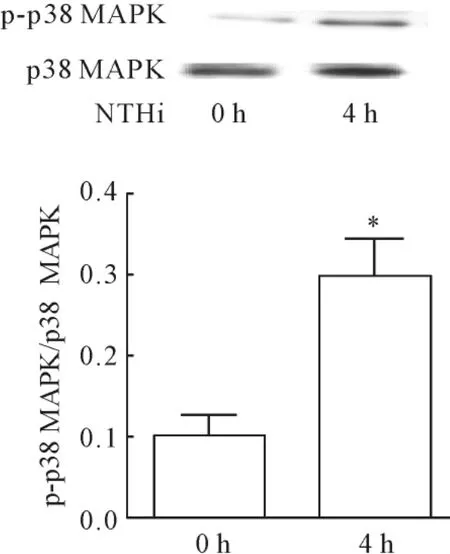
Figure 2.Elevated level of phosphorylation of p38 MAPK was detected in lung tissues infected with NTHi 4 h after stimulation..n=3.*P<0.05 vs 0 h.图2 NTHi刺激4 h后AHIM中磷酸化p38 MAPK表达
3 NTHi刺激后AHIM 的NF-κB活性检测
EMSA检测发现,NTHi刺激4 h,AHIM中NF-κB的DNA结合能力较对照组明显增强,见图3。
4 AHIM上清中的炎症因子测定
组织上清 IL-8检测显示,TLR2单抗、p38 MAPK和NF-κB抑制剂能显著降低NTHi所诱导的肺组织炎症反应,见图4。结果提示:NTHi通过TLR2-p38MAPK-NF-κB通路来诱导炎症反应。

Figure 3.NF-κB activation was detected by EMSA in lung tissues infected with NTHi 4 h after stimulation.Lane 1:control;Lane 2:NTHi stimulation.图3 NTHi刺激4 h后EMSA法检测AHIM中NF-κB的活性
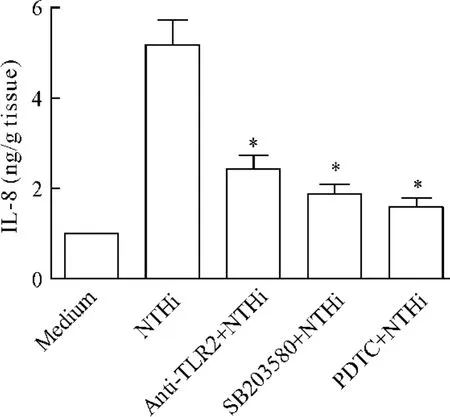
Figure 4.Effects of anti-TLR2,p38 MAPK and NF - κB inhibitors on NTHi-induced IL-8 production in lung tissues..n=5.*P<0.05 vs NTHi group.图4 TLR2单抗、p38 MAPK和NF-κB抑制剂对NTHi诱导IL-8生成的影响
讨 论
我们从因肺部孤立结节或肿块而接受肺叶或全肺切除的手术标本中切取肿块远处的正常肺组织块,体外与NTHi共孵育,建立AHIM。该模型可作为连接人体细胞和整体动物模型的桥梁,为在组织水平研究肺部疾病的病理生理变化提供一个功能平台。利用AHIM和HOPE技术便于开展肺部感染性疾病发生早期不同横断面的组织、分子病理学研究[3,4]。并且AHIM模型较小鼠模型和体外细胞模型更接近机体内的真实情况。
近年来,利用小鼠基因敲除模型,TLR2受体被证实是NTHi的重要识别受体[1]。通过体外细胞感染实验,研究者也发现:NTHi感染可激活上皮细胞多条信号通路,启动靶基因表达,参与NTHi发病[5]。既往研究中,NF-κB和p38 MAPK被证实为介导NTHi诱发免疫反应的重要信号分子[1]。有研究表明:阻断p38 MAPK通路并不影响NF-κB/RelA的核转位和向IL-8基因启动子的聚集,但降低了IL-8启动子处的p65/RelA的磷酸化水平,同时抑制了细菌诱导的RNA聚合酶Ⅱ向IL-8启动子的募集[6]。这些结果显示:p38 MAPK可以通过调节NF-κB p65介导的转录活化,从而影响炎症因子表达。
利用AHIM模型,我们发现NTHi感染后,肺组织TLR2-p38 MAPK-NF-κB信号通路迅速被激活。用抗TLR2抗体或特异性MAPK和NF-κB分子阻断剂可以显著抑制NTHi所诱导的炎症反应。我们的研究在组织水平阐明NTHi主要通过TLR-2-p38 MAPK-NF-κB信号通路来诱导肺组织分泌炎症因子。同时我们的工作再次证实,HOPE固定技术对肺组织的核酸和蛋白有很好的保护作用[4]。
AHIM结合HOPE固定技术,为研究病原菌与机体组织的相互作用提供了很好的研究平台。进一步深入了解NTHi促炎症反应的细胞和分子机制,有助于新的分子靶向性药物的研发。
[1]Xu F,Xu Z,Zhang R,et al.Nontypeable Haemophilus influenzae induces COX-2 and PGE2expression in lung epithelial cells via activation of p38 MAPK and NF-κB[J].Respir Res,2008,9:16.
[2]Xu F,Droemann D,Rupp J,et al.Mo-dulation of the inflammatory response to Streptococcus pneumoniae in a model of acute human lung tissue infection[J].Am J Respir Cell Mol Biol,2008,39(5):522 -529.
[3]Olert J,Wiedorn KH,Goldmann T,el al.HOPE fixation:a novel fixing method and paraffin-embedding technique for human soft tissues [J].Pathot Res Pracl,2001,197(12):823-826.
[4]夏靖燕,徐 峰,傅燕飚.介绍一种新的肺组织体外固定液[J].中华病理学杂志,2008,37(11):787-788.
[5]Li JD.Exploitation of host epithelial signaling networks by respiratory bacterialpathogens [J]. J Pharmacol Sci,2003,91(1):1-7.
[6]Schmeck B,Zahlten J,Moog K,et al.Streptococcus pneumonia-induced p38 MAPK-dependent phosphorylation of RelA at the interleukin-8 promotor[J].J Biol Chem,2004,279(51):53241-53247.
