可溶性TGFβRⅡ对大鼠心肌梗死后心功能的影响*
2011-08-02张玲玲刘增长殷跃辉
张玲玲, 刘增长, 苏 立, 殷跃辉
(重庆医科大学附属第二医院心血管内科,重庆 400010)
心肌梗死(myocardial infarction,MI)是危害人类健康的常见心血管疾病之一,MI后常发生心肌纤维化,引起心室重塑,使得心脏收缩和(或)舒张功能受损,并最终导致慢性心力衰竭的发生发展。心肌纤维化不仅发生在梗死区,同时也发生在非梗死区,包含成纤维细胞的增殖和细胞外基质(extracellular martrix,ECM)的沉积,与整个心室腔的扩张、变形及心功能降低密切相关。作为强有力的致纤维化因子之一,转化生长因子β(transforming growth factor-β,TGF-β)在MI后大鼠心脏梗死区和非梗死区的表达明显上调,在心肌纤维化过程中发挥关键作用[1]。lsaka等[2]研究发现,可溶性转化生长因子βⅡ型受体(soluble transforming growth factor-β typeⅡreceptor,sTGFβRⅡ)能竞争性抑制内源性TGF-βRⅡ与TGF-β的结合或是作为负效应受体起作用,减轻实验性肾小球肾炎ECM的聚集,改善肾小球纤维化。然而,有关sTGFβRⅡ能否逆转心肌纤维化的研究国内外鲜有报道。因此,本研究旨在观察重组腺病毒载体pAd-sTGFβRⅡ对TGF-β介导的心肌纤维化的调节,探讨sTGFβRⅡ对大鼠MI后心功能的影响。
材料和方法
1 材料
1.1 动物 清洁级健康雄性SD大鼠50只,体重200-250 g,由重庆医科大学动物中心提供,动物使用许可证号为SYXK(渝)2007-0001。
1.2 主要试剂和仪器 重组腺病毒载体 pAdsTGFβ RⅡ由本课题组前期构建;Trizol试剂、逆转录(PrimeScriptTM)试剂盒(TaKaRa);Pfu PCR Master Mix试剂(北京天根生化科技有限公司);多聚赖氨酸溶液、兔抗鼠基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)多克隆抗体、SP免疫组化检测试剂盒(武汉博士德生物工程有限公司);DAB显色试剂盒(北京中杉生物技术有限公司);明胶(Sigma)。TKR-200小动物呼吸机(江西特力麻醉呼吸设备有限公司);IX-70型偏振光学显微镜(Olympus);752型紫外分光光度仪(上海青华科技仪器公司);Thermo Hybaid Px2型PCR仪(Eppendorf);核酸电泳装置、Gel Doc 100型凝胶成像扫描分析仪(Bio-Rad)。
2 方法
2.1 MI大鼠模型的制备、分组及处理 40只SD大鼠称重后经3.5%水合氯醛溶液(10 mL/kg)腹腔注射麻醉,仰卧固定、备皮、消毒。用针形电极插入四肢皮下连接心电图机,观察记录肢体导联心电图。切开气管并插管,接上小动物呼吸机进行正压通气(潮气量20 mL,机械通气频率80次/min,呼吸比1∶1);在胸骨左缘扪及心脏搏动处纵行切开皮肤约3 cm,逐层钝性分离,于第3、4肋间开胸,暴露心脏,在肺动脉圆锥和左心耳之间于左心耳根部下方2 mm处进针,以6/0无损伤缝线穿过心肌表层,在肺动脉圆锥旁出针结扎左冠状动脉前降支,肉眼观察左心室前壁变苍白,同时在2个及以上肢体导联出现ST段弓背向上抬高0.2 mV以上,说明MI模型已成功建立;迅速将心脏复位,排尽气体,逐层关胸;待大鼠清醒时,拔除气管插管;术毕肌肉注射青霉素4×105U预防感染。术后3 d存活31只,随机分为 MI组(生理盐水 1 mL,n=10)、pAdsTGFβRⅡ组(pAdTrack-TO4- sTGFβRⅡ病毒上清液,1.0×1010pfu 1 mL,n=11)、空载体组(pAdTrack,1.0 ×1010pfu 1 mL,n=10);另设假手术组(仅在左冠脉前降支相同部位穿线并不缝扎,生理盐水1 mL,n=10)。干预方式为术后第4 d下肢肌肉注射,方法同Okada等[3]研究,之后在相同条件下喂养,观察4周。
2.2 超声心动图检测 4周后麻醉大鼠,应用GE Vivid 7彩色多普勒超声诊断仪(探头频率13 MHz,深度3.5 cm,速度200 mm/s)在获得满意的胸骨旁左心室短轴二维图像后,测量心率(heart rate,HR)、左心室舒张末期直径(left ventricular end-diastolic dimension,LVEDD)、左心室收缩末期直径(left ventricular end-systolic dimension,LVESD)和射血分数(ejection fraction,EF),取连续3个心动周期的平均值。
2.3 标本留取 超声心动图检测后,大鼠称重并处死,开胸取心脏,冰生理盐水洗净,滤纸吸干,沿房室沟剔除心房、血管组织,紧贴室间隔右下侧剔除右心室游离壁,余下左心室,沿梗死区中部垂直于长轴的方向切取厚约3-5 mm的心肌组织块放入4%多聚甲醛缓冲液中固定24 h,常规脱水,透明,石蜡包埋,切片备用,切片厚度约5 μm。余下部分经液氮速冻后转-80℃冰箱保存,用于冰冻切片、RT-PCR和明胶酶谱法检测。所有标本制作条件完全相同以避免人工误差。
2.4 冰冻切片检测sTGFβRⅡ基因的表达 取液氮冻存的心肌组织做冰冻切片,在荧光显微镜下观察绿色荧光细胞的数量和密度,检测sTGFβRⅡ基因在心肌组织中的表达情况。
2.5 天狼星红-饱和苦味酸染色观察心肌Ⅰ、Ⅲ型胶原的表达 石蜡切片常规脱蜡入水,双蒸水洗;切片入Harris苏木素染液5 min;自来水洗10 min;盐酸乙醇分色10s,水洗;入天狼星红-饱和苦味酸染液30 min;自来水速洗,蒸馏水洗,滤纸吸干;无水乙醇分化与脱水;二甲苯透明;适量中性树胶封片。偏振光学显微镜下观察心肌Ⅰ、Ⅲ型胶原的染色情况。
2.6 RT-PCR法检测左心室非梗死区 MMP-9 mRNA的表达 (1)RNA提取:按照Trizol试剂说明书提取总RNA,并溶于20 μL DEPC处理水中。(2)RNA纯度及浓度测定:用1 mL蒸馏水将紫外分光光度计校正调零。将1 μL RNA样品与1 mL蒸馏水混匀,转入石英杯中,分别读取A260和A280值,计算RNA样品中的A260/A280,以该比值≥2.0为纯度合格,其样品进入后续实验;按下列公式计算RNA样品浓度:RNA样品浓度(g/L)=A260值×40×稀释倍数×10-3,用无RNA酶纯水将RNA样品浓度调至1 g/L。(3)RT反应:应用TaKaRa逆转录试剂盒按照说明书进行 cDNA第 1链合成。(4)PCR反应:根据PubMed上GenBank提供的基因序列,以β-actin基因为内参照,扩增MMP-9基因(NM 031055.1)的引物序列,上游引物 5'-CCCTGCGTATTTCCATTCATC -3',下游引物 5'- GGCTTGGGTCAGGTTTAGAG-3',PCR产物的大小为500 bp;扩增β-actin(NM 031144.2)的引物序列,上游引物5'-CACCCGCGAGTACAACCTTC -3',下游引物 5'- CCCATACCCACCATCACACC-3',PCR 产物的大小为 250 bp。上述引物由上海生物工程有限公司合成。PCR条件为:94℃预变性3 min;94℃ 30 s,57℃ 30 s,72℃45 s,共35个循环;再72℃ 5 min。(5)PCR产物经1.5%琼脂糖凝胶电泳,用凝胶成像扫描分析仪摄像,结果用Quantity One 4.6.2软件分析后计算MMP-9与β-actin吸光度比值代表其相对表达量。
2.7 免疫组织化学方法检测心肌MMP-9蛋白的表达 采用链霉菌抗生物素蛋白-过氧化物酶(streptavidin peroxidase,SP)法进行免疫组化检测。石蜡切片常规脱蜡水化,微波加热修复抗原20 min,冷却至室温;3%H2O2去离子水室温孵育30 min灭活内源性过氧化物酶,PBS洗涤5 min×3次;每张切片滴加50 μL正常山羊血清封闭液,室温孵育30 min,甩去余液;每张切片滴加50 μL PBS缓冲液稀释的的兔抗鼠MMP-9多克隆Ⅰ抗(1∶50);4℃冰箱过液,37℃复温45 min,PBS洗涤5 min×3次;滴加生物变化Ⅱ抗,37℃孵育30 min,PBS洗涤5 min×3次;滴加链霉素抗生物素-过氧化物酶溶液,37℃ 孵育20 min;DAB显色;苏木精轻度复染;分色、脱水、透明和封片。同时用PBS代替MMP-9Ⅰ抗作阴性对照。免疫组化染色结果用Image-Pro Plus 4.5图像分析软件测量蛋白表达的累积吸光度值(integrated absorbance,IA)和平均吸光度值,其值越大分别代表蛋白表达量越多、强度越高。
2.8 明胶酶谱法检测心肌MMP-9的活性 取液氮冻存的心肌组织0.3 g加入1 mL蛋白提取液匀浆,12000 r/min、4℃离心20 min,取上清分装,用Bradford法蛋白定量;与上样缓冲液以1∶2混合后上样于含1%明胶的8%SDS-聚丙烯酰胺凝胶,加marker后电泳(60 V,30 min;100 V 120 min);电泳结束后将凝胶置于2.5%Triton X-100溶液中室温摇洗2次,每次30 min;然后以漂洗液(50 mmol/L Tris-HCl,5 mmol/L CaCl2,pH 7.6)漂洗2 次,每次20 min,再置于新鲜孵育液(50 mmol/L Tris-HCl,pH 7.5, 10 mmol/L CaCl2, 150 mmol/L NaCl,0.02%NaN3)中37℃孵育24 h;弃去孵育缓冲液,加入0.25%考马斯亮蓝染液染色3 h,用脱色液脱色至背景清晰为止;用Gel Doc 100型凝胶成像扫描分析仪在灰阶模式下扫描,结果用Quantity One 4.6.2软件分析以条带的吸光度值相对定量心肌MMP-9的活性。
3 统计学处理
结 果
1 各组大鼠心脏超声心动图检测结果
MI后4周,与假手术组比较,MI组、空载体组HR、LVEDD和 LVESD均明显升高(P<0.01),EF值明显降低(P<0.01);pAd-sTGFβRⅡ组仅LVEDD升高(P <0.05),HR、LVESD、EF值无显著差异。与MI组比较,pAd-sTGFβRⅡ组HR、LVEDD和LVESD均明显减小(P<0.01),EF值明显增高(P<0.01);空载体组各项指标与MI组比较无显著差异,见表1。
表1 MI后4周各组大鼠超声心动图各项指标的检测结果Table 1.The evaluation of HR,LVEDD,LVESD and EF of the rats in various groups by echocardiograms(.n=10)

表1 MI后4周各组大鼠超声心动图各项指标的检测结果Table 1.The evaluation of HR,LVEDD,LVESD and EF of the rats in various groups by echocardiograms(.n=10)
*P <0.05,**P <0.01 vs sham group;##P <0.01 vs MI group.
Group HR(min-1) LVEDD(mm) LVESD(mm) EF(%)Sham 458.00 ±4.06 4.80 ±0.41 2.89 ±0.31 68.08 ±2.89 MI 473.00 ±10.36** 7.10 ±0.31** 4.86 ±0.43** 37.27 ±3.62**pAd - sTGFβRⅡ 460.77 ±5.76## 5.25 ±0.33*## 3.21 ±0.34## 57.38 ±4.13##Vector 469.58 ±7.12** 7.01 ±0.35** 4.98 ±0.27** 35.54 ±3.52**
2 冰冻切片检测sTGFβRⅡ基因的表达结果
重组腺病毒载体pAd-sTGFβRⅡ含有绿色荧光蛋白基因,假手术组大鼠心肌组织中无绿色荧光蛋白,pAd-sTGFβRⅡ组可见大量的绿色荧光蛋白表达,表明sTGFβRⅡ基因在心肌组织中得到高效表达,见图1。
3 天狼星红-饱和苦味酸染色结果
偏振光学显微镜下观察:Ⅰ型胶原纤维呈红色或黄色,排列紧密,具强双折光性;Ⅲ型胶原纤维呈绿色,细纤维,弱双折光性。与假手术组比较,MI组和空载体组左心室非梗死区Ⅰ型和Ⅲ型胶原均显著增加,其中以Ⅰ型胶原增加更为显著,提示MI晚期胶原网络重塑以Ⅰ型胶原增生为主。MI组与空载体组之间无明显差异。与MI组比较,pAd-sTGFβRⅡ组非梗死区Ⅰ型和Ⅲ型胶原均明显减少,但与假手术组相比其表达仍稍有增加,见图2。

Figure 1.Expression of sTGFβRⅡ gene in myocardial tissues of rats in sham group(A)and pAd-sTGFβRⅡ group(B)(frozen section,×400).图1 心肌组织sTGFβRⅡ基因的表达结果

Figure 2.Content and distribution of collagen typeⅠ andⅢ in the left ventricular non-infarcted zone of rats in sham group(A),MI group(B),pAd-sTGFβRⅡ group(C)and vector group(D)(picrosirius red staining,×400).图2 各组大鼠左心室非梗死区Ⅰ、Ⅲ型胶原的表达
4 MMP-9 mRNA表达的琼脂糖凝胶电泳分析
MI后4周,MMP-9 mRNA相对表达量在假手术组、MI组、pAd-sTGFβRⅡ组和空载体组分别为0.392±0.008、0.526 ±0.021、0.436±0.012 和0.499±0.017。与假手术组比较,其余3组左心室非梗死区MMP-9 mRNA的表达量明显增加(均P<0.01);与 MI组比较,pAd-sTGFβRⅡ组 MMP-9 mRNA的表达量明显减少(P<0.01),见图3。

Figure 3.Expression of MMP-9 mRNA in the left ventricular non-infarcted zone of rats in various groups.A:agarose gel electrophoresis.Lane 1:sham group;Lane 2:MI group;Lane 3:pAd -sTGFβRⅡ group;Lane 4:vector group.B:the relative expression normalized with β-actin..n=10.**P<0.01 vs sham group;##P<0.01 vs MI group.图3 MI 4周后各组大鼠左心室非梗死区MMP-9 mRNA表达量
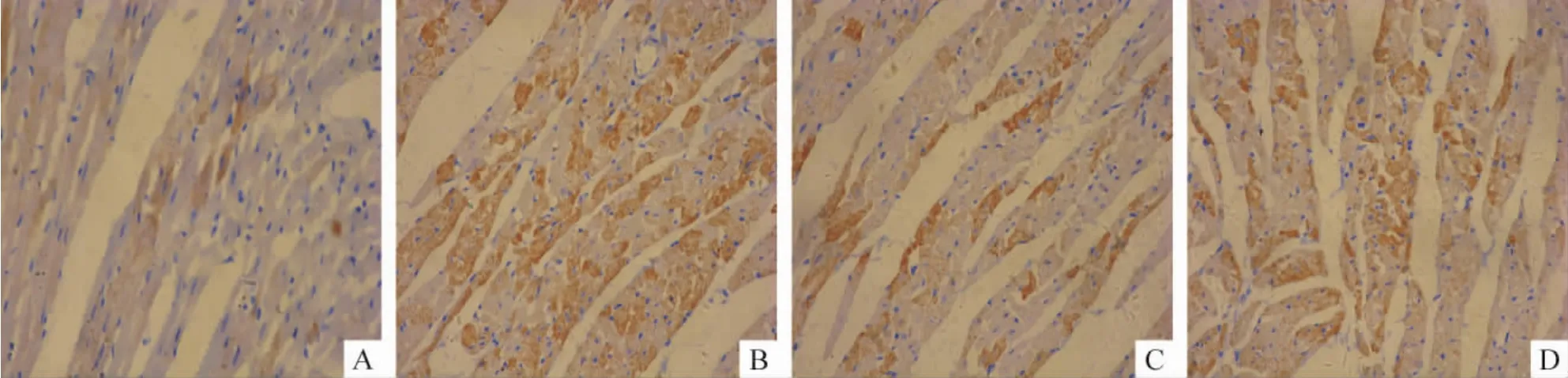
Figure 4.Expression of MMP-9 protein in myocardial tissues of rats in sham group(A),MI group(B),pAd-sTGFβRⅡ group(C)and vector group(D)(immunohistochemical staining,×400).图4 各组大鼠心肌组织MMP-9蛋白表达情况
5 MMP-9蛋白免疫组化染色结果
图4显示,MMP-9阳性染色定位于心肌细胞浆和成纤维细胞浆,呈棕黄色。与假手术组比较,MI组、pAd-sTGFβRⅡ组和空载体组左心室非梗死区MMP-9蛋白表达量增加(均 P<0.01);与MI组比较,pAd-sTGFβRⅡ组 MMP-9蛋白表达水平明显降低(P<0.01),空载体组无明显差异,见图4、表2。
表2 MI 4周后各组大鼠心肌组织MMP-9蛋白表达量的比较Table 2.MMP-9 protein content in myocardial tissues of rats in various groups(.n=10)

表2 MI 4周后各组大鼠心肌组织MMP-9蛋白表达量的比较Table 2.MMP-9 protein content in myocardial tissues of rats in various groups(.n=10)
IA:integrated absorbance.**P <0.01 vs sham group;##P <0.01 vs MI group.
Group IA AverageA Sham 61538.6 ±3269.5 0.0076 ±0.0003 MI 332829.2 ±16883.7** 0.0462 ±0.0023**pAd - sTGFβRⅡ 172623.1 ±15087.4**## 0.0222 ±0.0021**##Vector 312730.3 ±16338.3** 0.0445 ±0.0025**

Figure 5.The activity of MMP -9 in myocardial tissues of rats in various groups.A:gelatin zymography to detect MMP -9 activity.Lane 1:sham group;Lane 2:MI group;Lane 3:pAd-sTGFβRⅡ group;Lane 4:vector group.B:the protein activity was quantified..n=5.**P<0.01 vs sham group;##P<0.01 vs MI group.图5 MI 4周后各组大鼠心肌组织MMP-9的活性
6 心肌MMP-9活性测定结果
图5显示,84 kD处有1条酶条带,为MMP-9的活性形式。MMP-9蛋白表达活性在假手术组、MI组、pAd-sTGFβRⅡ组和空载体组分别为0.35±0.03、1.78±0.08、1.32±0.11和1.83±0.07。与假手术组比较,其余3组左心室心肌MMP-9的活性显著升高(均 P<0.01);与 MI组比较,pAdsTGFβRⅡ组MMP-9的活性显著降低(P<0.01)。
讨 论
心肌纤维化被公认为是MI后心力衰竭发生发展的重要环节。如何减缓或逆转MI后心肌纤维化成为近年来临床和基础研究的热点。近年来研究发现,TGF-β可刺激成纤维细胞增殖,诱导成纤维细胞向肌成纤维细胞分化及ECM大量合成,促进心肌纤维化的发生和发展[4,5]。因此,抑制 TGF- β 介导的生物学效应有可能成为未来预防MI后心力衰竭发生的有效策略。本研究采用携带sTGFβRⅡ基因的重组腺病毒载体pAd-sTGFβRⅡ转染MI大鼠,使其在心肌组织中得到高效表达,与内源性TGFβRⅡ竞争性结合TGF-β,由于不包含胞内激酶区而不能磷酸化,TGF-β信号下传受到抑制,心肌纤维化减轻,心功能得到改善,与Lian等[8]的研究结果相似。
MI后心肌间质胶原重塑是指胶原的形态、结构、生化(包括胶原含量、Ⅰ/Ⅲ型胶原比例、特性、构型、排列等)发生异常改变。有研究发现MI后心肌间质Ⅰ型和Ⅲ型胶原的合成显著增加及Ⅰ/Ⅲ型胶原比例失调,使得心肌僵硬度增加、心脏顺应性降低及心室腔扩大,最终导致心脏舒缩功能不全[9]。本研究观察了MI 4周的大鼠左心室非梗死区胶原重塑方面的改变,发现MI组与空载体组Ⅰ、Ⅲ型胶原含量和Ⅰ/Ⅲ型胶原比例较假手术组均明显增加,表明MI后心肌成纤维细胞合成和分泌胶原蛋白增加,胶原类型比例改变及心肌胶原网络重塑以Ⅰ型胶原增生为主;而pAd-sTGFβRⅡ组低于MI组,表明抑制TGF-β信号能减少左心室非梗死区Ⅰ、Ⅲ型胶原含量,同时还能改善胶原类型比例,逆转胶原重塑,与Ellmers等[10]研究结果一致。另外,本研究发现MI组与空载体组HR、LVEDD和LVESD较假手术组均明显升高,EF值显著降低,提示MI后心功能明显下降可能与胶原沉积尤其是Ⅰ型胶原增加显著使心室壁顺应性下降有关;而pAd-sTGFβRⅡ组上述改变明显减轻,表明sTGFβRⅡ干预使MI后左心室功能得到改善。
基质金属蛋白酶是降解ECM的最主要酶系,其表达量和活性升高将使胶原蛋白纤维化反应性增加,相反MMP的表达量和活性降低将改善心肌纤维化[11]。MMP-9可降解明胶和正常的胶原蛋白,使心肌间质被缺乏连接结构的纤维化间质所取代,导致心室扩大,心功能降低。亦有研究发现MMP-9基因缺陷小鼠MI后LVEDD和LVESD均比野生型小鼠显著减小,胶原沉积亦减少,左心室扩张得到改善,且心脏破裂的发生率明显降低,足见MMP-9在MI后基质代谢和心肌纤维化中的作用[12]。本研究发现MI后左心室非梗死区MMP-9 mRNA、蛋白表达水平及其活性均明显增高,但pAd-sTGFβRⅡ组较MI组、空载体组明显降低,并同时伴随Ⅰ、Ⅲ型胶原含量的减少和胶原类型的改善,表明sTGFβRⅡ抑制TGF-β介导的MMP-9表达可能是改善MI后心肌间质胶原重塑并最终减轻心肌纤维化的机制之一。由于调控MMP-9活性和表达的因素有很多,我们仍需更多的研究去探讨MMP-9是否可作为MI后心肌纤维化的治疗靶标。
总之,本研究表明sTGFβRⅡ干预能够改善MI后左心室功能,其作用机制可能与其下调MMP-9的表达、改善心肌间质胶原重塑、减轻心肌纤维化有关。
[1]Liu Y,Liao Y,Cheng X,et al.TGF-β1of cardiac tissue and ventricular remodeling in rats with acute myocardial infarction[J].Chin J Pathophysiol(中国病理生理杂志),2005,21(12):2305-2309.
[2]Isaka Y,Akagi Y,Ando Y,et al.Gene therapy by transforming growth factor-β receptor-IgG Fc chimera suppressed extracellular matrix accumulation in experimental glomerulonephritis[J].Kidney Int,1999,55(2):465-475.
[3]Okada H,Takemura G,Kosai K,et al.Postinfarction gene therapy against transforming growth factor-β signal modulates infarct tissue dynamics and attenuates left ventricular remodeling and heart failure [J].Circulation,2005,111(19):2430-2437.
[4]郭张强,廖玉华,李 彬,等.大鼠急性心肌梗死后心室重塑中细胞因子与胶原的变化[J].中国病理生理杂志,2006,22(12):2322-2327.
[5]Dobaczewski M,Bujak M,Li N,et al.Smad3 signaling critically regulates fibroblast phenotype and function in healing myocardial infarction[J].Circ Res,2010,107(3):418-428.
[6]Lian R,Chen Y,Xu Z,et al.Soluble transforming growth factor-β1 recepterⅡ might inhibit transforming growth factor-β-induced myofibroblast differentiation and improve ischemic cardiac function after myocardial infarction in rats[J].Coron Artery Dis,2010,21(6):369 -377.
[7]Sun Y,Zhang JQ,Zhang J,et al.Cardiac remodeling by fibrosis tissue after infarction in rats[J].Lab Clin Med,2000,135(4):316-323.
[8]Ellmers LJ,Scott NJ,Medicherla S,et al.Transforming growth factor-beta blockade down-regulates the rennin-angiotensin system and modifies cardiac remodeling after myocardial infarction [J].Endocrinology,2008,149(11):5828-5834.
[9]Phatharajaree W,Phrommintikul A,Chattipakorn N.Matrix metalloproteinases and myocardial infarction[J].Can J Cardiol,2007,23(9):727 -733.
[10]Anique D,Srefan F,Masanori A,et al.Targeted deletion of matrix metalloproteinase-9 attenuates left ventricular enlargement and collage accumulation after experimental myocardial infarction [J].J Clin Invest,2000,106(1):55-62.
