HPLC法测定复方龙胆片中龙胆苦苷的含量
2011-08-02谢瑞萍
谢瑞萍
(云南省文山州食品药品检验所,云南 文山 663000)
复方龙胆片是文山州中医医院医疗机构制剂,处方由龙胆草、牡丹皮、车前子、苍术等 17味药组成,具有疏肝利胆、清热凉血等功效。主要用于肝胆湿热、肝炎、胆囊炎等。龙胆草为该处方中的主药,具有清热燥湿、利肝胆、健胃、消炎等功效,其主要有效成分是龙胆苦苷[1]。为了更好地控制该药品的质量,保证该药的用药安全,本实验以龙胆苦苷为考察指标,参考了相关资料[2~4],建立了高效液相色谱法测定其含量。
1 仪器与试药
1.1 仪器 Ultimate 3000高效液相色谱仪(P680ALPG-4泵、ASI-100进样器、VWD-3100检测器);HS6150D超声波清洗器(功率250W,频率50KHz);AEG-120G电子分析天平,BP211D电子分析天平。
1.2 试药 复方龙胆片:文山州中医医院提供,批号20080416、20080605、20080529、20090331;阴性对 照样品 自制;龙胆苦苷对照品(批号110770-200611,供含量测定用)由中国药品生物制品检定所提供;甲醇为色谱纯;水为纯化水;其余试剂为分析纯。
2 方法与结果
2.1 色谱条件与系统适用性条件 色谱柱:Waters Symmetry C18柱(250 mm×Φ 4.6 mm,5μm);流动相:甲醇-水(23:77)[5];检测波长:270 nm;柱温:40 ℃;流速:0.8 mL/min;进样量:10 μ L;理论塔板数按龙胆苦苷峰计算不低于3000[6]。在此色谱条件下,龙胆苦苷与其他组分的分离效果较好。
2.2 提取时间的考察 超声处理不同时间,即 15、25、35、45 min,结果见表1,从表中可得到,35 min和45 min提取的龙胆苦苷含量相差甚微,因此选用省时、经济的超声35 min作为前处理方法。结果见表1。

表1 提取时间考察
2.3 对照品溶液的制备 精密称取以五氧化二磷为干燥剂减压干燥24 h的龙胆苦苷对照品10.76 mg置100 mL量瓶中,加甲醇溶解并稀释至刻度,作为对照品储备液(0.1076 mg/mL)。
2.4 供试品溶液的制备 取本品20片,精密称定,研细,取细粉约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定重量,超声处理 35 min,放冷,再称定重量,用甲醇补足损失的重量,摇匀,滤过,取续滤液用微孔滤膜(0.45μm)滤过,取续滤液,即得。
2.5 阴性对照溶液的制备 取处方中除龙胆草以外的所有药材,按处方剂量及制法和工艺要求制备缺龙胆草的阴性对照样品,按供试品溶液的制备方法制备阴性对照溶液。
2.6 专属性试验 精密吸取供试品溶液、对照品溶液、阴性对照溶液 10 μ L,分别注入色谱仪,结果见图1。从图中可看出,在与龙胆苦苷对照品相同的保留时间处,供试品溶液出现了相同的色谱峰,阴性对照溶液在此位置处未出现色谱峰,结果表明在此色谱条件下,其它组分对龙胆苦苷峰无干扰。
2.7 线性关系考察 分别精密量取对照品溶液 1、3、5、7、9 mL置10 mL量瓶中,用甲醇稀释至刻度,摇匀,分别精密吸取10 μ L,注入色谱仪,记录峰面积。以质量浓度为横坐标,以峰面积为纵坐标,制备标准曲线,可得回归方程为Y=-0.2015X+21.7231,r=0.9998,结果表明,龙胆苦苷在 0.01076~0.1076μg/μ L之间,质量浓度与峰面积值呈良好的线性关系。
2.8 精密度试验 精密吸取对照品溶液,重复进样5次,计算得龙胆苦苷峰面积的RSD值为0.899%。
2.9 稳定性试验 精密吸取对照品溶液,分别于0、1、2、4、8、12 h各进样1次,测定样品中龙胆苦苷峰面积,并计算其RSD值为1.315%,表明对照品溶液在24 h内稳定。
2.10 重现性试验 取同一批号样品6份,分别制备供试品溶液,进样测定,龙胆苦苷平均含量为9.13 mg/g,RSD值为1.21%,结果见表2。

图1 复方龙胆片中龙胆苦苷的高效液相色谱图
2.11 加样回收率试验 称取已知含量的同一批号样品6份,每份 0.25 g,精密称定,置具塞锥形瓶中,精密加入浓度为0.0430 mg/mL的龙胆苦苷对照品溶液(另配)50 mL,按“2.4”供试品溶液的制备方法制备,进样测定,计算回收率,结果见表3。
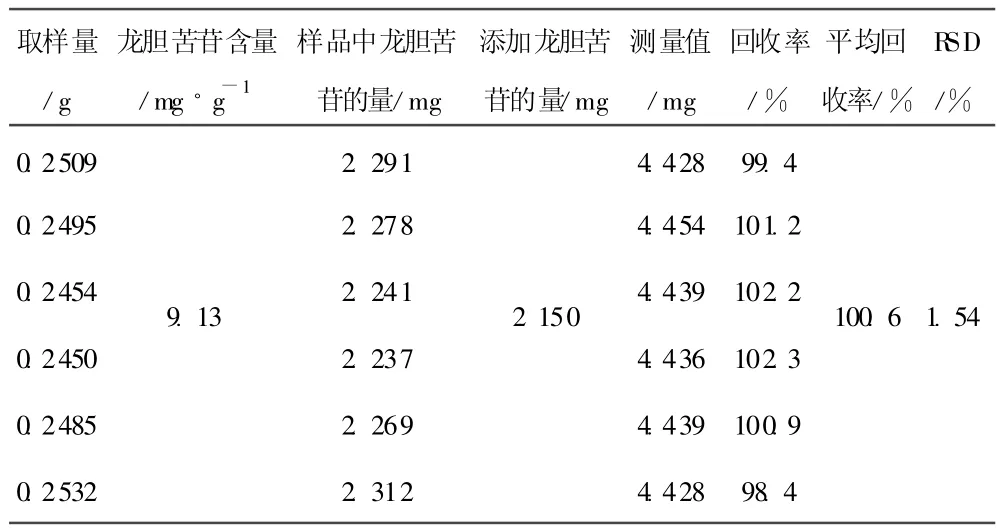
表3 加样回收试验结果
2.12 样品测定 按“2.4”项供试品溶液的制备方法制备5个不同批号的样品,按“2.1”项的色谱条件测定,并计算含量,结果见表4。

表4 含量测定结果
3 讨论
3.1 供试品提取时间考察 本试验考察了不同提取时间(15、25、35、45 min),结果发现 35 min、 45 min 所提取的量略高于 15 min和25 min的,而35 min与45 min相比差异较小,综合考虑,最后选择35 min作为供试品的提取时间。
3.2 检测波长的选择 本实验考察了不同的波长,其中主要对238 nm和270 nm进行了比较,结果发现在238 nm处,某组分的色谱峰干扰龙胆苦苷峰,为了排除杂质峰的干扰,因此,选择270 nm作为检测波长。
3.3 色谱柱的选择 本实验选用了Waters Symmetry C18柱(250 mm×Φ 4.6 mm,5μm)和 Hanbon Sci&Teeh Lichrospher C18柱(150 mm×Φ4.6 mm,5μm)不同的色谱柱,结果发现 Hanbon Sci&Teeh Lichrospher C18柱(150 mm×Φ4.6 mm,5μm)也能达到基线分离,但柱效较低,因而选用Waters Symmetry C18柱(250 mm×Φ4.6 mm,5μm)柱。
在上述色谱条件下,龙胆苦苷峰均在19min左右出现,色谱峰形理想,分离度好,理论塔板数高于3000。此方法简单、快捷、稳定性好,可用于复方龙胆片中龙胆苦苷的含量测定。
[1]陈文华,张淑杰,管春梅,等.HPLC测定龙胆草中龙胆苦苷的含量[J].中国医学检验杂志,2004,5(3):246~247.
[2]张良.金胆片中龙胆苦苷的含量测定[J].中国医药指南,2008,6(24):250~251.
[3]王发义,陈天祥.高效液相色谱法测定苦胆草片中龙胆苦苷的含量[J].中国民间医药,2008,(5):32~35.
[4]庄绪会,孙娇,张庆芝.昆明龙胆与滇龙胆中龙胆苦苷含量的比较[J].云南中医学院报,2010,33(1),12~14.
[5]刘瑞新.HPLC同时测定龙胆泻肝丸中龙胆苦苷和栀子苷的含量[J].中成药,2007,29(8):1170~1172.
[6]国家药典委员会.中华人民共和国药典[S].I部.北京:化学工业出版社,2010:89.
