脑梗死急性期SD大鼠血清血管内皮细胞生长因子变化特点的实验研究
2011-07-31罗永杰
陈 林,罗永杰,熊 毅
(1.四川省乐山市人民医院神经内科,四川 乐山 614800;2.四川省医学科学院·四川省人民医院神经内科,四川 成都 610072)
最新WHO调查显示:脑血管疾病(CVD)是目前导致人类死亡的第二大疾病,幸存者中也有50%以上的致残率,给社会及家庭带来沉重的负担[2]。Jin等[3]认为,VEGF有神经营养作用,在新血管形成之前,VEGF对神经组织有直接保护作用,这有助于延长细胞的存活时间,此保护作用直到新血管形成。VEGF在分子水平上变化对缺血环境发生适应,减轻缺血、缺氧对机体的损害。但是因子在梗死后不同时间点的具体表达特点和相关机制却不甚明确。本课题组2010年6月至2011年4月通过观察SD大鼠右侧局灶性脑缺血后血清中VEGF随时间的动态变化,探讨因子的表达与急性脑梗死的关系。为临床脑梗死的治疗和相关药物研究提供新的靶点。
1 材料与方法
1.1 实验动物 实验动物为2~3月龄SPF级SD大鼠,体重250~320 g,雌雄各半,购于四川省简阳市实验动物基地。随机分至笼中饲养,按统计学中的随机数列编号,总共36只大鼠,随机分为手术组16只、假手术组16只、空白组4只,手术组和假手术组又各分为 A、B、C、D4个小组,每组分别于1/2、2、3、6、12、24、72、168 h 共8 个时间点采血。
1.2 主要实验试剂 ①戊巴比妥;②多聚耐氨酸;③多聚甲醛(溶海生物技术有限公司);④大鼠VEGF酶联免疫分析(Elisa)试剂盒(深圳欣博盛生物科技有限公司提供96t货号ERC103);⑤PBS粉剂(成都溶海生物技术有限公司);⑥NaOH、HCL。
1.3 主要实验仪器 ①手术显微镜、眼科剪、微动脉夹等显微手术器械;②离心机,离心管;③37℃恒温箱,pH试纸;④轨道式摇床(美国Forma公司,MODEL-420);⑤ -80℃冰箱(SANYO,MDFU4086S);⑥可调移液器;⑦MK3酶标仪,酶联免疫加速仪(上海复星);⑧高精度电子分析天平;⑨鱼线2、3号,直径分别为0.23 mm、0.28 mm;⑩智能型电热恒温培育箱(上海琅玕),数显恒温水箱。
1.4 实验方法
1.4.1 建立模型[4,5]参照改良线栓法闭塞大鼠右侧大脑中动脉,制作大鼠局灶性脑梗死模型。
1.4.2 模型评分标准 ①神经功能评分:根据Longa等创立的5级评分法,在大鼠清醒后(术后30~60分钟),进行神经功能评分,标准如下:正常活动0分;不能充分伸展左前肢1分;向左侧转圈2分;向左侧倾倒3分;不能自发行走,意识障碍4分。神经功能评分在1~3分的大鼠用于实验。0、4分者或者术中死亡者淘汰,重新在未选入的大鼠中随机抽取手术。②行为检查:由3位参加实验的人员分别以单盲法对实验的大鼠进行打分和记录。在造模手术后和1/2 h进行行为检查。评分标准[6]:提尾使其离地30 cm时,左肩部内旋、左前肢屈曲、内收(正常大鼠两前肢对称向地伸开)。根据其严重程度,最高为4分,正常为0分。将大鼠置于平滑地板上,检查大鼠抵抗推动时的阻力,分别推其左、右肩向对侧移动,有左侧阻力下降(正常大鼠两侧推动的阻力明显对称)现象。可根据下降程度评1~3分,正常评分为0分。观察大鼠两前肢肌力,爬行时向左划圈。爬板时总是落向左侧。将动物两前肢置于一金属网上,然后轻提起大鼠,检查两前肢肌力。正常左右对称,如有一侧前肢肌力下降者,根据下降程度评为1~3分,正常评分为0分。上述行为检查总积分为0~10分。积分越高说明动物行为障碍越严重。
1.4.3 采血方法 采用断尾采血方法。先刮净尾毛,用温水浸泡鼠尾3~5分钟,酒精消毒鼠尾,固定器固定,在距尾末端3~5 cm处用无菌手术剪剪断鼠尾。第一滴血弃用,留取以后的血液进红头管,每次取血1~1.5 ml,每组第二次采用心脏穿刺采血。注意:术中失血量超过3.5 ml的大鼠淘汰;采血前一定将尾部消毒干净,防尾毛进入血清引起溶血;溶血标本淘汰。全血在2~8℃静置1/2~1小时后1000转离心机离心15分钟,然后用移液器吸分离血清至2 ml离心管,标记笔注明标号,-70℃冰箱冻存。
1.4.4 ELISA实验 首先从冰箱取出试剂盒和血清标本,室温复温平衡30分钟。调配需稀释的液体。分别设待测样品、标准孔、空白孔,空白孔加样品稀释液100 μl,余孔分别加标准品或待测样品100 μl,加样时加于酶标板孔底部,尽量不触及孔壁,不要产生气泡,轻轻晃动混匀,酶标板加上覆膜。37℃恒温箱温育120分钟。弃去液体,甩干,吸水纸上拍干,每孔加生物素标记抗体工作液100 μl,37℃恒温箱温育60分钟,再次弃去液体,甩干,吸水纸上拍干,如此重复洗板3次每次浸泡1~2分钟,200 μl每孔,甩干。每孔加入辣根过氧化物酶标记亲和素工作液100 μl(空白对照孔不加),37℃恒温箱温育60分钟;弃去液体,甩干,吸水纸上拍干,每孔加满洗涤液,静置1~2分钟,如此重复洗板5次。每孔先加入底物溶液90 μl,覆膜37℃避光显色20~30分钟,直至标准品出现明显梯度的蓝色改变(出现终止反应)。出现终止反应时,立即加终止液50 μl,颜色由蓝色立即转为黄色。最后以空白孔调零,在终止后15分钟内,用450 nm波长酶标仪测量各孔的吸光值(OD值),再根据标准品的浓度及对应的OD值,计算出标准曲线的直线回归方程,根据样本的OD值,在回归方程上计算出对应的样品浓度。
1.5 统计学方法 应用SPSS 17.0统计软件对实验数据进行分析,用重复测量的方差分析方法统计各组间及不同时间点的VEGF因子差异。P<0.05为差异有统计学意义。
2 结果
由表1可见,手术组与假手术组VEGF,在1/2、2、3、6、12、24 h 时间点差异均有统计学意义(P <0.05),而手术组与空白组 VEGF,在 1/2、2、3、6、12、24 h时间点差异均有统计学意义(P<0.05),手术组不同时间点的比较发现:VEGF在24 h的表达至峰值,与其他时间点比较,差异有统计学意义(P<0.05)。采用重复测量的方差分析对三组不同处理因素引起的VEGF表达的差异以及不同时间之间的差异进行分析,提示三组间差异有统计学意义(F=5.357,P <0.05),8个时间点间的差异也有统计学意义(F=9.589,P <0.05)。图1显示VEGF在不同处理因素作用下的动态表达过程,VEGF自MCAO后1/2 h即开始表达,之后浓度逐渐升高,于24 h到达高峰。
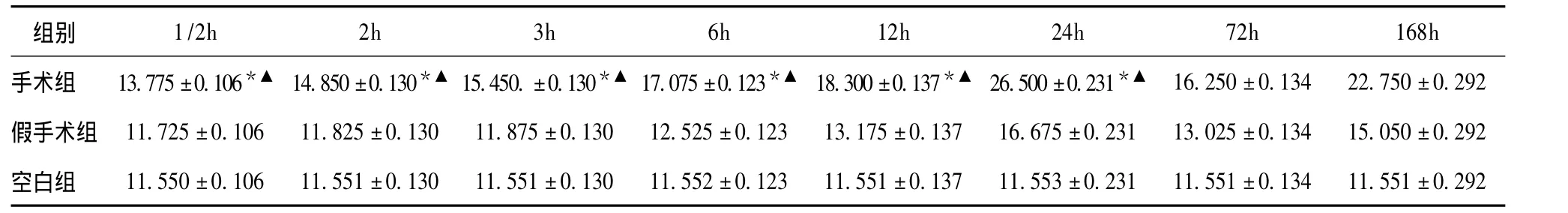
表1 VEGF的动态变化 (pg/ml)
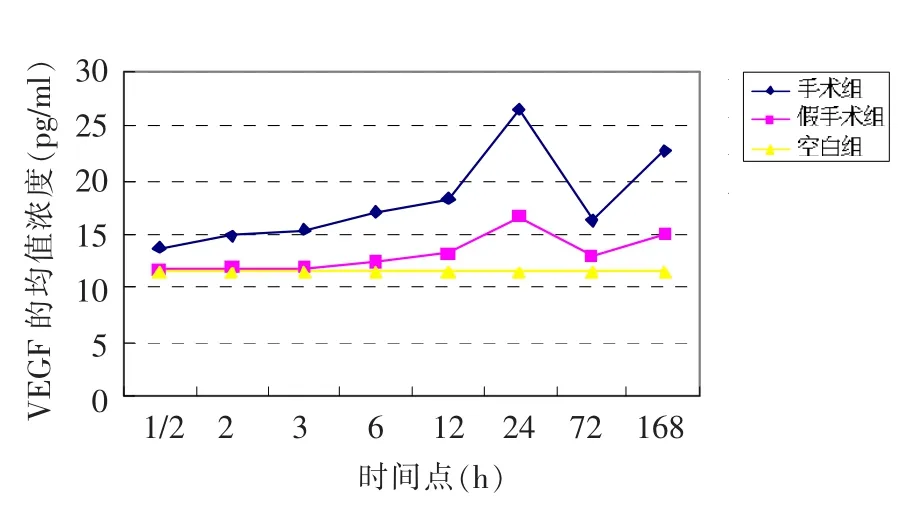
图1 三组大鼠VEGF随时间变化趋势图
3 讨论
VEGF是一种内皮细胞特异性有丝分裂原,在体外可促进内皮细胞生长,在体内可诱导血管生成。缺氧是VEGF和VEGF受体(VEGFR)表达上调的强效诱发因素,VEGF是目前已知最强的血管通透性因子,主要作用于毛细血管后微静脉和小静脉,其作用是组织胺的5万倍。在血管生成过程中,内皮细胞需表现一系列的复杂行为,包括增殖、迁移、细胞间黏附、排成直线及形成开放的管腔样结构等,还包括血管基底膜及细胞外基质的降解。此过程需要多种因子参与,其中VEGF是主要的调控因子。VEGF可提高葡萄糖进入内皮细胞的能力,补充血管形成所需的高能量。有研究认为在VEGF增加血管通透性的信号传导通路中 Src起重要作用[10,11],和蛋白激酶C(PKC)、Raf-1-MEK-ERK1/2、一氧化氮合酶(NOS)等也有关。VEGF通过 NO和前列环素(PGI2)对调节血管通透性也很重要。
VEGF在多种中枢神经系统疾病中的作用已得到肯定,Sondell等[12]研究发现,VEGF能刺激神经轴突的生长和延长神经细胞的存活时间,VEGF在病理状态下对中枢神经系统有保护作用。Samii等[13]用链脲霉素诱导大鼠Ⅰ型糖尿病模型,通过染色后观测,脊神经和坐骨神经的神经纤维中VEGF呈强阳性表达。用神经生长因子治疗的病理模型大鼠,周围神经功能改变表现为Schwann细胞[14]和神经元中VEGF上调;中枢神经功能改变表现为小胶质细胞和神经元中VEGF上调,故推测VEGF可能对神经再生也起一定的保护作用。
VEGF在脑梗死发病过程中起着双重作用,一方面它可使内皮细胞增殖并迅速形成新生血管,改善组织缺血缺氧环境,诱导小胶质细胞增生,故对脑缺血患者神经细胞的保护、侧支循环的建立等方面起积极意义;另一方面,它增加脑血管与组织间隙及血脑屏障的通透性,引起脑水肿形成和加重,增加颅内压,起到有害作用。所以在脑梗死患者中到底给予VEGF还是阻断其作用不确切,这里有一个时机和剂量的问题需要解决,这个问题值得深入研究。Van Bruggen等[15]报道,在大鼠脑缺血早期短暂应用VEGF拮抗剂,可使脑水肿减轻。近年来的实验发现糖皮质激素地塞米松对缺血半暗带VEGF表达的抑制、对缺血再灌注脑组织血管内皮细胞VEGF表达的抑制、对脑水肿形成的抑制三者的时相点一致,推测地塞米松可通过VEGF间接减轻脑水肿程度。近年有报道称,对缺血性疾病导入VEGF基因或给予重组人VEGF(rhuVEGF)可促进血管新侧支循环的建立,可代替血管重建和搭桥术,故称为“治疗性血管成形术”分子搭桥术,这也说明了VEGF在新生血管形成方面的作用。VEGF在小鼠急性脑梗死模型的实验性治疗中已取得了阶段性成果。Hayashi等[16]的研究表明,VEGF不仅可使梗死面积缩小,减轻脑水肿的形成,而且可局限神经元受损范围的扩展。多种动物模型的实验不断深入地阐明VEGF的作用、机制,推动VEGF的应用逐渐走向临床。了解VEGF在大鼠MCAO后的动态变化特点并找出其规律,准确控制VEGF进行干预的时间窗和干预程度,对脑梗死的诊断、治疗必将起到重要的作用。
本实验结果和相关文献明确了VEGF在脑梗死后不同时间点的相关表达。VEGF因子在缺血性病变的病理过程中发挥着关键作用;它与其他因子如缺氧诱导因子-1α(HIF-1α)、热休克蛋白 70(Hsp70)、半胱天冬蛋白酶(Caspase3)在缺血性病变的恢复机制中互相协同。所以对于VEGF在缺血性脑血管病中的信号转导途径及其活性调节机制的阐明可能为缺血性脑血管病的治疗提供了新的靶点。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2]贾建平,崔丽英,王伟,等.神经病学[M].第6版,北京,人民卫生出版社,2008.
[3]Jin KL,Mao XO,Nagayama T,et al.Induction of vascular endothelial growth factor and hypoxia-inducible factor-1alpha by global ischemia in rat brain[J].Neuroscience,2000,99(3):577-585.
[4]Belayev L,Alonso OF,Busto R,et al.Middle cerebral artery occlusion in the rat by intraluminal suture.Neurological and patho logical evaluation of an improved model[J].Stroke,1996,27(9):1616-1622.
[5]Laing RJ,Jakubowski J,Laing RW.Middle cerebral artery occlusion without craniectomy in rats:Which method works bests[J].Stroke,1993,24(2):294-298.
[6]Bederson JB,Pitts LH,Germano SM,et al.Evaluation of 2,3,5-triphenyltetrozolium chloride as a stain for detection and quantification of experimental cerebral infarction in rats[J].Stroke,1986,17(17):1304-1308.
[7]崔淑芳.医学实验动物的选择[M].第3版.上海:第二军医大学出版社,2007.
[8]Markgraf CG,Kraydieh S,Prado R,et al.Comparative histopathologic consequences of photothrombotic occlusion of the distal middle cerebral artery in Sprague-Dawley and Wistar rats[J].Stroke,1993,24(2):286-292.
[9]Koizumi J,Yoshida Y,Nakazawa T,et al.Experimental studies of ischemic brain edema:1.A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area[J].Jan J Stroke,1986,8:1-8.
[10]Garrido C,Brunet M.Heat shock proteins27 and 70:anti-apop-totic proteins with tumorigenic properties[J].CellCycle,2006,5(22):2592-2601.
[11]Rocchigiani M,Lestingi M,Luddi A,et al.Human FIGF:cloning,gene structure,and mapping to chromosome Xp22.1 between the PIGA and the GRPR genes[J].Genomics,1998,47(2):207.
[12]Kaipainen A,Korhonen J,Mustonen T,et al.Expression of the fms2 like tyrosine kinase 4 gene becomes restricted to lymphatic endothelium during development[J].Proc Natl Acad Sci USA,1995,92(8):3566-3570.
[13]姚维成,孟庆海,刘卫东,等.水通道蛋白4在大鼠蛛网膜下腔出血后脑水肿的表达研究[J].中华神经外科杂志,2006,22(7):434-436.
[14]Lee SR,Lo EH.Induction of caspase-mediated cell death by matrix metaloproteinases in cerebral endothelial cells after hypoxia-reoxygenation[J].J Cereb Blood Flow Metab,2004,24(7):720-727.
[15]Van Bruggen N,Thibodeaux H,Palmer JT,et al.VEGF antagonism reduces edema formation and tissue damage after is chemia/reperfusion injury in the mouse brain[J].Clin invest,1999,104(11):1613.
[16]Hayashi T,Abe K,Suzuki H,et al.Rapid induction of vascular endo thelial growth factor gene expression after transient middle cerebral arteryocclusion in rats[J].Stroke,1997,28(10):2039.
[17]Koizumi J,Yoshida Y,Nakazawa T,et al.Experimental studies of ischemic brain edema:1.A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area[J].Jan J Stroke,1986,8:1-8.
