脂肪组织来源干细胞的分离培养及鉴定
2011-07-31傅荣游晓波鲁峰
傅荣,游晓波,鲁峰
(1.四川省医学院科学院·四川省人民医院整形外科,四川 成都 610072;2.南方医科大学南方医院整形外科,广东 广州 510515)
种子细胞的获取、培养与种植是组织工程学的关键性步骤,是其前提和基础。一段时间以来,种子细胞来源不足、体外扩增能力弱、细胞数量有限和功能老化等问题限制了组织工程技术的发展与应用。解决种子细胞问题的关键就是如何获得来源广泛、数量充足、功能良好的细胞[1~3]。目前,干细胞作为种子细胞,因其具有强大的自我更新、多向分化或跨胚层发育的可塑,在组织工程的构建及基因的治疗方面具有巨大发展潜力。而干细胞中的成体干细胞在应用上与胚胎干细胞相比,不存在一些伦理学问题,取材方便,对机体无害,由于诱导的组织不存在配型及免疫排斥问题且分化的组织类型广泛,具有重要的临床价值[4~6]。近年来的研究证实,脂肪组织中能分离和培养出脂肪组织来源干细胞(adiposederived stem cells,ASCs),可以向成软骨细胞、成骨细胞、肌细胞、神经细胞和脂肪细胞等不同胚层来源的细胞分化,具备自我更新能力与多向分化潜能,类似于骨髓间充质干细胞等特性[7~9],具有能大量获得、自体取材容易、来源广泛的优势,是一种较理想的组织工程种子细胞。脂肪组织一般通过脂肪吸脂术获取,而抽吸物中包含脂质和液体两部分[10],脂质部分已被证实可以分离出具有多向分化能力的干细胞,而液态部分中是否也包含类似的干细胞。我们已证实液态部分含有ASCs,并在细胞的生长动力学、形态学、细胞衰老、表面标志物和分化能力等方面与脂质部分的干细胞具有非常相似的特性,认为这种经过最小限度人工干预的ASCs可能是将来脂肪组织工程比较理想的种子细胞[6]。2010年1~12月四川省医学院科学院·四川省人民医院整形外科将脂肪抽吸术中获得的脂质成分作为脂肪干细胞的来源,进行分离、培养、分化和鉴定等,为寻找一种理想的组织工程种子细胞提供实验依据,现报道如下。
1 材料与方法
1.1 实验材料及仪器 胎牛血清(PAA)高糖的DMEM、磷酸盐缓冲液(PBS)、胰蛋白酶-EDTA、青链霉素原液,I型胶原酶(Sigma),地塞米松(Sigma),胰岛素(Wako),吲哚美辛(Sigma),IBMX(Sigma),油红“O”,细胞培养瓶、培养板、培养皿,CD105、CD34、SMA和Ⅷ因子单克隆抗体(Zymed),细胞免疫化学SPK检测试剂盒(Zymed),CO2细胞培养孵箱(Forma),超净工作台,低温高速离心机,倒置显微镜,流式细胞仪。
1.2 组织材料 脂肪来自4例18~40岁行腹部及大腿脂肪抽脂术的健康成人,供体无传染病及内分泌疾病,男女比例为1∶1,平均脂肪抽吸物100 ml。
1.3 实验方法
1.3.1 人ASCs的体外分离培养及生物学特性分析①脂肪组织采集及ASCs的分离:脂肪抽吸物被分为两种成分:一种是比重小的脂质成分,另一种是比重大的液体成分。本实验采集液体成分作为ASCs的来源。取得液体成分约300 ml,经400 r/min低速离心5分钟,去上清,取沉淀加入适量完全培养基制成混悬液,沉淀混悬后100 μm尼龙网过滤,细胞悬液用细胞记数板记数。②原代培养:ASCs悬液接种于75 cm2培养瓶内(5×104),37℃,5%CO2培养箱内培养,24小时、72小时各换液一次,去除非贴壁细胞,贴壁培养纯化ASCs,每3天换液一次。③ASCs传代培养:至细胞生长至80%融合时,0.05%胰酶/0.02%EDTA消化传代,10%FBS DMEM培养液中止细胞消化,400r离心5~10分钟,10%FBS DMEM培养液重悬细胞,将细胞悬液接种于三个75 cm2培养瓶内37℃,5%CO2培养箱内培养。④ASCs活力测定:取50 μl细胞重悬液与50 μl的0.2%台盼蓝染液混合,于血球计数板上计数四个大方格内的细胞总数、死细胞数,计算活细胞的百分率[活细胞百分率=(活细胞数/总细胞数)×100%]。⑤ASCs的生长及增殖特点:细胞培养过种中每日在相差显微镜下观察细胞形态变化及生长增殖状况并拍照。采用离心法获取ASCs,传2代后,获得均一的成纤维样细胞,0.25%胰酶+0.02%EDTA消化,制成细胞悬液,接种至24孔培养板中(1×104细胞/孔),每日取4孔细胞胰酶消化进行细胞计数,剩余细胞,每3天换液1次,根据计数结果求平均数以绘制ASCs细胞生长曲线。
1.3.2 流式细胞仪检测体外培养细胞的分子表达四代细胞培养达90%融合后,彻底清洗去除悬浮细胞后,胰酶消化,PBS重悬,每组取细胞2×106,行流式细胞仪检测,分别检测显示ASCs特异性的CD44、CD29、CD106、CD34;成纤维细胞特异性的 HLA-DR;造血干细胞标志的CD133、CD45进行检测的百分比。设空白对照(不加一抗和对应二抗)和阴性对照(不加一抗,只加入二抗)。具体步骤:每组取培养细胞1×106,50%乙醇透化处理30分钟,4℃ 1500 rpm离心10分钟,弃上清,PBS洗涤,离心(同上)后制成100 μl单细胞悬液,各组分别加入鼠抗人 CD34、CD44、CD29、HLA-DR、CD133、CD106、CD45,室温孵育 30 分钟,PBS洗涤,离心,加入FITC标一记的羊抗鼠二抗(1∶100),4 ℃避光孵育30分钟,PBS洗涤,离心,加PBS 至300 μl,制成细胞悬液,FCM 分析。
2 结果
2.1 细胞形态学观察 把抽吸物液体部分直接离心、过滤,不经过酶消化,在接种48小时内ASCs是由大量圆形、透亮、无核的红细胞所覆盖,未见有梭形细胞贴壁。因为红细胞为悬浮细胞,不贴壁的红细胞在更换培养基时可除去。故经过2~3次换液后,红细胞逐渐减少直至最终消失,取而代之的是大量贴壁的梭形细胞(图1a)。贴壁的细胞成纤维细胞样的形态,在最初的5~7天有一段生长延滞时间。然后细胞进入增殖期,此后细胞增殖旺盛,原代培养的细胞8~12天即达70%~80%融合。单层细胞以0.25%胰蛋白酶消化传代,以后每2~3天传代一次。传代后细胞形态主要为梭形(图1b),体外传至10代后,细胞形态及倍增时间无明显改变。
2.2 细胞活性 ASCs在倒置显微镜下观察,均生长良好,细胞透光性好,形态完整,细胞碎片少,细胞稳定性好,可连续传代。细胞台盼蓝染色,活细胞不被染色,死细胞被染成蓝色,镜下观察,被染成蓝色的细胞很少(图 1c)。各组细胞在第 1、3、5、7、9 和11天的细胞存活率分别为(92.29±0.91)%、(92.83±1.26)%、(91.99±0.83)%、(92.93±0.81)%、(92.02±0.92)%和(91.98±0.93)%。
2.3 体外培养ASCs增殖速度 原代贴壁培养的ASCs生长速度缓慢,细胞密度不均,培养约10~12天后细胞才能达到90%融合。传代培养后,细胞形态及密度均匀,数小时内贴壁并伸展成多角形、梭形。2天前为相对抑制期,此后呈指数形式快速增殖,3~5天后达到80% ~90%融合。根据不同培养时间细胞数量绘制ASCs生长曲线。
2.4 流式细胞仪鉴定 流式细胞仪测得ASCs表面标记CD29、CD44阳性表达,说明该细胞具有干细胞特性;HLA-DR几乎无表达,排除该类细胞是成纤维细胞。ASCs细胞表面抗原分析:CD2974.0%,CD4436.9%,CD341.4%,HLA-DR 1.8%。
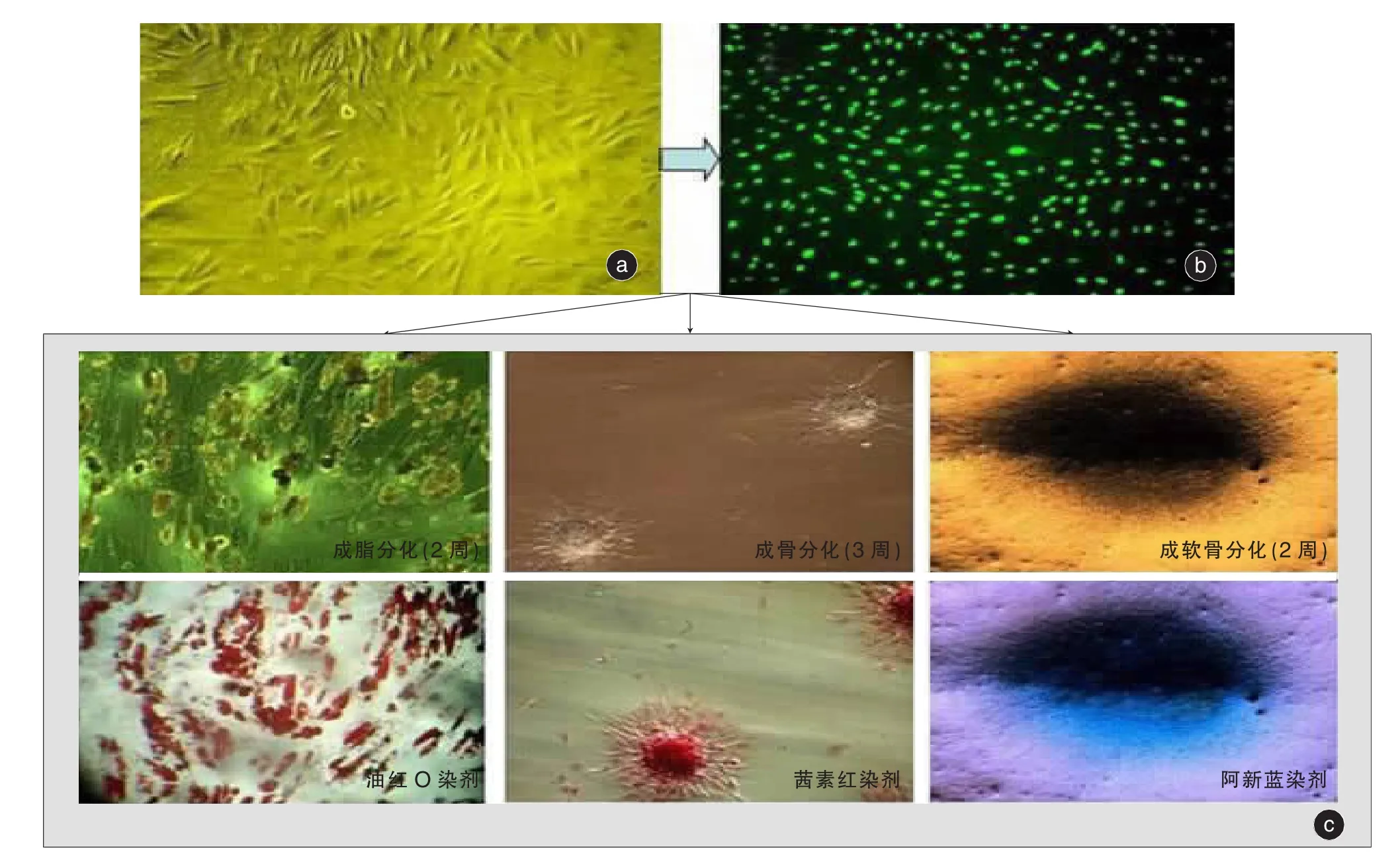
图1 人脂肪组织来源干细胞ASCs的分离培养,荧光标记及多向分化 a:原代培养的ASCs b:荧光显微镜下GFP标记的ASCs c:ASCs的体外成脂,成骨,成软骨分化及鉴定
3 讨论
随着现代医学的发展,人们已成功分离培养了多种干细胞,这为人类探索干细胞生物学调控机理和评价其治疗人类许多疾病的潜能打开了方便之门。干细胞总体上可分为胚胎干细胞和成体干细胞。胚胎干细胞在理论上虽具有最理想的效果,但其自身的免疫原性、取材困难以及宗教伦理道德等问题,限制了它在临床上的应用。而成体干细胞在分化能力上不及胚胎干细胞,但由于其可避免社会伦理之争,逐渐成为研究的热点。研究已证实从骨髓中分离得到的成体干细胞,在体外条件下可大量扩增并表现出广泛的多向分化潜能[11,12]。鉴于脂肪组织与骨髓同属于中胚层组织,因此有学者认为脂肪组织中也应该含有类似的干细胞,该假设被随后一系列的实验所证实。
近年来,多个研究小组从脂肪组织中分离得到的抽脂处理细胞[13]、脂肪基质微管碎片细胞、脂肪组织源基质细胞、脂肪源中胚层干细胞、或者脂肪源间质干细胞、脂肪源成体干细胞等[14~18],这些细胞可能就是脂肪组织中的一类多能性干细胞,因为它们均表现出具有体外可大量扩增和多向分化的能力。目前,各国研究人员大多采用这种方法来分离和培养此种细胞并将所得的细胞称之为 ASCs[19,20]。
目前已证实ASCs能向脂肪细胞、软骨细胞、成骨细胞、肌肉细胞及心肌细胞定向诱导转化,可作为多种组织工程的种子细胞。另外,ASCs目前已被用于研究骨缺陷、直肠阴道瘘的治疗和软组织增高术的临床实验。由于ASCs具有易获得性、可迅速扩增及多向分化潜能等特点,其将成为具有广阔治疗应用前景的一类成体干细胞。
我们采用简便经济方法,在未消化干细胞的条件下,从液体成分中成功获得ASCs,效率较高,避免了红细胞裂解液对细胞的损伤,同时避免了密度梯度离心法的操作复杂性。这种方法分离和培养出的细胞具有很强的增殖活性,体外培养可以保持在稳定的群体倍增数增长阶段,且传至10代以上增殖速度无明显变化。可以推测,经过最小限度人工干预的ASCs,其安全性和有效性将会更高,将更适合作为构建组织工程脂肪的种子细胞来源。
[1]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7:221-228.
[2]Ferrara N.Molecular and biological properties of vascular endothelial growth factor[J].J Mol Med,1999,77:527-543.
[3]Frerich B,Lindermann N,Krutz-Hoffman J,et al.In vivo model of a vascular stroma for the engineering of vascularized tissues[J].Int J Oral Maxillofacial Surg,2001,30(5):414-420.
[4]Cho SW,Kim SS,Rhie JW,et al.Engineering of volume-stable adipose tissues[J].Biomaterials,2005,26(17):3577-3585.
[5]Shieh SJ,Vacanti JP.State-of-the-art tissue engineering:from tissue engineering to organ building[J].Surgery,2005,137(1):1.
[6]鲁峰,高建华,水野博司,等.脂肪组织来源干细胞定向分化脂肪组织的体内外实验研究[J].中华整形外科杂志,2007,23(5):412.
[7]Gazit D,Turgeman G,Kelley P,et a1.Engineered pluripoten mesenchymal cells in integrate and differentiate in regenerating bone:a novel cell mediated gene therapy[J].J Gene Med,1999,1(2):121-133.
[8]Yarlagadda PK,Chandrasekharan M,Shyan JY.Recent advances and current developments in tissue scaffolding[J].Biomed Mater Eng,2005,15(3):159.
[9]Koide M,Osaki K.A new type of biomaterial for artificial skin dehydrothemally cross-linked composites for fibrillar and denatured collagens[J].Biomed Mater Res,1993,27:79-87.
[10]Ponticiello MS,Schinagl RM,Kadiyala S,et al.Gelatin-based resorbable sponge as a carrier matrix for human mesenchymal stern cells in cartilage regeneration therapy[J].Biom Mater Res,2000,52(2):246-255.
[11]Rakesh KJ.Molecular regulation of vessel maturation[J].Nature Medicine,2003,9:685-693.
[12]马勇江,屈雷,杨学义,等.脂肪间质干细胞研究进展[J].生命科学研究,2003,7(4):1-4.
[13]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Cell Biol,2002,13:4279-4295.
[14]Ugarte DA,De Alfonso Z,Zuk PA,et al.Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from adipose tissue and bone marrow[J].Immunol Let,2003,31:267-270.
[15]Yoshimura K,Shigeura T,Matsumoto D,et al.Characterization of freshly isolated and cultured cells derived from the fatty and fluid portions of liposuction aspirates[J].J Cell Physiol,2006,208(1):64-76.
[16]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[17]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Engineering,2001,7:211-228.
[18]Gronthos S,Franklin DM,Leddy HA,et al.Surface protein characterization of human adipose tissue-derived stromal cells[J].Journal of Cellular Physiology,2001,189:54-63.
[19]Garcia-Olmo D,Garcia-Arranz M,Herreros D,et al.A phase I clinical trial of the treatment of Crohn's fistula by adipose mesenchymal stem cell transplantation[J].Dis Colon Rectum,2005,48:1416-1423.
[20]Yoshimura K,Shigeura T,Matsumoto D,et al.Characterization of freshly isolated and cultured cells derived from the fatty and fluid portions of liposuction aspirates[J].J Cell Physiol,2006,208(1):64-76.
