siRNA沉默Nox1基因抑制胃癌细胞的生长*
2011-07-31曹家庆朱培谦毛盛勋
辛 林,曹家庆,朱培谦,沈 威,毛盛勋
(南昌大学第二附属医院胃肠外科,江西 南昌 330006)
胃癌是胃肠道常见的恶性肿瘤,细胞癌基因、凋亡抑制基因、凋亡基因等的异常表达是胃癌产生的重要原因。因此,特异性阻止胃癌细胞内异常高表达基因已成为胃癌治疗的新方法[1]。近年来研究表明,活性氧簇(reactive oxygen species,ROS)是参与体内细胞分化、增殖、转化、凋亡以及血管生成调节的重要信号分子[2]。细胞内ROS主要是由NADPH氧化酶(NADPH oxidase,Nox)调控生成,有学者报道Nox1在人正常胃上皮组织中不表达,但在胃癌组织中高表达[3]。因此,Nox1基因有可能成为胃癌生物治疗的分子靶点。
RNA干扰(RNA interfering,RNAi)是近年来发展起来的一种基因沉寂技术,已成为分子生物学研究中最为活跃的热点之一。RNAi技术可高效、特异地下调靶基因的表达,是一种简便而快速的基因功能研究手段[4,5]。本实验使用RNA干扰技术抑制胃癌细胞Nox1基因的表达,研究Nox1基因与胃癌细胞凋亡的关系,期望为胃癌的基因治疗提供一定的实验依据。
材料和方法
1 材料
人胃癌细胞株SGC-7901由上海消化外科研究所提供。siRNA序列由上海吉玛制药有限公司合成。Nox1 siRNA正义链序列为5'-CCU GAG GGG CAC CUG CUC A dTdT-3',反义链序列为5'-UGA GCA GGU GCC CCU CAGG dTdT-3'。阴性对照siRNA正义链序列为5'-UUC UCC GAA CGU GUC ACG U dTdT-3',反义链序列为5'-ACG UGA CAC GUU CGG AGA A dTdT-3'。RNA抽提试剂盒购自Invitrogen,逆转录试剂盒购于Promega。实时定量PCR所用的荧光标记物SYBR Green I混合物购自Applied Biosystems,所用引物采用Primer Express软件(Applied Biosystem)设计,鼠抗人Nox1单克隆抗体和Annexin V-异硫氰酸荧光素(FITC)凋亡检测试剂盒购自 BD Transduction Laboratories,辣根过氧化物酶(HRP)标记的羊抗鼠II抗购自Santa Cruz。
2 方法
2.1 细胞培养 在37℃、5%CO2(V/V)饱和湿度条件下,含10% 胎牛血清的RPMI-1640培养液中传代培养人胃癌SGC-7901细胞。转染前1 d,换取新鲜培养液后调整细胞浓度为5×107/L,以每孔2 mL接种于6孔板中培养过夜,待细胞增殖至50%~70%时,根据实验要求换为新鲜配制的含不同siRNA的RPMI-1640培养液,继续培养1~5 d后检测各指标。
2.2 细胞转染 转染试剂采用Lipofectamine2000(Life Technology),按说明书操作,简述如下:每500μL终体积中加入siRNA 母液1.5μL(干扰浓度为60 nmol/L)与50 μL RPMI-1640 培养液混合,Lipofectamine 20001.2 μL与 RMPI-1640培养液50 μL混合,室温放置5 min(Lipofectamine 2000与siRNA比例为1∶3),将上述用RPMI-1640稀释的siRNA和Lipofectamine 2000混合,室温放置20 min。将此混合物加入细胞培养板(预先加入 RPMI-1640培养液400 μL),混匀,37℃、5%CO2培养4 h后换用新鲜含10%新生牛血清的RPMI-1640培养液继续培养。实验分为4组:空白对照组(正常培养细胞)、阴性对照组(加阴性对照siRNA)、试剂对照组(不加siRNA,仅加入转染试剂)和干扰组(加入Nox1特异性的siRNA)。
2.3 实时定量PCR检测胃癌SGC-7901细胞Nox1 mRNA表达 用Trizol提取细胞中总RNA,将1 μg总RNA逆转录成cDNA。用Nox1实时定量PCR引物进行荧光定量PCR检测。Nox1上游引物:5'-CTC TCT CCT GGA ATG GCA TC-3',下游引物 5'-TGG AAA ACA TCC TCA CTG GC-3'。采用GAPDH作为内参照,上游引物:5'-GGA CCT GAC CTG CCG TCT AG -3',下游引物 5'- GTAGCC CAG GAT GCC CTT GA-3'。采用实时定量PCR仪(MJ Research)扩增上述基因,PCR 反应体系为:cDNA 1.0 μL,2 × SYBR Green I混合物 10 μL,上、下游引物各 1.0 μL,ddH2O 7.0 μL,每一样品均重复2个反应。按下述条件进行反应:50℃ 2 min,95℃ 10 min,95℃ 15 s,58℃ 1 min,40个循环。采用GAPDH内参照,Nox1 mRNA和GAPDH mRNA根据标准曲线得出mRNA的分子拷贝数。用GAPDH的拷贝数作为校正基数,即目的基因mRNA含量=目的基因Ct值/内参照GAPDH Ct值,以此比值做统计处理。根据FQ-PCR原理,被激发的荧光信号达到一定阈值后被荧光探头采集,最后将其转换成Ct值,该数值与扩增片段的实际拷贝数呈反比,即Ct值越低,实际拷贝数含量越高。
2.4 Western blotting检测胃癌SGC-7901细胞Nox1蛋白表达 取转染72 h后的胃癌SGC-7901细胞总蛋白50μg做SDS-PAGE电泳。电泳结束后转移蛋白至PVDF膜上,5%脱脂奶粉室温封闭2 h,加入 Nox1鼠抗人多克隆抗体(1∶500)及GAPDH鼠抗人多克隆抗体(1∶500)室温孵育3 h,TBST洗膜,加入碱性磷酸酶标记的羊抗鼠多克隆Ⅱ抗(1∶2000)1 h,TBST洗膜,用DAB显色。经自动电泳凝胶分析系统扫描并测定杂交条带IA,实验重复3次,将Nox1 IA/GAPDH IA平均值作为其蛋白表达水平的相对值。
2.5 CCK8细胞增殖实验 胃癌SGC-7901细胞培养于96孔板,2×103cells/well,实验分为4组:空白对照组(正常培养细胞),阴性对照组(加阴性对照siRNA),试剂对照组(不加siRNA,仅加入转染试剂)和干扰组(加入Nox1特异性的siRNA),每种处理方式接种5复孔,24 h后细胞处于指数生长阶段转染 Nox1 siRNA,分别在转染后24、48、72、96 h、120 h 加入 CCK810 μL,37 ℃ 培育4 h,酶标仪(Bio-TEK ,型号Quant)检测其450 nm的吸光度(A),取5个时点的A值平均值并绘制生长曲线。
2.6 细胞凋亡检测 细胞制成1×108/L的悬液,取100 μL细胞悬液放入试管中,加入 FITC-Annexin V 10 μL和 PI 5 μL染色,室温下避光静置15 min后加400 μL孵育缓冲液,1 h内流式细胞仪检测。先通过散射光信号分选细胞与细胞碎片,然后再在双变量荧光信号散点图上区分出活细胞、死亡细胞与凋亡细胞。
3 统计学处理
结 果
1 Nox1 siRNA对胃癌细胞Nox1 mRNA和相应蛋白表达水平的影响
将Nox1 siRNA转染至胃癌SGC-7901细胞,24、48及72 h后抽提其RNA,逆转录,经荧光定量PCR检测,发现转染24 h后干扰组细胞Nox1 mRNA表达量开始下降,与阴性对照组之间差异显著(P<0.05),48 h时下降更为明显,与阴性对照组之间差异显著(P<0.01),见图1。转染72 h后抽提蛋白,经Western blotting检测发现,干扰组细胞Nox1蛋白表达水平较阴性对照组下降明显,蛋白表达量是阴性对照组的17.55%,其抑制率为82.45%,与阴性对照组比较,显著差异(P <0.01),见图2。
2 Nox1 siRNA对胃癌细胞生长的影响
Nox1 siRNA转染胃癌SGC-7901细胞72 h后干扰组胃癌细胞的增殖速度较阴性对照组、空白组及试剂对照组有显著下降(P<0.05),而阴性对照组与空白组及试剂对照组间无显著差异(P>0.05),见图3。
3 流式细胞术检测Nox1 siRNA对胃癌细胞凋亡的影响
Nox1基因沉默72 h后,经Annexin V/PI双染色,流式细胞仪检测细胞凋亡率,空白对照、阴性对照、试剂对照和干扰组的凋亡率分别为(6.45±0.58)%、(8.16±1.03)%、(9.15±0.80)%和(53.44±3.40)%。干扰组细胞凋亡率较阴性对照组、空白对照组及试剂对照组有明显上升,差异显著(P <0.01),见图4。
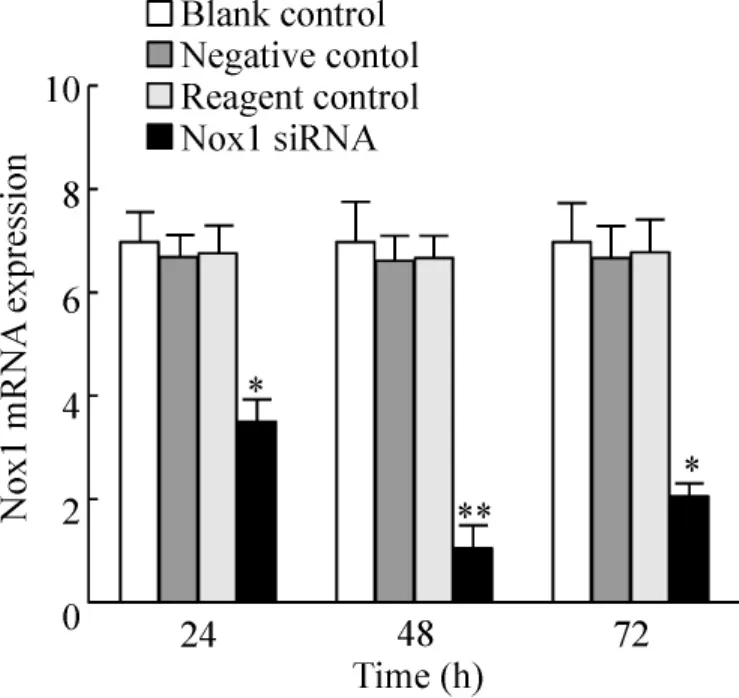
Figure 1.Real-time quantitative PCR results of Nox1 mRNA expression in SGC-7901 cells treated with Nox1 siRNA for 24,48 and 72 h..n=4.*P<0.05,**P<0.05 vs negative control or reagent control group.图1 siRNA抑制SGC-7901细胞 Nox1 mRNA表达的实时定量PCR结果
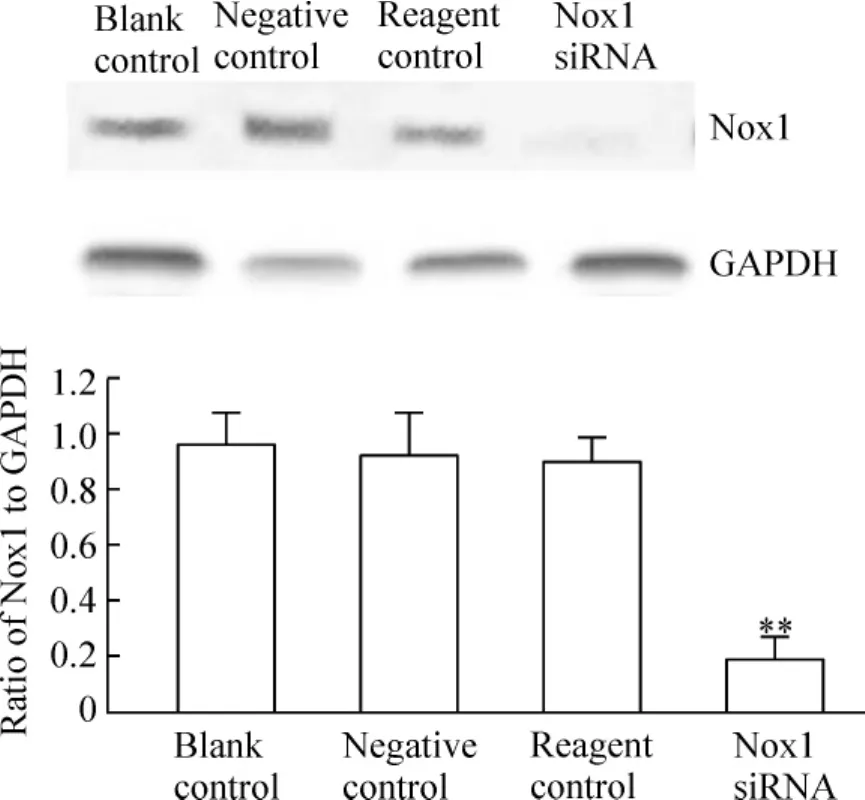
Figure 2.Nox1 protein expression in SGC -7901 cells treated by Nox1 siRNA for 72 h..n=4.**P<0.01 vs negative control or reagent control group.图2 Nox1 siRNA抑制SGC-7901细胞Nox1蛋白的表达
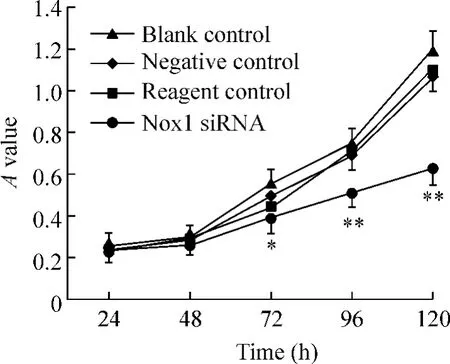
Figure 3.The growth curves of SGC-7901 cell after Nox1 siRNA transfection..n=4.*P<0.05,**P<0.01 vs negative control or reagent control group.图3 转染Nox1 siRNA后胃癌SGC-7901细胞生长的变化
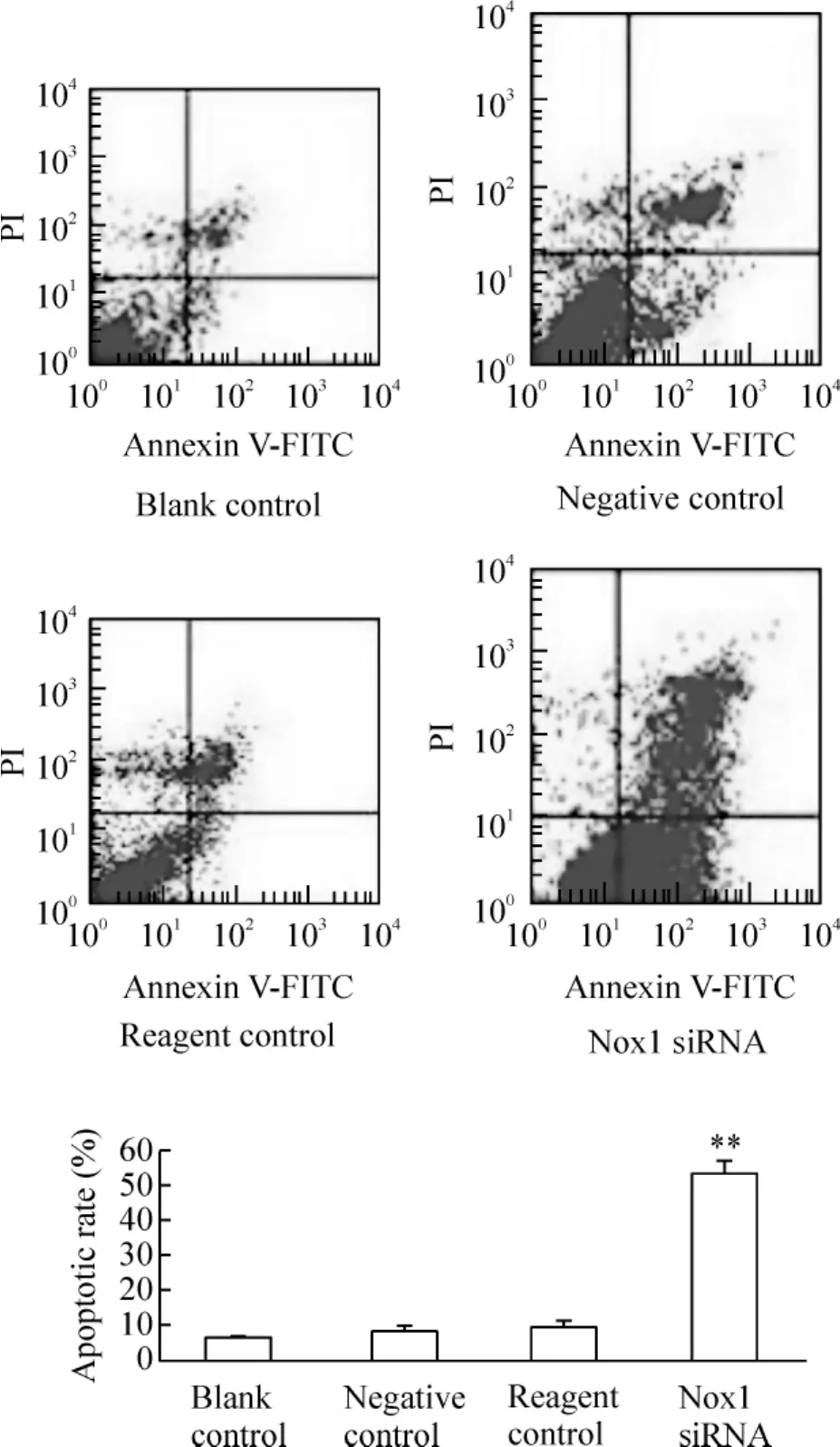
Figure 4.SGC-7901 cell apoptotic rate in different groups after Nox1 siRNA transfection for 72 h..n=4.**P<0.01 vs negative control or reagent control group.图4 转染Nox1 siRNA 72 h后不同处理组SGC-7901细胞凋亡率比较
讨 论
Nox首先被发现于中性粒细胞和巨噬细胞中,在炎症反应时这两种细胞发生“氧化爆发”产生大量ROS而构成机体抵抗病原体的第一防线,与吞噬细胞中Nox所制造的ROS不同,其它细胞内Nox产生的ROS并非主要起细胞防御作用,而是作为第二信使,参与细胞分化、增殖、凋亡的调节[6]。在不同种类的细胞中发现了一系列NADPH氧化酶的催化亚基,分别称其为 Nox1、Nox2、Nox3、Nox4、Nox5、DUOX1 及DUOX2,这些同源物后来被命名为Nox蛋白家族。有学者研究了Nox家族各个成员在多个肿瘤细胞系以及肿瘤组织及癌旁组织中的表达,发现在不同的肿瘤组织中,Nox家族各个成员表达的程度不同,Nox活性与肿瘤细胞的侵袭力及增殖能力相关[7]。
Nox1基因位于X染色体上,其至少有3种剪切变构体(splice variants),即 Nox1α(外显子 1 ~13)、Nox1β(外显子1 ~10,12,13)、Nox1γ(外显子 1 ~5,14)。选择性地剪接掉Nox1外显子11,则不能编码蛋白产生超氧化物。正常组织中Nox1主要在结肠中有低表达,血管平滑肌中、子宫、前列腺、破骨细胞、视网膜细胞也有微弱表达[8]。研究发现,很多肿瘤或者转化细胞系中都可以检测到 Nox1的高表达[9,10]。Nox1可以通过产生ROS来增加肿瘤细胞抵抗凋亡的能力从而促进肿瘤细胞生长[11]。最近有学者报道Nox1活性的高低与结肠癌细胞侵袭和转移能力有关[12]。因此,Nox1基因可以成为抑制肿瘤生长的分子靶点[13]。研究证明Nox1基因在人胃正常上皮黏膜细胞、慢性萎缩性胃炎、胃腺瘤及胃癌周围组织中表达水平较低,而在胃的肠型及弥漫型腺癌,包括印戒细胞癌中有高表达,表达Nox1的胃癌组织同时具有胃型和肠型两种表型,因此,Nox1在胃癌的发生、发展中起着重要作用[14]。
本实验设计构建了针对Nox1基因的siRNA并将其导入胃癌细胞株SGC-7901中,观察siRNA对Nox1基因表达的影响以及Nox1过度表达被抑制后胃癌细胞生长活性的变化,明确Nox1基因在胃癌发生、发展中的作用以及与胃癌细胞生存的关系。本实验的结果证实,Nox1 siRNA可在mRNA及蛋白质水平上显著抑制Nox1基因表达,胃癌细胞转染Nox1 siRNA后其生长受到明显抑制并出现大量凋亡。研究结果初步显示利用RNA干扰技术阻断胃癌Nox1基因的异常高表达可以诱导胃癌细胞凋亡、抑制胃癌细胞的生长,Nox1基因是胃癌生物治疗的一个新靶点。
[1]Oh YK,Park TG.siRNA delivery systems for cancer treatment[J].Adv Drug Deliv Rev,2009,61(10):850-862.
[2]Touyz RM,Briones AM,Sedeek M,et al.NOX isoforms and reactive oxygen species in vascular health[J].Mol Interv,2011,11(1):27-35.
[3]Rokutan K,Kawahara T,Kuwano Y,et al.NADPH oxidases in the gastrointestinal tract:a potential role of Nox1 in innate immune response and carcinogenesis[J].Antioxid Redox Signal,2006,8(9 -10):1573 -1582.
[4]刘 洁,沈文静,卢 瑶,等.小干扰RNA沉默hPTTG1基因对卵巢癌细胞增殖和凋亡的影响[J].中国病理生理杂志,2011,27(1):102-107.
[5]郭 亚,赵能江,林 玲,等.notch1基因对人胶质瘤U251细胞增殖和周期的影响[J].中国病理生理杂志,2010,26(6):1115 -1119.
[6]Peshavariya H,Dusting GJ,Jiang F,et al.NADPH oxidase isoform selective regulation of endothelial cell proliferation and survival[J].Naunyn Schmiedebergs Arch Pharmacol,2009,380(2):193 - 204.
[7]Juhasz A,Ge Y,Markel S,et al.Expression of NADPH oxidase homologues and accessory genes in human cancer cell lines,tumours and adjacent normal tissues[J].Free Radic Res,2009,43(6):523-532.
[8]Coant N,Ben Mkaddem S,Pedruzzi E,et al.NADPH oxidase 1 modulates WNT and NOTCH1 signaling to control the fate of proliferative progenitor cells in the colon[J].Mol Cell Biol,2010,30(11):2636 -2650.
[9]Kamata T .Roles of Nox1 and other Nox isoforms in cancer development[J].Cancer Sci,2009,100(8):1382 -1388.
[10]Laurent E,McCoy JW 3rd,Macina RA,et al.Nox1 is over-expressed in human colon cancers and correlates with activating mutations in K - Ras[J].Int J Cancer,2008,123(1):100-107.
[11]Puca R,Nardinocchi L,Starace G,et al.Nox1 is involved in p53 deacetylation and suppression of its transcriptional activity and apoptosis[J].Free Radic Biol Med,2010,48(10):1338 -1346.
[12]Gianni D,Taulet N,Zhang H,et al.novel and specific NADPH oxidase-1(Nox1)small-molecule inhibitor blocks the formation of functional invadopodia in human colon cancer cells[J].ACS Chem Biol,2010,5(10):981-993.
[13]Ushio-Fukai M,Nakamura Y .Reactive oxygen species and angiogenesis:NADPH oxidase as target for cancer therapy[J].Cancer Lett,2008,266(1):37 - 52.
[14]Tominaga K,Kawahara T,Sano T,et al.Evidence for cancer-associated expression of NADPH oxidase 1(Nox1)-based oxidase system in the human stomach[J].Free Radic Biol Med,2007,43(12):1627 -1638.
