血管紧张素-(1-7)对血管紧张素Ⅱ诱导的大鼠肾间质成纤维细胞活化的影响*
2011-07-31张小翠贺红焰夏纪毅樊均明欧三桃
张小翠,贺红焰,夏纪毅,樊均明,欧三桃,刘 建△
(泸州医学院附属医院1肾病内科,2病理教研室,3分子与免疫研究室,四川 泸州 646000)
肾素-血管紧张素系统(renin angiotensin system,RAS)在肾脏纤维化过程中发挥着重要作用。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)作为RAS的主要成员,导致氧化应激,血管收缩,细胞增殖,纤溶减弱,醛固酮分泌增加,造成高血压及心、脑、肾等一系列靶器官的损害。肾脏局部的AngⅡ在肾病进展中也起着重要作用。已有研究证实AngⅡ能诱导肾小管上皮细胞转分化及肾间质成纤维细胞活化为肌成纤维细胞,参与肾间质纤维化的形成[1,2]。血管紧张素 -(1-7)[Ang-(1-7)]是近年来发现的具有多种生物学活性的RAS新成员,被认为是AngⅡ的内源性拮抗因子,具有扩张血管,降低血压,利尿、利钠,调节水、盐、电解质平衡,以及抗增殖作用[3,4]。目前,对于在病理情况下,Ang- (1 -7)是否能通过抑制肾间质成纤维细胞活化,减少细胞外基质(extracellular matrix,ECM)的生成,从而减少肾小管间质区域ECM积聚,尚无直接证据。本研究将体外培养肾间质成纤维细胞,以AngⅡ作为刺激因子,探索Ang-(1-7)在肾间质成纤维细胞活化过程中的作用及可能机理,为治疗肾脏纤维化,阻止慢性肾脏疾病的进行性发展提供新的治疗思路。
材料和方法
1 材料
大鼠肾间质成纤维细胞株(NRK-49F)由四川大学华西医学院惠赠;Ang-(1-7)、AngⅡ和抗α-平滑肌肌动蛋白(alpha-smooth muscle actin,α -SMA)购自 Sigma;抗转化生长因子 -β1(transforming growth factor-β1,TGF-β1)抗胰岛素样生长因子-I(insulin like growth factor I,IGF-I)购自北京博奥森公司;Ⅰ型胶原 (collagen typeⅠ,ColⅠ)、TGF-β1和IGF-I检测ELISA试剂盒购自R&D;免疫组织化学试剂盒购自北京中杉金桥公司。
2 方法
2.1 NRK-49F的培养 复苏细胞后将其加入DMEM/F12培养基并接种于培养瓶中,放入培养箱。细胞呈单层贴壁生长,形态为长梭形。至细胞长至亚融合状态,用2.5%胰蛋白酶消化,传代,取生长旺盛的细胞做实验。
2.2 实验分组 将培养的肾间质成纤维细胞制成1×108/L的细胞悬液,接种在6孔板中1 cm×1 cm的盖玻片上,每孔加入细胞悬液2 mL,无血清DMEM培养24 h,使其生长同步化。按下列分组加入不同干扰因素进行实验。(1)对照组:仅加入含10%胎牛血清的DMEM/F12培养基;(2)AngⅡ组:加入含AngⅡ终浓度为10-6mol/L的DMEM/F12培养基;(3)Ang-(1-7)组:加入含 Ang-(1-7)终浓度为10-5mol/L的DMEM/F12培养基;(4)Ang-(1-7)+AngⅡ组:同时加入含AngⅡ终浓度为10-6mol/L和Ang-(1-7)终浓度均为10-5mol/L的DMEM/F12培养基。
2.3 细胞免疫化学法(SP法)测 α -SMA、TGF-β1、IGF-Ⅰ的表达 按上述分组加入不同药物干预72 h后,取出6孔板中细胞爬片,4%多聚甲醛固定15 min,0.1%Triton X-100处理细胞30 min,3%H2O2孵育10 min。分别加入小鼠抗大鼠α-SMA单抗(1∶50)、兔抗大鼠 TGF-β1多抗(1∶50)和兔抗大鼠IGF-I多抗(1∶50),4℃冰箱过夜。接下来按免疫组织化学染色试剂盒说明书进行操作,倒置荧光显微镜观察阳性信号,并照像以备数据分析。
2.4 酶联免疫吸附实验(ELISA)测 ColⅠ、TGF-β1和IGF-Ⅰ的表达 按上述分组加入不同药物干预72 h后,吸取培养上清液,按照ELISA试剂盒说明书操作,于波长450 nm的全光谱分光光度计上读取各孔的A值,分别检测ColⅠ、TGF-β1和IGF-I的含量。每组设6个复孔,以其均值作为统计数据。
3 统计学处理
图像分析采用Image-Pro Plus 6.0分析系统,对细胞α-SMA、TGF-β1和IGF-I的表达进行半定量分析。每张细胞爬片随机选5个视野,以细胞出现棕黄色颗粒为阳性细胞,以颗粒的平均光密度值反映阳性细胞蛋白表达量。使用SPSS 13.0统计软件包,结果以均数±标准差()表示,采用单因素方差分析。
结 果
1 免疫组化结果
培养72 h后,对照组细胞有少量α-SMA阳性表达,几无TGF-β1和IGF-Ⅰ阳性表达;Ang-(1-7)组与之类似;AngⅡ组细胞α-SMA、TGF-β1和IGF-Ⅰ表达明显增加;AngⅡ+Ang-(1-7)组与AngⅡ组比较,细胞α-SMA、TGF-β1和IGF-I表达明显减少(P<0.05),见表1、图1。
表1 各组细胞α-SMA、TGF-β1和IGF-Ⅰ的表达Table 1.The expression of α - SMA,TGF - β1and IGF - I in the cells(.n=6)
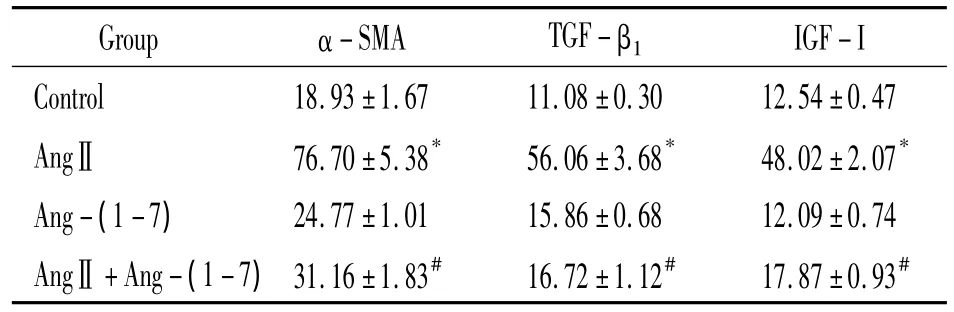
表1 各组细胞α-SMA、TGF-β1和IGF-Ⅰ的表达Table 1.The expression of α - SMA,TGF - β1and IGF - I in the cells(.n=6)
*P<0.05 vs control group;#P<0.05 vs AngⅡ group.
Group α-SMA TGF-β1IGF-I Control 18.93±1.67 11.08±0.30 12.54±0.47 AngⅡ 76.70±5.38* 56.06±3.68* 48.02±2.07*Ang-(1-7) 24.77±1.01 15.86±0.68 12.09±0.74 AngⅡ +Ang-(1-7)31.16±1.83# 16.72±1.12# 17.87±0.93#
2 ELISA结果
培养72 h后,与对照组比较,Ang-(1-7)组细胞上清液中ColⅠ、TGF-β1和IGF-Ⅰ的含量无明显改变,AngⅡ组细胞上清液中ColⅠ、TGF-β1和IGF-Ⅰ的含量明显升高(P<0.05)。与AngⅡ组比较,AngⅡ+Ang-(1-7)组细胞上清液中 ColⅠ、TGF-β1和 IGF-Ⅰ含量明显减少(P<0.05),见表2。
表2 细胞上清液中ColⅠ、TGF-β1和IGF-Ⅰ的含量Table 2.The content of ColⅠ,TGF-β1and IGF-Ⅰ in the cultured supernatants(ng/L·.n=6)
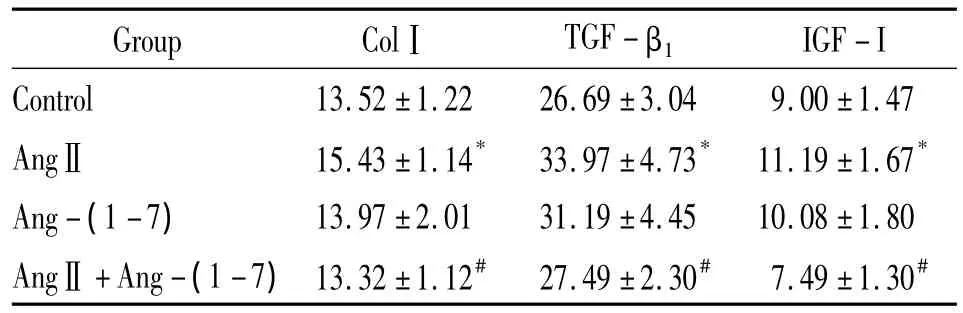
表2 细胞上清液中ColⅠ、TGF-β1和IGF-Ⅰ的含量Table 2.The content of ColⅠ,TGF-β1and IGF-Ⅰ in the cultured supernatants(ng/L·.n=6)
*P <0.05 vs control group;#P <0.05 vs AngⅡgroup.
Group ColⅠ TGF - β1IGF-I Control 13.52 ±1.22 26.69 ±3.04 9.00 ±1.47 AngⅡ 15.43 ±1.14* 33.97 ±4.73* 11.19 ±1.67*Ang-(1 -7) 13.97 ±2.01 31.19 ±4.45 10.08 ±1.80 AngⅡ +Ang-(1 -7)13.32 ±1.12# 27.49 ±2.30# 7.49 ±1.30#
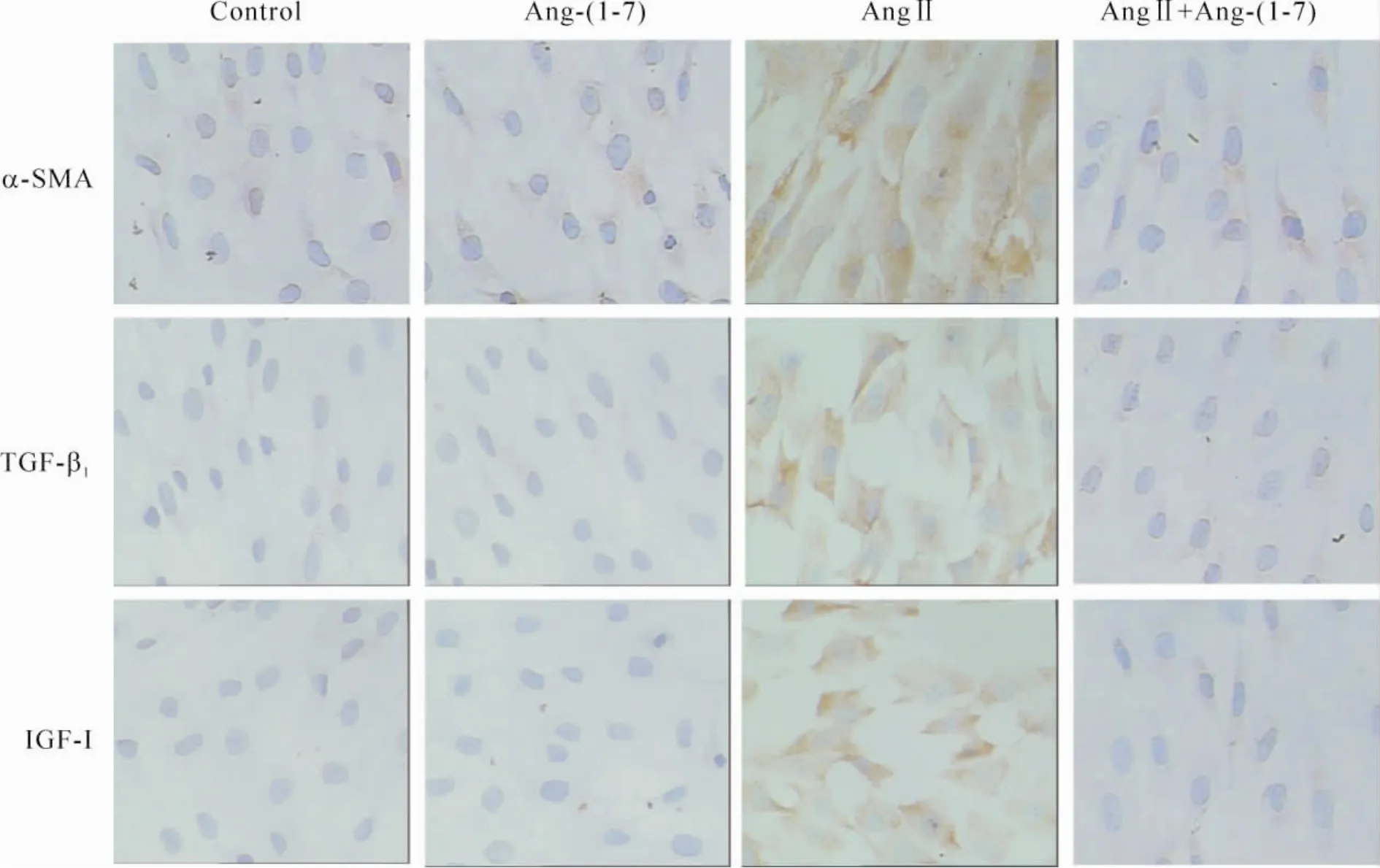
Figure 1.The expression of α-SMA,TGF-β1and IGF-Ⅰ detected by immunocytochemistry(×400).图1 免疫细胞化学检测α-SMA、TGF-β1和IGF-Ⅰ的表达
讨 论
肾间质纤维化是肾脏病发展至终末期肾功能衰竭的共同病理变化,成纤维细胞是肾间质纤维化的关键效应细胞。在病理情况下,各种致病因子使肾间质成纤维细胞活化成为表达α-SMA的肌成纤维细胞,后者具有分泌ECM和某些致纤维化因子和生长因子的功能。因此,肾间质成纤维细胞活化为肌成纤维细胞是造成肾间质纤维化的重要环节[5]。
RAS是体内重要的内分泌调节系统,机体局部和全身的激活可引起多种病理生理变化,肾间质纤维化的出现与肾脏局部RAS密切相关。AngⅡ是RAS的主要成员,作为一种促生长因子及促纤维化因子,它可以直接促进多种细胞因子的生成、细胞增生、肥大以及基质蛋白的积聚[6]。
以AngⅡ刺激体外分离培养的大鼠心肌成纤维细胞,发现AngⅡ可激活心肌成纤维细胞,并促进细胞外基质蛋白,如胶原和纤维连接蛋白的积聚,从而导致心脏重构,心肌纤维化[7]。Burns等[1]的研究小组体外培养大鼠肾小管上皮细胞,以AngⅡ干预3 d后,免疫细胞化学观察到细胞α-SMA表达增加,而E-钙黏蛋白表达减少,同时,RT-PCR也发现ColⅠ、ColⅣ和纤维连接蛋白等细胞外基质蛋白mRNA的表达增加,说明AngⅡ可诱导肾小管上皮细胞转分化,使细胞合成细胞外基质能力增强。本研究也观察到AngⅡ诱导NRK-49F细胞在体外活化,表达肌成纤维细胞特异性蛋白α-SMA,并改变其分泌功能,使ColⅠ合成增加,与上述研究一致。我们的研究还发现Ang-(1-7)可抑制AngⅡ诱导的NRK-49F细胞活化和ColⅠ的分泌增加。Burns等[1]进一步以AngⅡ和Ang-(1-7)共同干预大鼠肾小管上皮细胞证实Ang-(1-7)可抑制AngⅡ诱导的肾小管上皮细胞转分化和细胞外基质蛋白的表达。这与我们的实验结论相符。由此可知,Ang-(1-7)在抑制肾间质纤维化中发挥着重要作用。
在脏器纤维化形成的过程中,细胞因子网络起着关键作用,其中TGF-β1是目前已知最重要的致纤维化细胞因子之一,其突出作用是增加细胞外基质蛋白合成的同时减少其降解,改变ECM合成和降解的正常平衡,使细胞外基质沉积增多,最终引起纤维化。而IGF-I是一种结构和功能与胰岛素相似,能够强有力刺激细胞合成代谢的生长因子。已有大量研究表明,TGF-β1、IGF-I均可诱导多种细胞向肌成纤维细胞转化,并改变其分泌功能,加速脏器纤维化。Liu等[8]体外培养NRK-49F细胞,发现TGF-β1可使NRK-49F细胞活化,表达α-SMA增加。郑法雷等[9]用IGF-I干预体外培养的肾小管上皮细胞证实IGF-I也有与TGF-β1相同的作用,IGF-I呈剂量依赖性地诱导肾小管上皮细胞转分化,表达α-SMA,分泌细胞外基质FN、ColⅠ增加。本研究发现,在AngⅡ引起NRK-49F细胞活化,胶原分泌增加的同时,细胞因子TGF-β1和IGF-I的表达也增加。本研究还观察到Ang-(1-7)拮抗AngⅡ上述作用的同时也出现TGF-β1和IGF-I下调。因此,我们推测AngⅡ诱导肾间质成纤维细胞活化为肌成纤维细胞,表达α-SMA,分泌ColⅠ增加可能与细胞因子TGF-β1、IGF-I上调有关,而Ang-(1-7)则通过抑制TGF-β1、IGF-I上调而拮抗AngⅡ的作用。
综上,Ang-(1-7)可以抑制AngⅡ引起的肾间质成纤维细胞活化,其机理可能与Ang-(1-7)下调细胞因子TGF-β1、IGF-I的表达有关。这对临床治疗肾脏纤维化,阻止慢性肾脏疾病的进行性发展具有重要指导意义。
[1]Burns WC,Velkoska E,Dean R,et al.Angiotensin II mediates epithelial-to- mesenchymal transformation in tubular cells by ANG 1-7∕MAS-1-dependent pathways[J].Am J Physiol Renal Physiol,2010,299(3):F585-F593.
[2]Mezzano SA,Aros CA,Droguett A,et al.Renal angiotensin II up-regulation and myofibroblast activation in human membranous nephropathy[J].Kidney Int Suppl,2003,64(5):S39 - S45.
[3]Ferreira AJ,Hernández Prada JA,Ostrov DA,et al.Cardiovascular protection by angiotensin-converting enzyme 2:a new paradigm[J].Future Cardiol,2008,4(2):175-182.
[4]何建桂,黄艺仪,马 虹,等.血管紧张素-(1-7)对心肌肥厚的影响及其与细胞外信号调节激酶的关系[J].中国病理生理杂志,2005,21(9):1713 -1716.
[5]Yamate J,Kuribayashi M,Kuwamura M,et al.Differential immunoexpressions of cytoskeletons in renal epithelial and interstitial cells in rat and canine fibrotic kidneys,and in kidney - related cell lines under fibrogenic stimuli[J].Exp Toxicol Pathol,2005,57(2):135 -147.
[6]Yang F,Chung AC,Huang XR,et al.Angiotensin II induces connective tissue growth factor and collagen I expression via transforming growth factor-beta- dependent and-independent Smad pathways:the role of Smad3[J].Hypertension,2009,54(4):877 -884.
[7]Kawano H,Do YS,Kawano Y,et al.Angiotensin II has multiple profibrotic effects in human cardiac fibroblasts[J].Circulation,2000,101(10):1130 -1137.
[8]Liu C,Wang L,Xie XS,et al.Leukemia inhibitory factor suppresses renal interstitial fibroblast activation induced by transforming growth factor[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2010,41(3):448 -452.
[9]郑法雷,杨继红,吴 华,等.胰岛素样生长因子-I对体外培养的肾小管上皮细胞表型转化的作用[J].基础医学与临床,2005,25(5):459-464.
