低氧性肾间质纤维化和游泳运动对大鼠尾加压素Ⅱ及其受体表达的影响*
2011-07-31毛孙忠许芳芳胡良冈申屠杨萍范小芳龚永生
毛孙忠,邓 蔚,2,许芳芳,薛 峰,2,胡良冈,2,申屠杨萍,2,范小芳,2,龚永生,2△
(温州医学院1低氧医学研究所,肺心病研究室,2机能实验教学中心,机能实验学教研室,浙江 温州 325035)
尾加压素II(urotensin II,UⅡ)是迄今所知最强的缩血管活性肽[1],UⅡ及其受体——G蛋白偶联受体14(G-protein-coupled receptor 14,GPR14)分布广泛,在脑、肾、心及肺等均有表达。新近研究发现:UⅡ作为一种具有丝裂原作用的自分泌/旁分泌因子,参与了糖尿病性肾纤维化的进程[2];低氧可使机体UⅡ分泌增加[3],而低氧是慢性肾间质纤维化发生发展的重要因素之一,UⅡ与低氧性肾间质纤维化发生发展的关系尚不清楚。研究发现,运动通过降低循环UⅡ的含量对自发性高血压具有降压作用[4],运动可否通过调节UⅡ/GPR14对低氧性肾间质纤维化具有干预作用目前仍未明了。本研究旨在通过观察慢性低氧性肾间质纤维化大鼠UⅡ/GPR14的变化及游泳运动在其中的作用,以期为慢性低氧性肾间质纤维化的发病机制及防治提供新的思路。
材料和方法
1 慢性低氧性肾纤维化大鼠模型的制备及处理
清洁级雄性SD大鼠45只,体重300~350 g,由温州医学院实验动物中心提供。适应性喂养3 d后,随机均分成对照组、低氧组和游泳组。按以往的方法制备大鼠低氧模型[5],低氧组与游泳组置于自制常压低氧舱内,舱内吸入O2浓度9% ~11%,CO2浓度<3%,每天8 h,连续7周。游泳组在低氧3周后,于每天进舱2 h前进行无负重游泳运动,每次1 h,每天1次,共4周。游泳池为自制的圆形不锈钢桶,内径50 cm,水温为(33±2)℃,水深65 cm。对照组置于舱外,自由呼吸空气,其它饲养条件相同。
2 动物处理
动物饲养到规定时间后,用戊巴比妥钠(35 mg/kg,ip)麻醉,行左颈总动脉插管取血,分别置入含肝素及预冷含10%EDTANa2、抑肽酶抗凝的试管中,4000 r/min 4℃离心10 min,取上清液-70℃保存待测。放血处死动物后,取左肾组织约100 mg,待测组织羟脯氨酸的含量;取右肾组织约100 mg提取总RNA,待测UⅡ mRNA和GPR14 mRNA水平。
每组随机各取3只大鼠麻醉后,经左心室行主动脉插管,用0.9%生理盐水和4%多聚甲醛各约500 mL先后灌注固定。开腹,取右上半肾组织(横切)置于4%多聚甲醛中进一步固定24 h。按石蜡或冰冻切片技术要求取材、包埋、切片。
3 血液和肾匀浆指标的检测
化学比色法检测血液尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)的含量;制备10%肾组织匀浆,化学比色法检测肾组织羟脯氨酸(hydroxyproline,Hyp)含量,以考马斯亮蓝法测定蛋白含量,以上试剂盒由南京建成生物工程研究所提供。ELISA法测定血浆UⅡ含量,试剂盒由Phoenix Pharm aceuticals Inc.提供。严格按说明书操作。
4 肾间质纤维化指标的检测
肾组织石蜡包埋切片,切片厚度约5 μm,苦味酸-酸性品红(van Gieson,VG)染色观察肾间质纤维化情况(胶原纤维为鲜红色)。试剂盒由福州迈新生物技术开发有限公司提供。
5 肾组织UⅡmRNA和GPR14 mRNA表达水平的检测
采用RT-PCR法检测肾组织 UⅡ mRNA和GPR14 mRNA的表达水平。Trizol一步法制备大鼠肾组织总RNA。常规PCR法扩增产物,UⅡPCR引物的上、下游序列分别为5'-GAG CAG ACA CCC AGC CAG ACT T-3'和5'-TGC CCA GTG AGA GCC TTC CT-3'(PCR产物为306 bp,退火温度为60℃);GPR14为5'-GCC TGG CTT GGT CAT TGG G-3'和5'-GCA GAG TGT AGA GGA AGG GAT TGA TG-3'(PCR产物为293 bp,退火温度为68℃);β-actin为5'-CTG AGA GGG AAA TCG TGC GTG AC -3'和5'- GTG CTA GGA GCC AGG GCA GTA ATC-3'(PCR产物为357 bp,退火温度为68℃),引物均由赛百盛基因有限公司合成。扩增产物行1.25%琼脂糖凝胶电泳分离,经凝胶成像仪(Gene Genius)分析结果,分别计算UⅡ和GPR14 mRNA/β-actin条带吸光度的比值作为其mRNA的相对含量。重复3次实验。
6 肾组织UⅡ蛋白的定位
选择右肾上半中部,应用恒冷冰冻切片机横位连续切片,厚约10 μm。免疫组织染色采用SP法,Ⅰ抗浓度为4 mg/L,4℃过夜,DAB显色,苏木素复染,阳性结果为棕黄色颗粒沉积。用PBS液代替Ⅰ抗作为阴性对照。每个标本取3张切片,每张切片随机选取10个非重复视野,光镜下观察肾小球单位及其肾小管染色情况,进行定位研究。Image-Pro Plus 6.0图像分析软件检测其平均吸光度值(absorbance,A)及累积吸光度值(IA)作为UⅡ蛋白表达的相对含量。
7 统计学处理
结 果
1 BUN、Scr、血浆UⅡ和肾组织Hyp含量的比较
低氧组Scr和BUN含量较对照组分别低18.5%和14.1%(均P<0.05),而游泳组与低氧组间无显著差别。低氧组肾组织Hyp含量比对照组高42.9%(P<0.01),而游泳组较低氧组低26.1%(均P<0.05)。低氧组血浆UⅡ含量较对照组高380.8%(P<0.01),而游泳组较低氧低42.6%(P<0.01),见表1。
表1 各组BUN、Scr、血浆UⅡ和肾组织Hyp含量的比较Table 1.Comparison of BUN,Scr,plasm UⅡ and Hyp in renal tissues in rats(.n=12)

表1 各组BUN、Scr、血浆UⅡ和肾组织Hyp含量的比较Table 1.Comparison of BUN,Scr,plasm UⅡ and Hyp in renal tissues in rats(.n=12)
*P <0.05,**P<0.01 vs control group;##P <0.01 vs hypoxia group.
Group Scr(μmol/L)BUN(mmol/L)Hyp(mg/g)UⅡ(μg/L)Control 57.2 ±11.0 10.55 ±1.60 0.408±0.045 2.13±0.67 Hypoxia 46.6 ±10.7* 9.06 ±1.47* 0.583±0.200** 10.24 ±1.27**Swimming 42.7 ±7.0 8.75 ±0.71 0.431±0.039## 5.88 ±0.91##
2 肾组织UⅡmRNA和GPR14 mRNA表达的比较
低氧组肾组织UⅡ mRNA表达较对照组上调104.5%,而游泳组较低氧组下调33.2%(均 P<0.01);低氧组肾组织GPR14 mRNA较对照组上调35.4%(P<0.01),而游泳组与低氧组间无显著差别(P >0.05),见表2、图1。
表2 各组肾组织UⅡ和GPR14 mRNA表达的比较Table 2.Comparison of the mRNA expression of UⅡ and GPR14 in renal tissues of rats(.n=9)
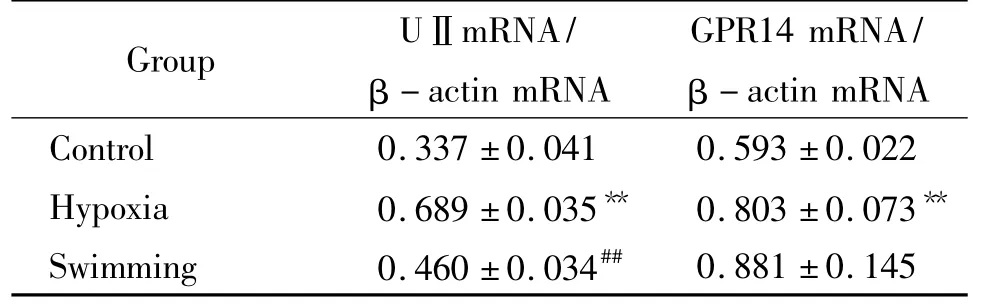
表2 各组肾组织UⅡ和GPR14 mRNA表达的比较Table 2.Comparison of the mRNA expression of UⅡ and GPR14 in renal tissues of rats(.n=9)
**P <0.01 vs control group;##P <0.01 vs hypoxia group.
0.881 ±0.145 Control 0.337 ±0.041 0.593 ±0.022 Hypoxia 0.689 ± 0.035** 0.803 ± 0.073**Swimming 0.460 ±0.034##
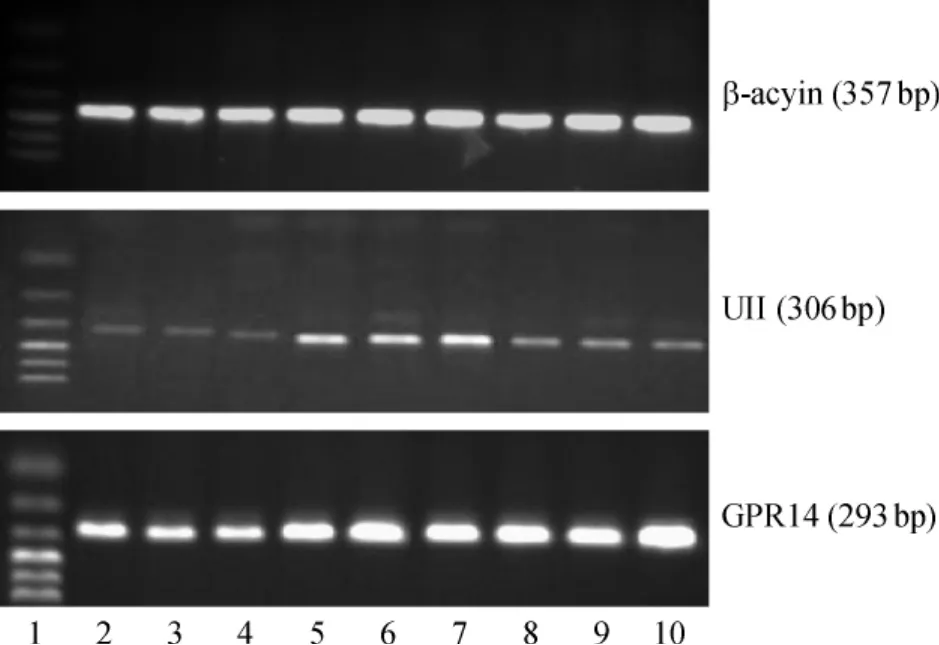
Figure 1.Results of RT-PCR for UⅡmRNA and GPR14 mRNA in renal tissues of rats.1:marker;2 ~ 4:control group;5~7:hypoxia group;8~10:swimming group.图1 各组肾组织RT-PCR电泳结果
3 肾组织UⅡ蛋白表达的比较
免疫组化结果分析显示低氧组肾组织UⅡ蛋白的A及IA值表达均较对照组明显上调(P<0.01),而游泳组较低氧组明显下调(P<0.01)。光镜下观察显示:对照组大鼠肾组织棕黄色颗粒主要见于肾皮质的肾小管上表达,肾小球内未见明显表达;低氧组肾组织棕黄色颗粒表达明显强于对照组,肾皮质的肾小管上表达强阳性,肾小囊囊壁和肾血管内皮细胞层可见少量表达;游泳组棕黄色颗粒表达明显低于低氧组,肾皮质的肾小管上表达较强。阴性对照细胞胞核及胞膜呈蓝色,胞浆及整片组织呈淡蓝色,见表 3、图2。
表3 各组肾组织UⅡ蛋白含量的比较Table 3.Comparison of the protein expression of UⅡin renal tissues of rats(.n=12)

表3 各组肾组织UⅡ蛋白含量的比较Table 3.Comparison of the protein expression of UⅡin renal tissues of rats(.n=12)
**P <0.01 vs control group;##P <0.01 vs hypoxia group.
Group A IA Control 0.205 ±0.045 2353 ±541 Hypoxia 0.461 ± 0.030** 5232 ±493**Swimming 0.299 ±0.031## 3422 ±525##
4 肾组织VG染色观察结果的比较
光镜观察结果显示,对照组肾血管及周围见少量鲜红色染色,低氧组肾血管及周围见较多鲜红色染色,即间质细胞增生、胶原纤维明显增多,游泳组肾血管及周围鲜红色染色面积较少,见图3。
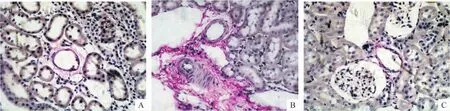
Figure 3.Histopathological changes in renal tissues of rats(VG staining,×400).A:control group;B:hypoxia group;C:swimming group.图3 各组肾组织病理学检查
讨 论
慢性肾脏病(chronic kidney disease,CKD)是一组进行性发展的慢性疾病,具有很高的死亡率和致残率。肾间质纤维化是CKD进展到终末期时的共同病变过程,延缓或防止肾纤维化是防治CKD进展的关键。低氧是慢性肾间质纤维化发病重要的致病因素之一。有关低氧引起肾脏纤维化的机制目前尚不清楚,氧化应激、血管活性物质失衡、炎症反应、增殖与凋亡等多因子、多因素都与该病理生理进程有关[6]。目前认为促纤维化细胞因子,如转化生长因子 β(transforming growth factor β,TGF - β)、内皮素1等,在其中起着非常重要的作用[7]。
UⅡ是迄今为止发现的收缩血管活性最强的多肽(较之前被认为收缩血管活性最强的内皮素-1还强6-28倍)。UⅡ及其受体GPR14在体内分布广泛,在心血管、肾脏、肺、神经和内分泌组织均有表达[8]。UⅡ可通过内分泌、旁/自分泌的方式发挥多种生物学效应,对心脑血管稳态、水盐平衡及炎症免疫等具有重要的调节作用,参与了高血压、动脉粥样硬化和糖尿病等疾病的进程[9]。新近研究发现,UⅡ作为一种有丝裂原作用的自分泌/旁分泌的生长因子,具有促细胞增殖和促细胞外基质表达等效应[10],UⅡ是否参与低氧性肾间质纤维化的进程目前尚不清楚。羟脯氨酸是反映组织胶原含量的指标,胶原堆积是肾纤维化的表现。本实验结果发现:慢性低氧大鼠肾脏组织羟脯氨酸含量较正常对照组显著增高,VG染色显示胶原纤维染色的强度和面积均明显升高,同时血浆UⅡ含量显著升高,肾组织UⅡ mRNA和蛋白的表达均显著上调,GPR14 mRNA的表达亦显著性上调,提示UⅡ/GPR14参与了慢性低氧致肾脏纤维化的进程。Zhang等[3]的研究也发现UⅡ与TGF-β介导的糖尿病性肾纤维化密切相关。
目前临床上根据肾脏纤维化发病机制采取药物干预方法,对延缓CKD的进展、改善CKD预后取得了一定的疗效,但仍有25%左右的CKD患者肾脏病变进行性发展,因此改进当前单纯药物干预的治疗方略尤显重要。运动对肾脏功能的影响历来为运动医学所重视。有研究表明,运动对自发性高血压具有降压作用与其降低循环UⅡ含量有关[3],运动对低氧性肾间质纤维化是否具有干预作用、该干预作用是否与UⅡ/GPR14有关目前尚未明了。研究表明,适度的有氧运功可改善肾功能,而剧烈运动可引起肾损伤,甚至出现急性肾衰竭[11]。关宇光等[12]发现长期有氧运动可以降低血浆UⅡ含量,每天1 h无负重游泳训练可使大鼠血浆UⅡ含量下降,而1次3%负重力竭游泳运动后血浆UⅡ含量却显著升高,故本实验大鼠每天游泳定为1 h无负重游泳运动。另外,Scr和BUN是反映肾功能的常用指标,急慢性肾功能衰竭时Scr和BUN均明显增高。本实验结果亦发现该强度下的游泳组大鼠BUN和Scr含量与其它组别无明显差异。
本实验发现,游泳运动4周后,游泳组大鼠肾组织羟脯氨酸值较低氧组显著降低,VG染色显示胶原纤维染色强度及面积也明显降低,提示长期适度游泳运动对慢性低氧肾间质纤维化具有防治作用。实验还发现,游泳组大鼠血浆UⅡ含量较低氧组显著降低,肾组织UⅡmRNA和蛋白表达亦显著下调,而GPR14 mRNA的表达2组间无显著差异。有报道,运动可降低血浆UⅡ含量对自发性高血压具有降压作用[4],提示适度游泳运动对慢性低氧肾间质纤维化的防治作用与降低循环UⅡ含量和改善肾组织UⅡ的表达有关。长期有氧运动后,循环中UⅡ含量的降低一方面可通过降低UⅡ对血管的直接收缩作用和改善缩/舒血管活性物质失衡[8],进而促进肾脏血供,缓解肾缺血缺氧症状;另一方面减弱UⅡ促增殖作用及对肾小管上皮细胞的促丝裂原作用,改善肾脏组织促纤维化细胞因子与抗纤维化细胞因子(如间质金属蛋白酶-2)间的失衡,缓解肾上皮细胞间质化和肾间质成纤维细胞活化的发生[7],进而延缓肾纤维化的进程。今后可以通过或配合与UⅡ生物学效应有关的拮抗剂来达到强化防治低氧性肾间质纤维化的效果,有待进一步的研究。
本实验结果提示:慢性低氧性肾纤维化大鼠UⅡ及其受体的表达上调;适度游泳运动对慢性低氧肾间质纤维化具有防治作用,并下调UⅡmRNA与蛋白的表达,推测该作用可能与调节UⅡ的表达有关,但尚有待进一步研究证实。
[1]Carotenuto A,Grieco P,Campiglia P,et al.Unraveling the active conformation of urotensinⅡ[J].J Med Chem,2004,47(7):1652-1661.
[2]Tian L,Li C,Qi J,et al.Diabetes-induced upregulation of urotensinⅡand its receptor plays an important role in TGF-β1-mediated renal fibrosis and dysfunction[J].Am J Physiol Endocrinol Metab,2008,295(5):E1234- E1242.
[3]Zhang Y,Li J,Cao J,et al.Effect of chronic hypoxia on contents of urotensinⅡand its functional receptors in rat myocardium[J].Heart Vessels,2002,16(2):64 -68.
[4]于明月,边树怀,张 扬,等.自发性高血压大鼠血浆尾加压素Ⅱ的变化及运动干预的影响[J].河北医科大学学报,2006,27(1):28-29.
[5]陈静炯,龚永生,郑绿珍,等.慢性低氧对大鼠肺血管左旋精氨酸/一氧化氮途径的影响[J].中国病理生理杂志,2001,17(9):858-861.
[6]Fine LG,Norman JT.Chronic hypoxia as a mechanism of progression of chronic kidney diseases:from hypothesis to novel therapeutics[J].Kidney Int,2008,74(7):867 -872.
[7]Cho MH.Renal fibrosis[J].Korean J Pediatr,2010,53(7):735-740.
[8]伍 蕊,陈亚红,姚婉贞,等.硫化氢供体对急性支气管哮喘大鼠尾加压素Ⅱ表达的影响[J].中国病理生理杂志,2010,26(9):1781 -1785.
[9]Ross B,McKendy K,Giaid A.Role of urotensinⅡin health and disease[J].Am J Physiol Regul Integr Comp Physiol,2010,298(5):R1156 - R1172.
[10]Zhang YG,Li YG,Liu BG,et al.UrotensinⅡaccelerates cardiac fibrosis and hypertrophy of rats induced by isoproterenol[J].Acta Pharmacol Sin,2007,28(1):36-43.
[11]Ohta T,Sakano T,Igarashi T,et al.Exercise-induced acute renal failure associated with renal hypouricaemia:results of a questionnaire - based survey in Japan[J].Nephrol Dial Transplant,2004,19(6):1447 -1453..
[12]关宇光,王安利,杜 屏.不同负荷游泳运动对大鼠血浆尾加压素Ⅱ的影响[J].中国运动医学杂志,2008,27(1):95-96.
