MMP3在早期骨关节炎模型软骨下骨的表达及其意义*
2011-07-31张荣凯卢华定陈郁鲜宋炎成蔡道章
张荣凯,方 航,卢华定,陈郁鲜,宋炎成,曾 春,赵 庆,蔡道章△
(1中山大学附属第五医院骨科1区,广东 珠海 519000;2中山大学附属第三医院关节外科,广东 广州 510630)
骨性关节炎(osteoarthritis,OA)是一种退变性关节疾病,主要是关节软骨的退变降解,表现为进行性软骨变薄、纤维化、糜烂、裂隙、肉眼下溃疡及全层关节面消失等,并涉及关节的其它组织,包括关节的滑膜、软骨下骨及肌肉、韧带等结构的改变[1]。以往对OA的病因研究多集中于关节软骨的破坏,目前越来越多的研究表明,软骨下骨改变在OA发病过程中起着积极作用,软骨下骨改变有可能先于关节软骨的变化[2-3]。最近研究表明,破骨细胞在早期骨关节炎疾病进程中起了重要作用,在骨关节炎早期,软骨下骨的破骨细胞活动增强,从而导致骨吸收作用明显强于成骨作用,进而引起软骨下骨的骨量丢失,骨质量下降。在软骨下骨的骨吸收作用中,基质金属蛋白酶(matrix metalloproteinases,MMPs)起了重要的作用,可降解关节中的骨基质,特别是破骨细胞表达的基质金属蛋白酶3(matrix metalloproteinase 3,MMP3)可能在软骨下骨的骨吸引中起重要作用[4-5]。然而,有关早期骨关节炎软骨下骨MMP3表达的研究在国内外报道极少。本研究利用大鼠膝关节骨关节炎模型,首次从基因及蛋白水平全面研究早期骨关节炎软骨下骨的MMP3表达情况,为阐述其在骨关节炎致病机制中的重要作用提供依据,有利于OA的早期诊断和治疗。
材料和方法
1 动物选择与分组
选取大小、体重相似(10周龄,体重300~325 g)的雄性SD大鼠60只,由中山大学动物实验中心提供,并饲养于该实验中心SPF级屏蔽环境中,大鼠分笼饲养,自由饮水和进食。动物房温度(23±3)℃,相对湿度(60±5)%,每天照明12 h。大鼠编号后,随机分为对照组(n=30)和实验组(n=30)。
2 主要的试剂及仪器
MMP3多克隆抗体(Abcam);山羊抗鼠IgGⅡ抗(DAKO),DAB显色液(康为世纪),蛋白酶 K(Sigma),EDTA(Sigma),苏木素(Sigma),E.Z.N.A.® Tissue RNA Kit(Omega Bio-Tek),All-in-OneTMqPCR Mix(GeneCopoeia),Allin-OneTMqPCR Primer(GeneCopoeia),SX手术显微镜(安信化学仪器制造有限公司),电动磨钻(Strong 90,New Power),石蜡切片机(Leica),光学显微镜(Leica DMI 3000 B),iQ5 Real-Time PCR Detection System(Bio-Rad),分光光度计(ND -1000,Thermo Scientific)等。
3 大鼠膝关节骨关节炎模型的建立
实验组大鼠用10%水合氯醛(4 mL/kg)腹腔内注射麻醉后,选取右膝关节,去毛后,常规消毒铺巾,依次切开皮肤、膝关节囊,行“内侧副韧带切断+内侧半月板切除”,用5-0可吸收线独立缝合关节囊,以5-0丝线间断缝合伤口。术后肌注1次青霉素40000 U抗感染,待麻醉苏醒后腹腔注射曲马多(10 mg/kg)止痛。同样的方法处理对照组大鼠,但不切断内侧副韧带,也不切除内侧半月板。
4 标本获取及处理
4.1 标本的初步处理 于术后1、2、4周分别随机抓取大鼠,对照组、实验组各10只。于每一时点,对照组、实验组各5只解剖分离右膝关节,在解剖显微镜下对膝关节面进行观察,大体观察后立即将骨组织置10%多聚甲醛4℃固定保存。另5只分离出膝关节后将股骨髁从骺板处折断后立即将股骨髁放入液氮保存,用于进一步分离软骨下骨组织及提取骨RNA。
4.2 标本的进一步处理 膝关节标本置10%多聚甲醛4℃固定48 h后,放入20%EDTA液于4℃冰箱内脱钙4周,每3 d换脱钙液1次。常规脱水、浸蜡后包埋,沿膝关节矢状面切片,每隔300 μm切片1次,每张切片厚度5 μm,行苏木精-伊红(HE)及番红O-固绿(Safranin O-fast green)染色进行组织学观察。
4.3 软骨下骨的分离及其RNA的提取 将保存于液氮下的股骨髁拿出,放入液氮容器内并固定,使用微动力磨钻于液氮保护下打磨清除关节软骨及骺板组织,操作中使用手术显微镜确保完全清除其它组织。将分离得到的软骨下骨放入液氮研磨器中,将骨块研磨成粉末后,使用E.Z.N.A.® Tissue RNA Kit,按试剂盒操作说明提取软骨下骨RNA,用分光光度计法及琼脂糖凝胶电泳法鉴定RNA的质量。
5 实时荧光定量PCR
采用染料法(SYBR Green I)进行相对定量分析,按照ΔΔCt解析法来进行实验设计,以GAPDH作为内参照基因。MMP3上游引物 5'-CGGTGGCTTCAGTACCTTTC -3',下游引物5'-ACCTCCTCCCAGACCTTCA-3'。标本 RNA反转录、qPCR反应体系建立实验步骤按试剂盒说明操作。PCR反应条件,采用了标准的三步法程序进行反应:95℃预变10 min 1个循环;95℃ 10 s,60℃ 20 s,72℃ 10 s,40个循环。
6 免疫组化检测
每块骨组织连续切取5张切片(每张厚度5 μm,相距300 μm)行免疫组化染色:采用SABC(链霉亲和素生物素酶复合物)法,阴性对照以PBS代替Ⅰ抗,以人乳腺癌组织切片为阳性对照。切片常规脱蜡,水化,用3%H2O2避光封闭15 min,柠檬酸高温高压8 min和蛋白酶K修复抗原后,加MMP3Ⅰ抗4℃下孵育过夜,将带辣根过氧化酶Ⅱ抗37℃下孵育20 min,DAB溶液光镜下控制显色,漂洗后苏木素复染、脱水、透明,中性树脂封片,切片置于40倍显微镜下观察切片。
7 统计学处理
采用SPSS 16.0软件进行统计学分析,数据以均数±标准差(),均数比较采用t检验,α=0.05。
结 果
1 SD大鼠膝关节骨关节炎模型的成功建立
1.1 术后膝关节大体标本观察结果 术后1周,实验组与对照组与股骨髁软骨面光滑如常,关节面无破损;术后2周,实验组股骨内侧髁与胫骨内侧平台软骨表面稍显粗糙,极少关节面见轻微糜烂,外侧股骨髁光滑如常;术后4周,实验组双侧股骨髁均见明显的软骨面轻度糜烂,部分关节溃疡磨损,而且内侧股骨髁比外侧更严重,无骨赘形成。
1.2 术后膝关节病理切片观察结果 术后1周,实验组与对照组软骨表面光滑平整,细胞数目和软骨细胞排列无明显差异,番红O-固绿染色不均匀,特别是表层染色减退,但潮线尚完整,见图1A、B、G、H;术后2周,软骨表面见较多裂隙,有的甚至伸入辐射层,软骨细胞数量明显增多,结构开始有点紊乱,可见软骨细胞簇集,表层细胞变圆及其片状剥脱现象,软骨破坏较重的关节面可见表层软骨变薄,部分关节面纤维组织覆盖,见图1C、D、I、J;术后4周,看见局部表面,软骨细胞脱落消失,直到钙化层和软骨下骨交界处,此处表层覆盖大量的纤维素,细胞数目整体明显增多,细胞簇集现象明显,见图1E、F、K、L。
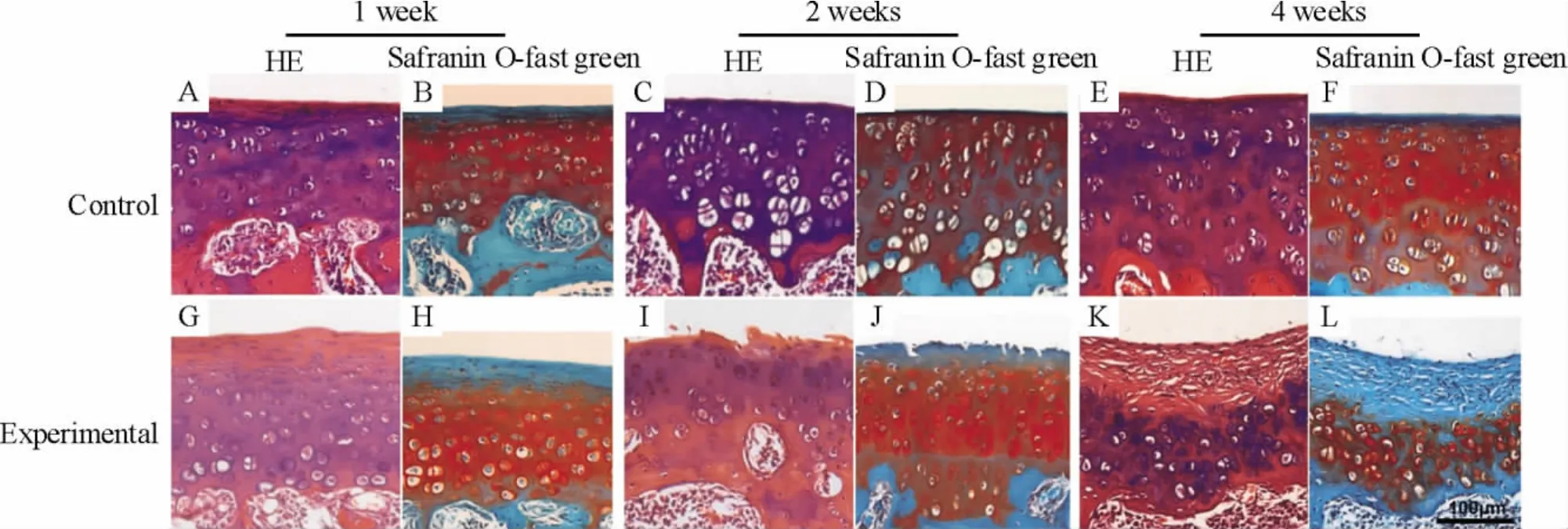
Figure 1.Histological analysis of cartilage degradation at each time point post-surgery(×20).A,C,E,G,I,K:sections stained with HE;B,D,F,H,J,L:sections stained with safranin O - fast green.Scale bar=100 μm.图1 实验组与对照组标本切片苏木精-伊红(HE)及番红O-固绿染色
以上观察结果表明:以“内侧副韧带切断+内侧半月板切除”造成的膝关节不稳,大鼠膝关节骨关节炎表现随着术后时间进展,关节面的损伤慢慢加重,本实验成功建立大鼠膝关节骨关节炎模型[6]。
2 软骨下骨RNA提取结果
实验组与对照组股骨髁标本,用液氮下微动力磨钻打磨的方法分离得到的软骨下骨,进一步提取的骨RNA浓度为(357.71±157.74)mg/L,A260/A280值为2.030±0.014;琼脂糖凝胶电泳法对每个标本RNA分析显示:RNA电泳条带清晰,28S∶18S约为2∶1,表明RNA完整无降解。以上结果表明:本方法在分离软骨下骨时能有效避免骨RNA的降解,确保得到高质量的骨RNA用于后继的qPCR实验。
3 软骨下骨MMP3 mRNA的表达量分析结果
实时荧光定量PCR结果示:实验组与假手术组相比较,在术后1周,软骨下骨的MMP3在实验组的表达量明显升高,是对照组的8.34倍(P<0.05);术后2周,MMP3在实验组的表达量也升高,是对照组的4.85倍(P<0.05),但相对于术后1周,表达量有所下降;术后4周,2组的MMP3表达量无差异表达,见图2。以上结果表明,软骨下骨中的MMP3在极早期骨关节炎的表达量明显增加,提示了MMP3在极早期骨关节炎的软骨下骨中可能起了重要的作用。
4 软骨下骨的MMP3免疫组化结果
如图3所示,术后1、2周,实验组软骨下骨区检测到大量的MMP3阳性细胞,以小单核细胞及多核巨细胞为主,其中多核巨细胞胞浆MMP3阳性较明显;特别在靠近骨小梁区,破骨细胞样MMP3阳性多核巨细胞明显增多。而且,术后1周阳性细胞比例明显高于术后2周,阳性的强度也较高。术后4周实验组、对照组及阴性对照组织切片均未检测到MMP3阳性细胞。免疫组化检测结果从蛋白水平验证了早期骨关节炎软骨下骨MMP3的表达,而且与荧光定量PCR的结果相一致。

Figure 2.MMP3 mRNA expression detected by real-time PCR at each time point.*P <0.05 vs control group.图2 实验组与假手术组软骨下骨MMP3 mRNA的表达
讨 论
软骨下骨改变在OA发病过程中起着积极作用,特别是与关节软骨紧靠的软骨下骨,其与软骨的相互作用可能也越密切。研究早期OA的软骨下骨改变对于OA的早期诊断、早期治疗有着重大意义[7]。软骨下骨包括软骨下骨板以及紧靠其下方的骨小梁、血管和小梁间的腔隙,在OA病例中,常可以观察到软骨下骨硬化、囊性化、无菌性坏死等改变[8]。有研究表明软骨下骨中产生的炎症因子,可改变软骨细胞的代谢,进而引起关节软骨破坏及进行性恶化[9-10]。
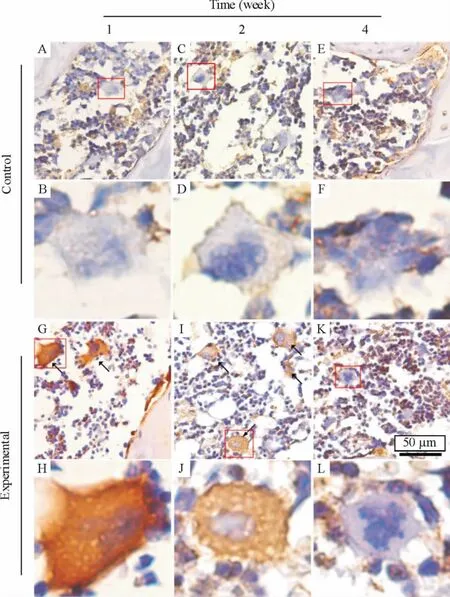
Figure 3.Immunohistochemical staining of MMP3 in subchondral bones(A,C,E,G,I,K)and polynuclear giant cells(B,D,F,H,J,L)in experimental group and control group at each time point post-surgery(×40).图3 软骨下骨MMP3免疫组化图
然而,目前缺乏早期骨关节炎软骨下骨活体组织的相关研究报道,其原因主要是:(1)获取合适的早期OA的人软骨下骨标本十分困难,而研究晚期OA的软骨下骨标本因硬化、囊性变等晚期改变导致难以推断其早期的分子机制;(2)利用细胞培养技术研究的破骨细胞及成骨细胞的功能容易受培养环境影响,并不能真正地反映活体组织软骨下骨细胞功能改变;(3)获取能用于后继研究的高质量软骨下骨RNA难度较大。因此,本实验设计使用的SD大鼠膝关节骨关节炎模型,结合首创的液氮下微动力磨钻打磨分离膝关节软骨下骨的方法,有效避免了软骨下骨RNA的降解,很好地解决以上矛盾,是软骨下骨基因表达相关研究值得推广的方法。
本骨关节炎动物模型与其它动物模型相比,具有体积小、价廉、易饲养、解剖及生理学特点与人类相似的特点。有研究表明,使用前交叉韧带+内侧半月板切除建立的膝关节骨关节炎模型在术后4周与人类的早期膝关节骨关节炎,特别是创伤后(如半月板损伤、交叉韧带损伤等)膝关节骨关节炎,在病理、病生以及形态学改变等方面极为相似[6,11],更重要的是大鼠的基因组已明确,可以利用该动物模型从基因水平研究软骨下骨在骨关节炎疾病进程不同时点的分子机制。
MMP3属于基质溶解酶,广泛参与包括蛋白聚糖、纤维结合蛋白、层黏连蛋白、凝胶、Ⅳ型胶原和Ⅸ型胶原等各种细胞外基质的降解过程,是破骨细胞骨吸收作用的重要因素之一。Hayami等[6]研究指出本动物模型在术后2周软骨下骨骨量明显减少,本研究中,关节不稳定因素导致膝关节的应力改变是唯一的实验因素,这一因素启动了软骨下骨表达MMP3,MMP3参与骨基质的降解,导致骨量减少并在术后2周引起了形态学改变,这个实验结果与其他学者研究的结果相似[5]。有趣的是,Shibakawa等[4]利用人类晚期膝关节骨关节炎标本,用免疫组化技术在紧靠钙化软骨层的软骨下骨部位也检测到MMP3的高表达,并指出MMP3的表达进一步引起了关节软骨的退变,提示了本实验结果与人类骨关节炎疾病极为相似。但是,本实验只研究了早期骨关节炎软骨下骨MMP3的表达,缺乏在更早期及更晚期的软骨下骨MMP3表达信息;此外,MMP3的基因及蛋白表达是如何调控的,目前尚不清楚,这些都值得进一步深入研究。
[1]Lohmander LS.What can we do about osteoarthritis?[J].Arthritis Res,2000,2(2):95 -100.
[2]Radin EL,Rose RM.Role of subchondral bone in the initiation and progression of cartilage damage[J].Clin Orthop Relat Res,1986,(213):34 -40.
[3]Lajeunesse D,Reboul P.Subchondral bone in osteoarthritis:a biologic link with articular cartilage leading to abnormal remodeling[J].Curr Opin Rheumatol,2003,15(5):628-633.
[4]Shibakawa A,Yudoh K,Masuko-Hongo K,et al.The role of subchondral bone resorption pits in osteoarthritis:MMP production by cells derived from bone marrow[J].Osteoarthritis Cartilage,2005,13(8):679-687.
[5]Chang HH,Wu CB,Chen YJ,et al.MMP -3 response to compressive forces in vitro and in vivo[J].J Dent Res,2008,87(7):692-696.
[6]Hayami T,Pickarski M,Zhuo Y,et al.Characterization of articular cartilage and subchondral bone changes in the rat anterior cruciate ligament transection and meniscectomized models of osteoarthritis[J].Bone,2006,38(2):234 -243.
[7]Muraoka T,Hagino H,Okano T,et al.Role of subchondral bone in osteoarthritis development:a comparative study of two strains of guinea pigs with and without spontaneously occurring osteoarthritis[J].Arthritis Rheum,2007,56(10):3366 -3374.
[8]Madry H,van Dijk CN,Mueller-Gerbl M,et al.The basic science of the subchondral bone[J].Knee Surg Sports Traumatol Arthrosc,2010,18(4):419-433.
[9]Westacott CI,Webb GR,Warnock MG ,et al.Alteration of cartilage metabolism by cells from osteoarthritic bone[J].Arthritis Rheum,1997,40(7):1282 -1291.
[10]Hayami T,Pickarski M,Wesolowski GA,et al.The role of subchondral bone remodeling in osteoarthritis:reduction of cartilage degeneration and prevention of osteophyte formation by alendronate in the rat anterior cruciate ligament transection model[J].Arthritis Rheum,2004,50(4):1193-1206.
[11]查振刚,姚 平,吴 昊.维骨力预防骨关节炎软骨退变的实验研究[J].中国病理生理杂志,2004,20(6):1030-1034.
