靶向PERK基因的shRNA真核表达载体的构建及对内质网应激状态下L02肝细胞凋亡的影响*
2011-07-31杨朝霞
曹 洁,杨朝霞△,沈 薇△,姚 隆
(1重庆医科大学附属第二医院消化科,重庆 400010;2江津区中心医院重症医学科,重庆 402260)
PERK[RNA-dependent protein kinase(PKR)-like endoplasmic reticulum kinase]是位于内质网的Ⅰ型跨膜蛋白,N端位于内质网腔,非应激时与葡萄糖调节蛋白(glucose-regulated protein,GRP)78形成复合物,C端位于胞质,具有丝氨酸/苏氨酸蛋白激酶活性。在内质网应激(endoplasmic reticulum stress,ERS)状态下,PERK与GRP78解离,发生自身联合,自身磷酸化而激活,激活的PERK磷酸化真核翻译起始因子-2的α亚基(eIF2-α)51位的丝氨酸,从而阻断蛋白合成,降低了去往内质网的蛋白量,最终减轻了内质网的负担,但是磷酸化的eIF2-α却可以选择性增加活化转录因子4(activating transcription factor 4,ATF4)mRNA的表达,继而上调促凋亡因子CHOP的表达,从而诱导细胞凋亡[1]。已有研究证实,在ERS状态下,PERK基因在鼠 INS-1细胞[2]和鼠H4IIE细胞[3]凋亡的过程中发挥了重要的作用,但是有关PERK基因与ERS状态下人肝细胞凋亡的关系鲜有报道。为此,本实验将构建靶向人PERK基因的短发夹状RNA(short hairpin RNA,shRNA)表达载体,并转染人正常肝细胞株 L02,沉默PERK基因,同时用毒胡萝卜素(内质网膜上钙泵抑制剂,thapsigargin,TG)诱导细胞发生ERS反应,观察肝细胞凋亡的变化,旨在为进一步研究PERK基因及其相关的信号通路在ERS诱导肝细胞凋亡过程中的作用和机制打下基础。
材料和方法
1 材料
1.1 质粒和菌株 pGenesil-1.1质粒载体购自武汉晶赛生物技术公司,大肠杆菌E.coli DH5α由重庆医科大学附属二院肝病研究所提供。
1.2 细胞株 人正常肝细胞株L02细胞由本消化科实验室提供。
1.3 主要试剂 T4 DNA连接酶、DNA Fragment Purification Kit.2.0 试剂盒、MiniBEST Plasmid Purification Kit.2.0 试剂盒、PrimeScriptTMRT Reagent Kit试剂盒(TaKaRa);Poly JetTM转染试剂(SignaGen);RPMI-1640培养基(Gibco);胎牛血清(杭州四季青生物公司);兔抗PERK多克隆抗体(Santa Cruz);PCR引物由大连TaKaRa公司合成;MIT细胞增殖及细胞毒性检测试剂盒、Annexin V-PE/7-AAD细胞凋亡检测试剂盒(凯基生物有限公司)。
2 方法
2.1 shRNA真核表达载体序列的设计 根据Gen-Bank提供的人PERK基因序列(NM-004836),利用Ambion公司的在线设计软件(http://www.Ambion.com),并参考哺乳动物真核细胞siRNA的TuschlAA-19nt设计原则,设计针对人PERK基因mRNA的靶位点序列,包括3个特异匹配位点和1个随机错配的寡核苷酸片段。根据载体特性,合成发夹结构shRNA对应的DNA序列。BLAST检索设计的DNA片段序列的特异性,排除阴性对照序列与人体其它任何mRNA有同源性。序列由武汉晶赛生物技术公司合成。shRNA转录模板DNA的结构模式为:CACC+正义序列+茎环序列+反义序列+终止信号+SacⅠ酶切位点。
转录模板DNA序列如下:PERK1-1.1-A:5'-CACC GCTTTGGAATCTGTCACTAATTTCAAGACGATT AGTGACAGATTCCAAAGCTTTTTTG-3';PERK1-1.1-B:5'-AGCTCAAAAAAGCTTTGGAATCTGTCACTAATCGTCTTGAAATTAGTGACAGATTCCAAAGC-3';PERK2-1.1-A:5'-CACCGCCTCAAGCCATCCAACATATTCTATGGACAAATATGTTGGATGGCTTGAGGTTTTTTG-3';PERK2-1.1-B:5'-AGCTCAAAAAACCTCAAGCCATCCAACATATTTGTCCATAGAATATGTTG-GATGGCTTGAGGC -3';PERK3-1.1-A:5'-CACCGTTGTGCTAGCAACCCTAATATTCAAGACGTATTA-GGGTTGCTAGCACAACTTTTTTG-3';PERK3-1.1-B:5'-AGCTCAAAAAAGTTGTGCTAGCAACCCTAATACGTCTTGAATATTAGGGTTGCTAGCACAAC-3';HK -1.1-A:5'-CACCGACTTCATAAGGCGCATGCTTCAAGACGGCATGCGCCTTATGAAGTCTTTTTTG-3';HK -1.1-B:5'-AGCTCAAAAAAGACTTCATAAGGCGCATGCCGTCTTGAAGCATGCGCCTTATGAAGTC -3'。
2.2 shRNA真核表达载体的构建 将上述shRNA序列的模板DNA正、反义链退火后合成DNA片段。质粒pGenesil-1.1经Eco31I酶切,形成线性片段,并加以纯化。稀释退火片段分别与线性化pGenesil-1.1质粒表达载体连接。连接反应条件:稀释退火片段 1 μL;线性化质粒载体 1 μL;10×ligase buffer 1 μL;T4 DNA 连接酶 1 μL;ddH2O 6 μL,37 ℃ 水浴反应过夜。将连接产物转化感受态细菌DH5α,筛选卡那霉素抗性克隆,挑取阳性克隆,用小提试剂盒小量提取质粒。质粒分别经Sac I做酶切鉴定,在酶切鉴定中观察到所插入的小片段后,取转化菌液送武汉晶赛公司测序。证实序列正确后,分别命名为PERK1-shRNA、PERK2-shRNA、PERK3-shRNA及阴性对照HK-shRNA。大量扩增菌株,抽提质粒,-20℃冻存备用。
2.3 shRNA真核表达载体转染L02肝细胞后绿色荧光信号观察 L02细胞用含10%胎牛血清的RPMI-1640培养基(含双抗:青霉素0.0625 g/L,链霉素0.1 g/L),37℃、5%CO2、饱和湿度传代培养。实验分空白对照组:即未做任何处理;阴性对照组:转染HK-shRNA;实验组:分别转染 PERK1-shRNA、PERK2-shRNA和PERK3-shRNA。取对数生长期细胞,按2×108/L细胞密度接种于6孔板,待细胞融合率达70% ~80%时,将1 μg干扰质粒和3 μL Poly JetTM转染试剂瞬时转染L02肝细胞,每组设3个复孔。转染12~18 h后,培养液更换为完全培养液,继续培养,分别于转染24、48 h后在倒置荧光显微镜下观察增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的表达情况。
2.4 RT-PCR法检测PERK mRNA的表达 收集各组转染24 h的细胞,提取细胞总RNA,检测纯度及完整性,按TaKaRa PrimeScriptTMRT reagent Kit试剂盒说明书方法逆转录成 cDNA,PCR扩增后经1.5%琼脂糖凝胶电泳,凝胶成像系统照相,Quantity One 4.52图像分析软件半定量分析,以PERK与β-actin的比值代表其相对含量。PERK上游引物5'-AGCACTCAGATGGAGAGAGTCAG -3',下游引物5'-GCTATGGGAGTTGTTGGACTGT -3',产物大小260 bp;β-actin上游引物5'-GACCCAGATCATGTTTGAGACC-3',下游引物 5'-ATCTCCTTCTGCATCCTGTCG -3',产物大小550 bp。
2.5 Western blotting检测PERK蛋白的表达 收集各组转染24 h的细胞,按总蛋白提取试剂盒说明步骤提取细胞中总蛋白,BCA法进行蛋白定量,分装后-80℃保存,避免反复冻融。蛋白经SDS-PAGE电泳后,电转移至PVDF膜上,加入兔抗PERK多克隆抗体(1∶500稀释),再加入辣根过氧化物酶标记的羊抗兔IgG(1∶5000稀释),ECL显影。以β-actin为内参照。Quntity One 4.52图像分析软件进行图像分析,将每个样本的积分吸光度值与β-actin的积分吸光度值相比,得出的比值代表其蛋白相对含量。
2.6 MTT法检测细胞活力 L02细胞以5×107/L的细胞浓度接种于96孔板,细胞贴壁后更换培养基,按2.3方法将上述筛选出的最佳干扰质粒和阴性质粒转染L02肝细胞,分组如下:(1)正常细胞组(normal组);(2)内质网应激模型组(TG组):即毒胡萝卜素刺激L02细胞;(3)转染HK-shRNA载体的肝细胞内质网应激模型组(HK+TG组);(4)转染PERK-shRNA载体的肝细胞内质网应激模型组(PERK+TG组)。各组细胞转染24 h后,更换新鲜培养基,加入终浓度为100 nmol/L[4]毒胡萝卜素,孵育24 h后,每孔加入MTT(5 g/L)20 μL,继续培养4 h,弃去培养基,每孔加入150 μL DMSO,用酶标仪在490 nm波长处检测每孔的吸光度。每组设3个复孔,至少重复3次。
2.7 Annexin V-PE/7-AAD流式细胞术检测细胞凋亡率 按2.6方法处理细胞后,收集各组细胞,PBS漂洗2次,用1 μL Annexin V -PE 和5 μL 7-AAD避光染色10 min后,将细胞置激发光为488 nm波长的FACS Calibur型流式细胞仪上检测,上机测定时获取2×105个以上细胞,重复3次。得到的数据用ModFit LT软件分析结果。染色后将细胞分为3个亚群:活细胞胞膜完整,磷酯酰丝氨酸(phosphatidylserine,PS)无外化,为 Annexin V -PE-/7-AAD-亚群;早期凋亡细胞胞膜完整,PS外化,为Annexin V-PE+/7-AAD-亚群;晚期凋亡或坏死细胞胞膜不完整,PS外化,为Annexin V-PE+/-7AAD+亚群。
3 统计学处理
结 果
1 shRNA真核表达载体的构建、电泳鉴定及测序
经BLAST检索,证实设计好的DNA片段序列仅与PERK基因有同源性,且有明显的特异性,阴性对照DNA片段与人任何基因无同源性,可用于shRNA的构建。
重组表达质粒经Sac I单酶切得到一条约916 bp的DNA小带,初步表明4个重组质粒均构建成功,见图1。随后测序结果显示,仅PERK2-shRNA的loop环上有3个碱基与初始设计不符,但依据siRNA的设计原则,不会影响干扰实验,其余3个重组质粒中的目的序列与设计的寡核苷酸序列完全一致,证实重组质粒构建成功,见图2。
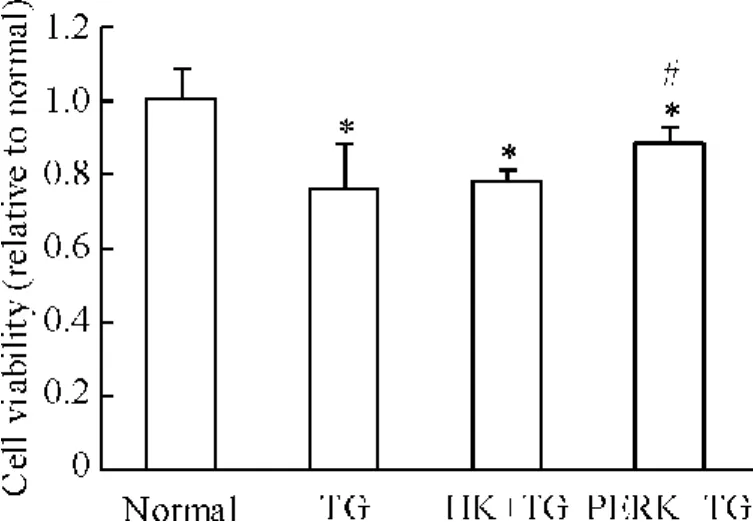
Figure 1.Digestion and identification of recombinant plasmids.1:PERK1-shRNA;2:PERK2-shRNA;3:PERK3-shRNA;4:HK -shRNA;5:marker.图1 重组质粒的酶切鉴定

Figure 2.The sequences of recombinant plasmids.A:PERK1-shRNA;B:PERK2-shRNA;C:PERK3-shRNA;D:HK-shRNA.图2 重组质粒测序结果
2 shRNA真核表达载体转染L02肝细胞后EGFP的表达
构建的重组表达质粒携带有EGFP(显示绿色荧光)报告基因,经Poly JetTM转染细胞24、48 h后,荧光显微镜下可见转染各质粒的细胞带绿色荧光,未转染质粒的细胞则未出现荧光,见图3。

Figure 3.Expression of EGFP in L02 cells after transfected with recombinant plasmids for 24 h(×200).A:PERK1-shRNA;B:PERK2-shRNA;C:PERK3-shRNA;D:HK-shRNA.图3 转染重组质粒24 h后L02细胞中EGFP的表达
3 RT-PCR检测shRNA对各组细胞内PERK mRNA表达
不同质粒转染细胞24 h后,提取各组细胞总RNA,RT-PCR检测结果表明各组样本均可见亮度均一的β-actin对照条带,应用Quantity One软件进行半定量分析,空白对照组、阴性对照组、各实验组(PERK1、PERK2、PERK3)mRNA相对表达量(PERK/β-actin)分别为0.24±0.01、0.23±0.03、0.10±0.07、0.17±0.05、0.21±0.02,阴性对照组与空白对照组比较差异无显著(P>0.05),各实验组与空白对照组比较差异均显著(P<0.05),并且以PERK1-shRNA的差异最为显著,见图4。

Figure 4.RT-PCR analysis of PERK mRNA in L02 cells.1:marker;2:control;3:HK-shRNA;4:PERK1-shRNA;5:PERK2-shRNA;6:PERK3-shRNA.图4 RT-PCR法检测shRNA对L02细胞中PERK mRNA表达的影响
4 Western blotting检测shRNA对各组细胞内PERK蛋白表达的影响
不同质粒转染细胞24 h后,提取各组细胞总蛋白,Western blotting检测结果显示,空白对照组、阴性对照组、各实验组的蛋白相对含量(PERK/β-actin)分别为 0.29±0.07、0.30±0.02、0.17±0.03、0.22±0.01、0.26±0.04,阴性对照组与空白对照组比较差异无显著(P>0.05),各实验组与空白对照组比较差异均显著(P<0.05),但是 PERK1-shRNA对PERK蛋白表达的抑制作用最明显,结合RT-PCR结果,我们将在后续实验中选用重组质粒PERK1-shRNA进行干扰实验,见图5。

Figure 5.Western blotting analysis of PERK protein in L02 cells.1:control;2:HK-shRNA;3:PERK1-shRNA;4:PERK2-shRNA;5:PERK3-shRNA.图5 Western blotting法检测shRNA对L02细胞中PERK蛋白表达的影响
5 PERK1-shRNA对内质网应激状态下L02细胞活力的影响
经100 nmol/L毒胡萝卜素诱导各组L02细胞24 h后,MTT测定结果表明,在ERS状态下,与正常细胞组相比,肝细胞活力明显降低(P<0.05),转染PERK1-shRNA能明显增加肝细胞的活力,且差异显著(P<0.05),见图6。
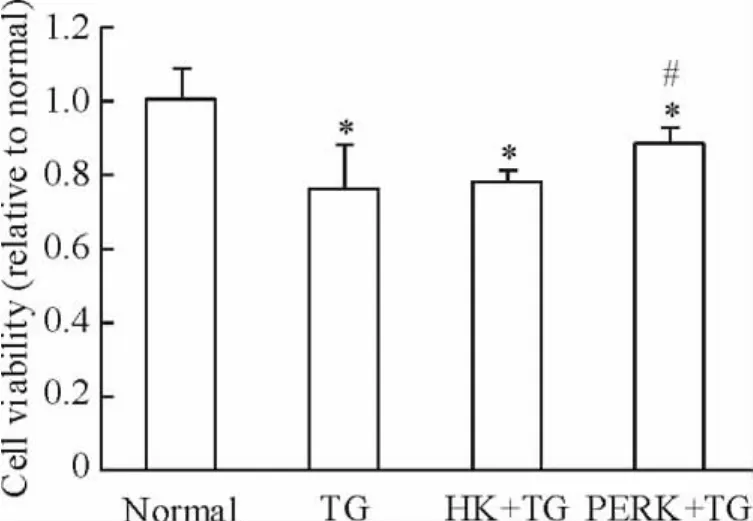
Figure 6.The cell viability of each group.The figure showed that endoplasmic reticulum stress induced by thapsigargin(TG)could decrease the cell viability,while such effect was inhibited by PERK1-shRNA transfection..n=3.*P<0.05 vs normal group;#P<0.05 vs TG group.图6 MTT法检测PERK-shRNA对ERS状态下L02细胞活力的影响
6 PERK1-shRNA对内质网应激状态下L02细胞凋亡的影响
Annexin V-PE/7-AAD流式细胞术测定结果证实,ERS能够诱导肝细胞凋亡(P<0.05),而沉默PERK基因能够有效的抑制ERS诱导的肝细胞凋亡(P <0.05),见图7。

Figure 7.The apoptotic rate of each group.Representative graphs were obtained by flow cytometry analytic after double staining with Annexin V-PE and 7-AAD.The figure showed that endoplasmic reticulum stress could increase the apoptotic rate of L02 cells,while such effect was attenuated by PERK1-shRNA transfection..n=3.*P<0.05 vs normal group;▲P<0.05 vs TG group.图7 流式细胞术检测PERK-shRNA对ERS状态下L02细胞凋亡的影响
讨 论
内质网(endoplasmic reticulum,ER)是真核细胞内重要的亚细胞器,含多种酶系统,参与脂类代谢过程。多种生理或病理条件会引起未折叠蛋白或错误折叠蛋白在ER聚集,损伤ER的正常生理功能,称为ERS[5]。许多文献报道ERS与酒精性肝病、糖尿病、神经元变形等疾病有关[6]。PERK是位于ER膜上的3种跨膜蛋白之一,配体结合域位于ER腔面,效应域位于ER胞质面,在ERS早期,PERK信号通路通过抑制蛋白质的合成对细胞起保护作用、促进细胞生存,随着ERS时间的延长,PERK通过诱导促凋亡因子CHOP的表达而促进细胞凋亡[1]。越来越多的研究证实肝细胞凋亡是造成肝脏损伤和肝脏疾病最基本的中心环节[7]。因此,本研究选择构建了靶向PERK基因的shRNA表达载体,转染L02细胞,观察PERK基因的缺失对ERS条件下肝细胞凋亡的影响。
RNA干扰(RNA interference,RNAi)现象是由与靶基因序列同源的双链 RNA(double-stranded RNA,dsRNA)引发的广泛存在于生物体中的序列特异性基因转录后的沉默过程。细胞中特异性核酸酶Dicer将dsRNA裂解成由21-25个核苷酸组成的小干扰RNA(small interfering RNA,siRNA),随后 siRNA通过识别与之序列互补配对的mRNA使特定基因在转录后水平被降解从而下调靶基因表达[8-10]。2001年,Elbashir等[11]首次发现了哺乳动物细胞也存在RNAi现象。这一发现极大地推动了RNAi技术在疾病治疗领域的研究和应用,同时也为RNAi技术广泛应用于基因功能、信号转导、抗肿瘤等的研究奠定了基础。
本实验选用武汉晶赛生物技术公司的pGenesil-1.1质粒载体,该载体含有人RNA聚合酶Ⅲ家族的hU6启动子,RNA聚合酶Ⅲ识别的终止信号3'端6个连续的T,可指导转录出3'端突出包含茎环的发卡结构,同时该载体含有报告基因EGFP和抗生素标记,可分别用于转染效率的观察以及抗生素筛选阳性克隆。此外,载体多克隆的酶切位点中有一个Sac I酶切位点,我们在插入的DNA片段中也设计了Sac I位点,当片段插入正确时,质粒就能被Sac I酶切出一条约916 bp的DNA小带。经酶切鉴定分析,构建的重组质粒酶切片段与预期大小一致。测序分析,3个重组质粒测序结果与初始设计完全一致,仅有1个重组质粒的loop环上有3个碱基与初始设计不符,但不会影响干扰实验,说明4个重组质粒构建有效。
将shRNA表达载体导入细胞中是诱导RNAi发生的关键。我们将4个shRNA表达载体经Poly JetTM转染试剂包裹转染L02细胞,与未转染组相比,各组均有荧光的表达,表明我们成功将质粒转染入细胞中。RT-PCR和Western blotting结果均显示PERK1 shRNA组PERK表达量最低,表明在蛋白和mRNA水平上PERK1 shRNA对目标基因表达有最明显抑制效果。该结果也为下一步进行L02细胞中PERK基因的功能研究奠定了有利的实验基础。
Saito等[12]在成骨细胞的研究中发现,ERS反应介导的PERK-eIF2α-ATF4通路参与细胞的分化过程。研究[2,3]发现 PERK/ATF4/CHOP 通路在 ERS诱导的鼠INS-1和MIN6细胞凋亡中发挥了重要作用。许多肝脏疾病的发病机制与肝细胞凋亡密切相关。然而,PERK相关的信号通路是否参与了肝细胞的凋亡至今尚不清楚。本研究中流式细胞术结果表明,沉默了PERK基因的肝细胞ERS组较ERS组细胞凋亡率明显降低,提示PERK基因沉默对ERS状态下肝细胞凋亡有抑制作用,但具体机制还有待进一步研究。在后续实验中,我们将进一步应用该表达载体深入研究PERK基因及其相关的信号通路在ERS诱导的肝细胞凋亡过程中的作用。
[1]Kapoor A,Sanyal AJ.Endoplasmic reticulum stress and the unfolded protein response[J].Clin Liver Dis,2009,13(4):581-590.
[2]Lai E,Bikopoulos G,Wheeler MB,et al.Differential activation of ER stress and apoptosis in response to chronically elevated free fatty acids in pancreatic β - cells[J].Am J Physiol Endocrinol Metab,2008,294(3):E540 -E550.
[3]Wei YR,Wang D,Topczewski F,et al.Saturated fatty acids induce endoplasmic reticulum stress and apoptosis independently of ceramide in liver cells[J].Am J Physiol Endocrinol Metab,2006,291(2):E275-E281.
[4]Takadera T,Fujibayashi M,Kaniyu H,et al.Caspasedependent apoptosis induced by thapsigargin was prevented by glycogen synthase kinase-3 inhibitors in cultured rat cortical neurons[J].Neurochem Res,2007,32(8):1336-1342.
[5]Kapoor A,Sanyal AJ.Endoplasmic reticulum stress and the unfolded protein response[J].Clin Liver Dis,2009,13(4):581-590.
[6]Marciniak SJ,Ron D.Endoplasmic reticulum stress signaling in disease[J].Physiol Rev,2006,86(4):1133 -1149.
[7]吕 游.肝脏疾病中肝细胞凋亡的研究进展[J].中国基层医药,2005,12(10):1444-1446.
[8]Pushparaj PN,Aarthi JJ,Manikandan J,et a1.siRNA,miRNA,and shRNA:in vivo applications[J].J Dent Res,2008,87(11):992-1003.
[9]Carthew RW,Sontheimer EJ.Origins and mechanisms of miRNAs and siRNAs[J].Cell,2009,136(4):642 -655.
[10]刘晓兵,郭晓红,刘立新,等.siRNA沉默Smad3对肝星状细胞增殖与凋亡的影响及其机制研究[J].中国病理生理杂志,2011,27(7):1376 -1381.
[11]Elbashir SM,Harborth J,Lenderckle W,et a1.Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells[J].Nature,2001,411(6836):494-498.
[12]Saito A,Ochiai K,Kondo S,et al.Endoplasmic reticulum stress response mediated by the PERK-eIF2α-ATF4 pathway is involved in osteoblast differentiation induced by BMP2[J].J Biol Chem,2011,286(6):4809-4818.
