大豆异黄酮对去势雌大鼠缺血再灌注脑组织细胞凋亡及calpain表达的影响*
2011-07-31么晓轶于纪珠
么晓轶,于纪珠,李 颖
(1哈尔滨医科大学第二临床医学院老年病科,黑龙江 哈尔滨 150086;2哈尔滨医科大学第一临床医学院大桥分院,黑龙江 哈尔滨 150006)
大量实验证明雌激素可以通过不同方式对脑梗死病理过程发生作用,从而对脑缺血损伤起到保护作用,但雌激素存在的许多负面作用及其性别限制其在临床上得以广泛应用。植物雌激素结构与人体分泌的雌激素十分相似,其化学结构与哺乳动物雌激素17β-雌二醇相似,都有1对羟基及1个酚环,这种结构的相似性决定了它们具有一定的雌激素活性,可以和内源性雌激素受体(estrogen receptor,ER)结合,而表现出类似雌激素样的作用,摒弃动物雌激素缺陷。Calpain是一种钙依赖性蛋白酶,属于半胱氨酸蛋白酶中香木瓜蛋白酶家族成员,在中枢神经系统广泛存在。Calpain和caspase-3都属于半胱氨酸蛋白酶家族,都可以介导细胞凋亡的发生,二者在脑缺血后作用于半暗带神经元,促进凋亡[1]。已有研究证明17β-雌二醇对大鼠缺血再灌注损伤具有保护作用[2-3],因此推断植物雌激素也可能具有类似作用。本文以大豆异黄酮作为植物雌激素的典型代表,研究植物雌激素对缺血再灌注脑组织的保护作用并探讨其作用机制。
材料和方法
1 主要试剂与仪器
大豆异黄酮购自九三油脂集团(纯度为40%),原位TUNEL试剂盒购自罗氏公司,calpain多克隆抗体和原位杂交试剂盒购自武汉博士得生物工程有限公司。DAB染色剂购自北京中杉金桥生物技术有限公司。Tris-HCl、EGTA、DTT、考马斯亮蓝G250、β -硫基乙醇、Lowry蛋白定量试剂盒和溶血脑磷脂均购自Sigma。
2 动物分组
成年健康雌性SD大鼠36只,月龄2~3个月,制作双侧卵巢切除术时体重180~220 g,制作脑缺血再灌注模型时体重230~280 g。所有动物均将双侧卵巢切除,随机分为3组:大豆异黄酮大剂量组12只、小剂量组12只、模型组12只。大剂量组按120 mg·kg-1·d-1灌胃给药,小剂量组按 60 mg·kg-1·d-1灌胃给药,模型组给予等量生理盐水灌胃。各组动物喂养1个月后,按改良的Longa法[4]行左侧大脑中动脉阻断模型,应用黑色5/0尼龙线栓自颈总动脉的切口插入,沿颈总动脉、颈内动脉顺行向上插入大脑中动脉的起始部,遇阻力停止,从颈总动脉分叉处计算插入深度1.7~1.8 cm,造成大脑中动脉阻断。缺血2 h后,无需要再次麻醉,轻轻抓握动物将栓线后拔退至颈总动脉,即恢复大脑中动脉的血供。术后动物清醒后右侧肢体出现Horner氏征,并采用5分制进行神经功能评分以证明脑缺血模型成功。
3 方法
3.1 实验指标的检测
3.1.1 HE染色 各组大鼠再灌注22 h后取材。于视交叉前后各2 mm冠状切片,常规梯度乙醇脱水,二甲醛透明,浸蜡,包埋,制成蜡块,切成厚约4 μm的薄片,在各个标本的同一位置连续做3张切片,分别用于HE染色,光镜下定性观察。
3.1.2 原位杂交检测calpain mRNA的表达 操作如下:切片常规脱蜡至水,新鲜配制的0.5%H2O2/甲醇室温处理30 min,经3%柠檬酸新鲜稀释的胃蛋白酶37℃消化1 min,每片加20 μL预杂交液,37℃作用2 h,再加20 μL杂交液4℃杂交过夜,经梯度洗涤后,滴加封闭液,37℃作用30 min,再依次滴加生物素化鼠抗地高辛,SABC复合物和生物素化过氧化物酶作用后,用新配制的0.01%H2O2/0.04%DAB室温显色10 min,充分水洗,苏木素复染,中性树胶封固。光学显微镜下观察,阳性细胞为棕黄色染色。用PBS代替杂交探针作为阴性对照片。Calpain mRNA阳性细胞计数方法:由对实验不知情者在高倍镜(×400)下分别计数相邻脑片中缺血侧阳性细胞数。光镜下在缺血测梗死灶周围选择5个不重叠的视野,计数每个视野下每100个细胞中阳性染色的细胞数,然后除以5,所得数据作为1个动物标本的calpain mRNA阳性细胞数。
3.1.3 原位末端标记(TUNEL)检测细胞凋亡 使用DAB显色试剂盒。着棕黄色为凋亡细胞,定义为阳性细胞。阳性细胞计数方法:400倍光镜下在缺血侧梗死灶周围选择5个不重叠视野,计数每个视野下每100个细胞中阳性染色的细胞数,然后除以5,所得数据作为1个动物标本的阳性细胞数。
3.2 Calpain活性测定[5]大鼠迅速断头取脑,冰浴上分离出缺血侧皮层制成10%的组织匀浆以测定calpain活性。将皮层组织加入20 μmoL/L Tris-HCl缓冲液pH=7.4,在冰浴上用玻璃匀浆器将其制成组织匀浆,在4℃条件下1000×g离心8 min,取上清液置4℃冰箱待测calpain活性。1管为无Ca2+体系,内含酪蛋白 0.4 mg,12 mmol/L Tris - HCl,1 mmol EGTA及上清液40 mL;另1管除用1 mmol/L CaCl2代替EGTA外,管内其它物质均相同。25℃反应30 min后依次向各层加入蒸馏水3.0 mL,考马斯亮蓝G250染液0.8 mL,充分混合10 min测595 nm吸光度值(A值)。每个样品calpain活性用各相应的无钙管吸光度A值减去有钙管A值所得差值来计算,蛋白定量采用Lowry法。
4 统计学处理
数据采用SPSS 11.0统计软件包进行处理。数据以均数±标准差()表示,用方差分析(ANOVA)进行分析处理。用直线相关分析法判定两变量间的相关情况,相关系数r的假设检验用t检验。
结 果
1 光镜定性观察
大、小剂量大豆异黄酮组皮质区可见大部分神经细胞形态尚正常,胞质、胞核清晰可见,内有核仁,少数神经细胞轻度肿胀,细胞周围间隙略增宽,神经细胞呈三角形或多角形。模型组皮质区大部分神经细胞轴突消失,细胞周围的间隙明显增宽,胞间距离增大,神经细胞及胶质细胞肿胀,神经细胞呈三角形或圆形,胞核固缩、核碎裂或消失,一些神经细胞变性坏死,并有局部脑区的液化性坏死,见图1。
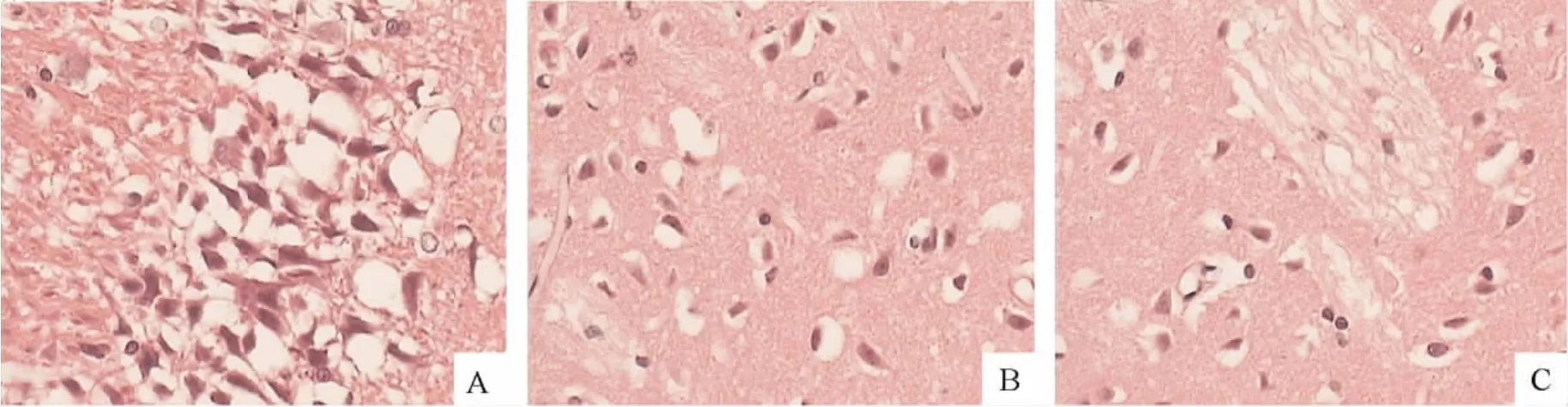
Figure 1.Morphological changes of the ischemic cortex(HE staining,× 400).A:FCIR(focal cerebral ischemia and reperfusion)group;B:low-dose soybean isoflavone-treated group;C:high-dose soybean isoflavone-treated group.图1 缺血皮层神经细胞形态学变化
2 脑缺血再灌注侧calpain mRNA阳性细胞的分布和数量
Calpain阳性细胞的胞浆呈棕色。3组缺血再灌注侧脑组织均有大量calpain表达,而缺血对侧脑组织仅有少量的calpain mRNA的表达。阳性细胞广泛分布于缺血侧的皮质区,梗死灶周围半暗带区表达较强。大豆异黄酮组与模型组比较,calpain的表达显著减弱,不同剂量药物干预组calpain mRNA阳性细胞数量相近,无明显差异,见图2、表1。

Figure 2.Expression of calpain mRNA in the ischemic cortex(DAB staining,×400).A:FCIR group;B:low-dose soybean isoflavone-treated group;C:high-dose soybean isoflavone-treated group.图2 脑缺血侧皮层calpain mRNA表达
表1 各实验组凋亡细胞数、calpain mRNA阳性细胞数和calpain活性变化Table 1.Comparison of apoptotic cells,calpain mRNA positive cells and activity of calpain in different groups(.n=6)

表1 各实验组凋亡细胞数、calpain mRNA阳性细胞数和calpain活性变化Table 1.Comparison of apoptotic cells,calpain mRNA positive cells and activity of calpain in different groups(.n=6)
△P <0.05 vs FCIR group.SIF:soybean isoflavones.
Group Dose Apoptotic cells Calpain mRNA posit ive cells Activity of calpain FCIR - 38.67 ±4.03 70.97 ±1.25 2.23 ±0.25 Low -dose SIF 60 mg·kg-1·d-1 32.13 ±3.45△ 65.43±1.74△ 1.87±0.12△High-dose SIF 120 mg·kg-1·d-1 30.20 ±1.90△ 64.87±2.10△ 1.94±0.31△
3 脑缺血再灌注侧calpain活性的变化
脑缺血再灌注侧皮层calpain活性明显升高,大豆异黄酮组缺血再灌注侧calpain活性显著下降,与对照组相比差异显著(P<0.05);不同剂量药物预处理组calpain活性相近,两药物组对比无明显差异(P>0.01),见表1。
4 脑缺血再灌注后细胞凋亡情况
细胞核中有棕黄色颗粒者为TUNEL阳性细胞,即凋亡细胞。凋亡细胞染色不均,多集中在核膜下,呈不规则环形,可见核固缩及碎裂。凋亡细胞主要分布于大脑中动脉供血区的额顶叶皮层,以梗死灶周边区密度最高,而梗死灶中心细胞丢失,无阳性染色。凋亡细胞的分布区域与calpain mRNA阳性细胞的分布相符合。模型组缺血皮层TUNEL染色阳性细胞(凋亡细胞)在缺血半暗带密集成簇,在药物组缺血皮质的周围凋亡细胞零星散在,数量明显减少,与模型组相比,差异显著(P<0.05)。各组神经细胞凋亡情况见图3、表1。

Figure 3.The neuronal apoptotic cells in cortical ischemic regions(DAB staining,×400).A:FCIR group;B:low -dose soybean isoflavone-treated group;C:high-dose soybean isoflavone-treated group.图3 缺血侧皮层脑组织神经细胞凋亡
5 神经细胞的凋亡程度与calpain活性的相关性分析
本实验进行时将同批次各组神经细胞凋亡数和calpain活性两两相对应进行相关分析,结果显示,神经细胞凋亡数与calpain活性呈正相关(相关系数r=0.874,P<0.01)。去势雌性大鼠脑缺血再灌注后缺血脑组织calpain活性增强,从而诱导神经细胞凋亡。
讨 论
大豆异黄酮分为游离型的苷元和结合型的糖苷两类,游离型的甙元中染料木黄酮和大豆黄素为含有芳香环的非类固醇化合物,它们的结构与雌激素相似,故有植物性雌激素之称。现有的研究已证实植物雌激素具有抗氧化、抗炎、抗凋亡的作用。唐决等[6]人在肝脏的缺血模型中发现染料木黄酮预处理后,肝组织病理损伤明显减轻,肝组织caspase-3蛋白表达及丙二醛浓度显著降低。在大鼠和家兔的心肌缺血再灌注模型中证实植物雌激素可减轻心肌细胞的凋亡[7-8]。
在器官缺血时,发生细胞内钙离子超载,calpain被激活。Calpain过度激活参与了缺血性脑损伤的病理过程,现有的研究在不同种动物的多种脑缺血模型中发现calpain的活化,但在其活性的变化与缺血再灌注时间的关系上,不同的实验得出的结论不尽相同[9-10],多数研究证实calpain活性的变化在脑缺血再灌注后呈双峰式。本实验研究结果表明大鼠脑缺血再灌注后calpain表达增加,参与脑缺血损伤过程,与以往文献结果一致。Calpain表达在诱导细胞凋亡中具有重要作用,由目前研究文献推断calpain参与凋亡的机制可能有如下几个方面:calpain裂解caspase-3等产生活性片段,活性caspase-3水解calpastatin,反过来增加 calpain 活性[11],促进凋亡。Calpain激活caspase-3后,除与 caspase的关系外,还通过激活钙调神经磷酸酶(calcineurin,CaN)介导了脑缺血神经元延迟性死亡[12]。Chae 等[13]的研究,发现动物雌激素能够通过抑制calpain介导的Bid的裂解发挥对心肌缺血再灌注损伤的保护作用,降低calpain和caspase-8的活性,这提示雌激素样物质在脑组织的缺血性损伤中也有可能具有相似的作用。在我们的研究中发现在脑缺血再灌注22 h后calpain mRNA的阳性细胞数在缺血半暗带明显增多,calpain的活性也同步上升,相关分析结果显示神经细胞的凋亡程度与calpain的活性呈正相关。大豆异黄酮组与模型组相比,calpain表达及神经细胞凋亡均明显减少,calpain的活性显著下降。由此推断大豆异黄酮通过减弱calpain的表达来阻止脑缺血再灌注损伤,进而起到脑保护作用。
以往的研究显示:与雌激素相似的结构特点使异黄酮能够与雌激素受体结合,从而表现出雌激素活性和抗雌激素活性,至于表现为何种活性主要取决于其局部浓度、内源性雌激素水平以及组织器官的水平[14]。最新的研究表明,在永久性大脑中动脉阻塞大鼠模型中,大豆异黄酮从10 mg·kg-1·d-1增至50 mg·kg-1·d-1时,其对脑组织的保护作用明显增强[15]。这说明摄入量在 10 mg·kg-1·d-1至50 mg·kg-1·d-1之间时,大豆异黄酮的脑保护作用与剂量大小呈正相关。但目前有关大豆异黄酮对缺血脑组织发挥保护的最小剂量尚无报道,这有待我们进一步的探讨。在本实验中,120 mg·kg-1·d-1与60 mg·kg-1·d-1组比较,它们对 calpain 的表达及神经细胞凋亡无明显差异,这说明大鼠的摄入量在60 ~120 mg·kg-1·d-1之间大豆异黄酮对缺血再灌注脑组织具有保护作用,但在此范围内它的保护作用并未随着剂量的增加而提高,因实验条件所限对于此范围以外的剂量我们未进一步探究。本研究表明植物雌激素大豆异黄酮在缺血性脑损伤中起到神经保护作用,通过下调calpain的表达和降低calpain活性减轻缺血半暗带神经细胞的凋亡可能是其发挥此作用的机制之一。
[1]Blomgreni K,Leist M,Groc L.Pathological apoptosis in the developing brain[J].Apoptosis,2007,12(5):993 -1010.
[2]Liu R,Wen Y,Perez E,et al.17β - Estradiol attenuates blood-brain barrier disruption induced by cerebral ischemia - reperfusion injury in female rats[J].Brain Res,2005,1060(1 -2):55 -61.
[3]吴 芹,赵 智,孙 红,等.雌激素对去卵巢大鼠离体心脏缺血/再灌注损伤的保护作用[J].中国应用生理学杂志,2009,25(3):355 -360.
[4]Longa EZ,Weinstein PR,Carson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84 -91.
[5]王宇卉,夏春林,强 华,等.大鼠短暂局灶性大脑中动脉缺血calpain的表达[J].中国神经科学杂志,2003,19(3):151 -155,160.
[6]唐 决,王东平,鞠卫强,等.Genistein预处理对大鼠肝缺血再灌注损伤的保护作用[J].中国普通外科杂志,2011,20(1):53 -57.
[7]Kim DS,Kwon DY,Kim MS,et al.The involvement of endoplasmic reticulum stress in flavonoid-induced protection on cardiac cell death caused by ischaemia/reperfusion[J].J Pharm Pharmacol,2010,62(2):197 -204.
[8]Ji ES,Yue H,Wu YM,et al.Effects of phytoestrogen genistein on myocardial ischemia/reperfusion injury and apoptosis in rabbits[J].Acta Pharmacol Sin,2004,25(3):306-312.
[9]Tsuchiya K,Kohda Y,Yoshida M,et al.Postictal blockade of ischemic hippocampal neuronal death in primates using selective cathepsin inhibitors[J].Exp Neurol,1999,155(2):187-194.
[10]Neumar RW,Meng FH,Mills AM,et al.Calpain activity in the rat brain after transient forebrain ischemia[J].Exp Neurol,2001,170(1):27 -35.
[11]Blomgren K,Zhu C,Wang X,et al.Synergistic activation of caspase-3 by m-calpain after neonatal hypoxia-ischemia:a mechanism of"pathological apoptosis"?[J].J Biol Chem,2001,276(13):10191 -10198.
[12]Shioda N,Moriguchi S,Shrasaki Y,et al.Generation of constitutively active calcineurin by calpain contributes to delayed neuronal death following mouse brain ischemia[J].J Neurochem,2006,98(1):310 -320.
[13]Chae SU,Ha KC,Piao CS,et al.Estrogen attenuate scardiac ischemia-reperfusion injury via inhibition of calpainmediated bid cleavage[J].Arch Pharm Res,2007,30(10):1225-1235.
[14]Tham DM,Gardner CD,Haskell WL.Potential health benefits of dietary phytoestrogens:a review of the clinical,epidemiological,and mechanic evidence[J].J Clin Endocrinol Metab,1998,83(7):2223 -2235.
[15]Huang G,Cao X,Zhang X,et al.Effects of soybean isoflavone on the notch signal pathway of the brain in rats with cerebral ischemia[J].J Nutr Sci Vitaminol(Tokyo),2009,55(4):326 -331.
