一种度他雄胺合成新工艺
2011-07-31刘龙成
刘龙成
(重庆万利康制药有限公司,重庆 垫江 408302)
引言
度他雄胺 (Dutasteride,CAS#:164656-23-9),化学名为(5α,17β)-N-[2,5-双(三氟甲基)苯基]-3-酮-4-氮杂-5α-雄甾-1-烯-l7β-羧酰胺,是葛兰素史克(GSK)公司研制,2003年6月获FDA批准在美国上市的一种I型和Ⅱ型两种同工形式甾体类5α-还原酶(一种能够将睾酮转化成5α-二氢睾酮的细胞内酶)的选择性抑制剂[1],是一种新型治疗良性前列腺增生(BPH)的药物,可减少急性尿潴留和减少BPH手术治疗。较非那雄胺作用更迅速,效果更显著,因该药的疗效确切、剂量小、副作用较低,因此受到患者的广泛好评[2]。

图1.酰氯法合成度他雄胺
3-酮-4-氮杂-5α-雄甾-1-烯-l7β-羧酸(代号:DT4,CAS#:104239-97-6)是合成度他雄胺的关键中间体,其合成工艺在我国已趋完善,其合成的收率、质量均居世界前列,价廉易得。
由DT4合成度他雄胺(代号:DTS),据文献报导,目前主要有以下几种方法:
1.酰氯法:文献[3-5]提供的是以甲苯或直接以吡啶为溶剂,以氯化亚砜或草酰氯为酰氯化试剂,经由 DT4-酰氯(III)与 2,5-双三氟甲基苯胺(2,5-bis(trifluoromethyl)aniline,BTFMA) 反应制备DTS的方法。收率分别为48%、85%与86%。

图2.混合酸酐法合成度他雄胺
该方法是目前仍较好的合成方法,但本法在合成过程中及后处理中产生的氯化氢废气在工业生产中会严重腐蚀生产设备。
2 混合酸酐法:文献[6-8]提供的是以乙腈为溶剂,将DT4在DBU催化下与特戊酰氯或甲磺酰氯制成混合酸酐(IV或V),再与BTFMA反应制备DTS的方法。收率70%。需要低温(-30℃)与强的路易氏酸BF3-乙醚溶剂催化反应。能耗高,工业生产危险性大,产品纯化较困难,不利于大规模生产。
3 新型中间体法:文献[9]提供的是将DT4酰氯法与氨反应制成DT4-酰胺(II),将BTFMA重氮化置换为2,5-双三氟甲基碘代苯(VI),二者以二甲苯为溶剂,以碳酸钾与铜粉催化,回流反应50-60小时制备DTS的方法。收率60%。反应时间长,能耗高,后处理复杂,不利于大规模生产。

图3.新型中间体法合成度他雄胺
本文在参考国内外文献的基础上,利用DT4羧基的酸性,与氨直接反应成DT4-铵盐(I);利用羧酸铵盐类易于脱水成酰胺的特性,将所得铵盐直接脱水成DT4-酰胺(II);再利用酰胺催化下与BTFMA进行胺交换反应成功制备了度他雄胺(DTS)。反应专属性好,产品易于纯化,三步反应总收率达92%以上,纯度达99.5%以上。产品结构经1H-NMR、13C-NMR、IR、MS予以确认。从根本上避免使用有害、有毒化学原料,工艺简便、收率高、质量好、成本低、三废少,符合绿色化学合成要求,适合工业化大规模生产。
合成路线如下:
2 实验部分
2.1 试剂与仪器
DT4(CAS#:104239-97-6,重庆万利康制药有限公司生产,HPLC纯度99.54%),20%氨水,二甲苯,乙腈,硫酸锆(Zr(SO4)2·4H2O,CAS:7446-31-3),N,N-二甲氨基吡啶(DMAP),对甲苯磺酸(PTS·H2O),硫氰化钾(KSCN),2,5-双三氟甲基苯胺(BTFMA,CAS#:328-93-8),甲苯,盐酸,片碱,无水乙醇,均为工业品。
熔点仪(RY-1,毛细管法,温度计未校正)
HPLC(Agilent 1200 Series)
NMR(ACF-300,溶剂:CDCl3)
IR(Nicolet 560E.S.PFITR,KBr压片)
MS(VGZAB-HS,测试条件:FAB)
2.2 合成路线
如图4所示.
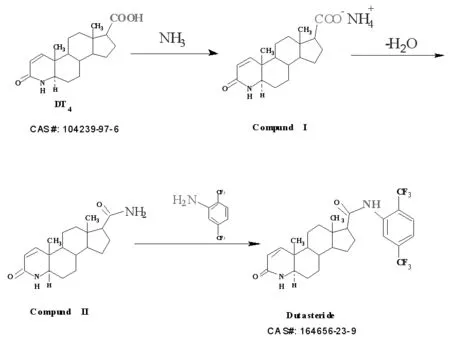
图4.度他雄胺合成新工艺
2.3 I与II的合成(成盐反应、脱水反应)
于装配有蒸馏浓缩并配好尾气吸收装置的洁净1000ml反应瓶中,投入浓度为20%的氨水600 ml、搅拌下投入50.00g DT4,缓慢升温至80℃,保温至反应液由浑浊逐渐变得澄清时,标志成盐反应完成,再继续升温浓缩至大量析出并稠厚,冷却至60℃以下,加入500ml二甲苯,改蒸馏浓缩装置为回流分水装置,升温至回流,分水反应至馏出液澄清时,标志脱水反应完成,再继续升温浓缩至大量析出并稠厚。降至室温,过滤,用100ml二甲苯分次洗净反应瓶再洗滤饼,滤干,60℃真空干燥至恒重,得白色II结晶物49.62 g,收率99.54% (重量收率99.24%),HPLC纯度99.45%(HPLC归一法),不需精制,直接投入胺交换反应。
2.4 度他雄胺的合成
2.4.1 催化剂的制备
于250 ml洁净干燥反应瓶中依次加入50ml 20%的氨水、DMAP 20.0g,PTS 20.0g,KSCN 25.0g,常温下搅拌溶解完全,再于搅拌下缓慢加入硫酸锆粉末50.0 g,搅拌成糊状,继而固化成块。捣碎,研细,60℃真空干燥至恒重,密封备用。
2.4.2 度他雄胺的合成(胺交换反应)
于有回流装置的洁净1000ml反应瓶中,投入乙腈600 ml,纯化水40ml,II的白色结晶40.0g (126.41mmol),BTFMA25.0ml (163.2 3mmol),搅拌升温至50℃溶解完全得澄清透明溶液,加入前述自制催化剂12.0g,搅拌悬浊,续升温至回流反应18小时,TLC监控终点;反应完成后,过滤除去催化剂,少量乙腈洗饼至净,滤干,滤饼集中收集;滤液浓缩回收乙腈至稠厚,降温至60℃以下,加入甲苯500ml,用6N盐酸100ml3次洗涤,纯水100ml2次洗涤,5%NaOH 100ml3次洗涤,最后用纯水100ml4次洗涤至中性,分尽水层与絮状物,减压浓缩回收甲苯至干,每次用30ml无水乙醇浓缩带干两次,再加入100ml无水乙醇,升温溶解完全,搅拌下降温至室温,析晶3小时;过滤,少量无水乙醇分多次洗涤滤饼,滤干,85℃真空干燥至恒重,得白色度他雄胺结晶性粉末物61.85 g,收率92.59%(重量收率 154.63%),MP:246.4~248.2℃(文献[3]:245-245.5℃),纯度 99.61%(HPLC 归一法)。

3 结果与讨论
在I与II的合成中,我们避免了文献[9]的非水体系的酰氯法,而是采用了氨水与DT4直接成盐溶于反应体系的含水体系的合成方法,降低了对设备的腐蚀程度,也大大简化了操作程序,同时降低了能耗,提高了产品的纯度与收率,所得产品几乎以理论收率得到无需纯化的化合物II,可直接投入下步反应。
成盐反应与脱水反应过程中除了有尾气氨放出外,几乎没有废水与废渣排放;发生的尾气为纯净的氨,通过吸收,可以重复利用;脱水反应所用的二甲苯在反应过程中几乎无损耗而循环利用。此举既可降低对环境的影响,又可进一步降低生产成本。
2.2在II合成度他雄胺的反应中,我们对催化剂的制备与用量进行了大量的探索工作,终于摸索得到一种催化效果好、用量省、价格便宜、制取简便、后处理方便(只需过滤即可实现分离)、可重复套用的催化剂。通过摸索发现,当催化剂用量为底物质量的30%时催化胺交换反应的效果最好,几乎生成理论量的度他雄胺。此举既节省了辅料成本,更重要的是产物纯度高,精制简单方便,提高了工效,降低了操作难度,更便于工业规模生产。
反应及后处理过程中均避免了使用有害、有毒化学原料,无废气与废渣产生,废水中含有的少量盐类可直接排放。
4 结论
以DT4为起始原料,经成盐、脱水与胺交换三步反应合成度他雄胺,反应中避免使用对环境敏感的氯化亚砜、草酰氯、特戊酰氯或甲磺酰氯;也无需使用昂贵的特种催化剂如DBU与铜粉等;避免使用有害、有毒化学原料,产品收率好,纯度高,易精制,操作简便,成本低,三废少,符合绿色化学合成要求,为实现度他雄胺的高收率高纯度绿色化大规模清洁生产奠定了良好的工业化基础。
[1]Frye S V.Bramson H N,Hermann D J,et a1.Discovery and Development of GG745,a Potent Inhibitor of Both Isozymes of 5a-Reductase[J].Pharm Biotechnol,1998,11:393-422
[2]Clark R V,Hermann D J,Cunningham G R,eta1.Marked Suppression of Dihydrotestosterone in Men with Benign Prostatic Hyperplasia by Dutasteride,a Dual 5a-Reductase Inhibitor[J].J Clin Endoerinol Metab,2004,89(5):2179-2184.
[3]Androstenone derivative[P]:WO,95/07927
[4]李启彬,巩新玉等.度他雄胺的合成分析[J].中国医药指南,2008,6(20):153-154
[5]何明华,廖清江.度他雄胺的合成[J].化工时刊,2009,23(3):44-46
[6]Solid and crystalline dutasteride and processes forpreparation thereof [P]:WO,2009/083258A2
[7]An improved process for the preparation of dutasteride[P]:WO,2011/004242A2
[8]Solid and crystalline dutasteride and processes for preparation thereof [P]:US,2009/0203724A1
[9]Process for the preparation of 17beta-N-[2,5-bis(trifluoromethyl)phenyl]carbamoyl-4-aza-5-alpha-androst-1-ene-3-one[P]:US,2005/0059692A1
