低分子肝素在冠脉造影和PCI术中抗凝的有效性和安全性研究
2011-07-30魏友平高招波范剑峰郑春华万明勇张春花熊旭华涂群芳
魏友平,高招波,范剑峰,郑春华,万明勇,张春花,熊旭华,涂群芳
南昌市第一医院心内二科,江西南昌 330008
低分子肝素(LMWH)在冠心病治疗中的作用已得到充分的肯定。多项国际多中心临床研究均已显示,对于急性冠状动脉综合征(ACS)患者应用低分子肝素(LMWH)较静脉普通肝素(UFH)治疗效果更佳,然而在冠心病经皮冠状动脉介入治疗(PCI)中以LMWH取代静脉UFH是否可行,目前尚无定论。本文主要探讨LMWH在冠心病冠脉造影和PCI中的疗效和安全性。
1 资料与方法
1.1 一般资料
将我院2006~2009年290例单独行冠脉造影或同时需行PCI术的患者列为研究对象。按是否使用LMWH将患者分为两组,实验组使用LMWH,对照组使用UFH,主要排除标准为低分子肝素使用有禁忌者。实验组140例中,男85例,女 55 例,年龄(66.50±0.36)岁;对照组 150 例,男 89例,女61例,年龄(69.50±0.96)岁。两组患者在高血压、糖尿病、高脂血症、急性心肌梗死、冠心病外科治疗(CABG)等病史的例数分布方面比较,差异无统计学意义(P>0.05),具有可比性。见表1。
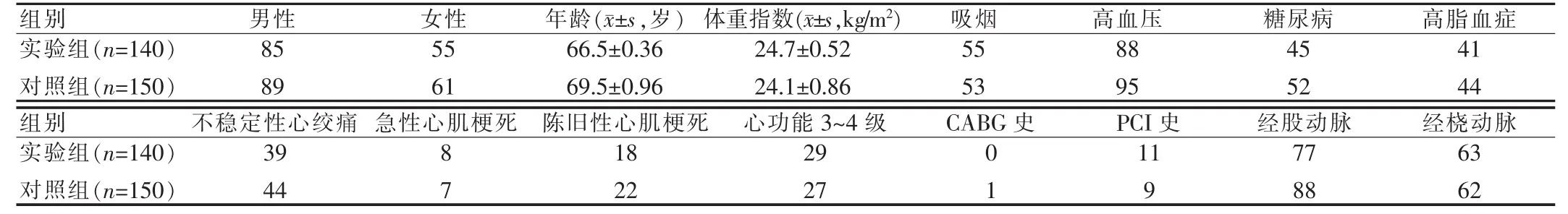
表1 入选患者一般资料比较(例)
1.2 研究方法
①冠脉造影术及PCI治疗操作同常规。②在动脉穿刺成功后经鞘管给予普通肝素5000 U或低分子肝素0.5 mg/kg。冠脉造影后需要进行PCl术的患者,对照组补充肝素至100 U/kg,如手术时间超过2 h,对照组追加肝素3000 U,实验组追加低分子肝素至0.25 mg/kg。③术后实验组即刻拔除动脉鞘管,平卧12 h;对照组在术后4 h测激活凝血时间(ACT)<180 s时拔管,拔管后再平卧12 h。④术中不监测抗凝。⑤其他治疗:抗血小板药物,术前3 d给予阿司匹林100 mg/d及氯吡格雷75 mg/d,或术前24 h给予负荷量的氯吡格雷300 mg及阿司匹林300 mg;长期服用氯吡格雷75 mg/d及阿司匹林100 mg/d。金属裸支架术后至少服用6个月、药物涂层支架术后至少服用1年。其他药物如β受体阻滞剂、ACEI等及其他常规治疗根据病情决定,术后肝素的应用视病情而定。⑥评价住院期间和介入治疗后30 d临床终点事件(主要终点事件为心源性死亡、心肌梗死、急诊血运重建、中风;次要终点事件为假性动脉瘤、血肿、出血事件)的发生情况。
1.3 统计学方法
采用SPSS 13.0软件进行分析。计量资料数据以均数±标准差(±s)表示,组间比较采用t检验;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 冠脉造影及PCI情况
介入手术均在2 h内完成,手术成功率为100%。两组患者冠脉造影及PCI术中均无急性血管闭塞和紧急冠脉血运重建。见表2。
2.2 两组终点事件发生率比较
介入治疗后30 d内,对照组动脉穿刺部位的假性动脉瘤6例,实验组2例;皮下血肿对照组13例,实验组4例;两项次要终点事件发生率实验组分别为1.43%(2/140)、2.86%(4/140),对照组分别为 4.00%(6/150)、8.67%(13/150),两组比较,差异有统计学意义(P<0.05);对照组住院期间有 1例患者发生了非ST段抬高性心肌梗死,主要终点事件的发生率为0.67%(1/150),实验组为0,低于对照组,但差异无统计学意义(P>0.05)。见表3。
3 讨论
急性ST段抬高性心肌梗死(STEMI)应用普通肝素(UFH)抗凝治疗已有近50年历史,临床实践充分证明了其有效性。80年代病理学研究发现不稳定性心绞痛(UA)/急性非ST段抬高性心肌梗死(NSTEMI)和STEMI有着相同的病理基础,提示UA/NSTEMI抗凝治疗的必要性。大量临床研究证实,UA/NSTEMI应用UFH抗凝治疗可进一步降低早期(<5 d)心血管死亡风险(降低56%)[1],奠定了UFH在UA/NSTEMI治疗中的地位。2002年ACC/AHA UA/NSTEMI治疗指南提出,UA/USTEMI的抗凝治疗使用低分子肝素(LMWH)治疗优于普通肝素(UFH)。2007年ACC/AHA和ESC UA/NSTEMI治疗指南[2-3]以及2007 ACC/AHA STEMI[4]治疗指南更新了对低分子肝素的推荐,应用建议更加具体、明确地推荐依诺肝素作为ACS抗凝治疗药物。

表2 冠脉造影及PCI情况(例)

表3 终点事件发生率比较[n(%)]
LMWH优于UFH的药效学特性为:①抗凝作用稳定,抗凝效果呈明显的剂效关系,不需要定期监测抗凝强度。②抗凝作用具有可预测性,组织因子旁路抑制剂(tissue factor pathway inhibitor,TFPI)是肝素类药物预防血栓形成的主要机制,有研究显示,连续使用UFH 5 d后,UFH促进TFPI释放的作用完全消失,而依诺肝素具有持续稳定的促进TFPI释放作用[4-5]。③肝素诱导的血小板减少症发生率低,依诺肝素激活血小板和与血小板第4因子(platelet factor 4,PF4)结合的能力显著弱于UFH,较少引起肝素诱导的血小板减少症[6]。④对血小板激活为主形成的血栓抗凝作用优于UFH,依诺肝素受PF4影响显著小于UFH,不影响凝血块内血小板的清除,对于富含血小板的血栓,依诺肝素抗凝作用优于UFH[7]。这是依诺肝素对ACS抗凝作用强于UFH的机制之一。
因为UFH有着不可预料的剂量反应、出血及其他不良反应,动摇着其在PCI术中抗凝的地位。LMWH抗Ⅹa活性较UFH高,主要是通过阻断凝血因子Ⅹa活性抗凝,有更强的抗凝作用;抗凝活性更容易预测,抗凝效果相对稳定;引起出血的危险性降低。已有研究显示,在导管介入手术中以静脉注射LMWH代替UFH抗凝可能是安全的。
2002年AHA/ACC最新的PCI指南建议术中用UFH抗凝。但应用LMWH在冠脉造影和PCI术中抗凝目前在国内少数医院开展。LMWH在冠心病治疗中的作用已经得到了充分的肯定。多项国际多中心临床研究均已显示,对于ACS患者应用LMWH较静脉UFH有更佳的治疗效果,然而在冠心病PCI术中以LMWH取代静脉UFH是否可行,目前尚无定论。
Collet等[8]的首先报道451例UA/USTEMI患者在PCI前至少48 h开始皮下注射LMWH,在距最后1次皮下注射LMWH的8 h内完成PCI术,术中不再追加UFH或LMWH。结果显示,最后1次应用依诺肝素8 h内抗Ⅹa活性是稳定的,PCI后未发生院内急性闭塞或急性血运重建事件,该研究初步显示LMWH用于PCI可能较为安全;且疗效优于低剂量的UFH。Madan等[9]研究表明,依诺肝素在心血管不良事件(MACE)及出血的发生率(8%,5%)上少于普通肝素(14%,10%),但两者比较,差异均无统计学意义。
本研究中,在介入手术经鞘管弹丸式推注LMWH,入选后30 d内两组术后主要终点事件发生率,对照组终点事件的发生率为0.67%,高于实验组(0),但两组比较,差异无统计学意义(P>0.05)。对照组动脉穿刺部位的假性动脉瘤6例,皮下血肿13例;实验组动脉穿刺部位的假性动脉瘤2例皮下血肿4例,均低于对照组,差异有统计学意义(P<0.05)。
由此可见,LMWH在冠脉造影和PCI术中应用安全,且明显减少假性动脉瘤、血肿及出血并发症。该研究方案具有一定的可行性。近年来有许多因心脏介入术后较长时间卧床而并发肺栓塞致死的报道,实验组术后立即拔除动脉鞘管,缩短了卧床时间,减少了血栓栓塞并发症的发生,同时减少了压迫止血的时间,减轻了医务人员劳动强度,具有较好的应用前景。本研究结果初步显示了LMWH在冠脉造影和PCI术中抗凝的有效性和安全性。当然,这还需要更大样本量的临床研究进一步证实。
[1]Cohen M,Adams PC,Parry G,et al.Combination antithrombotic therapy in unstable rest angina and non-Q-wave infarction in nonprior aspirin users.Primary end points analysis from the ATACS trial.Antithrombotic Therapy in acute coronary syndromes research group[J].Circulation,1994,89(1):81-88.
[2]Albert N,American College of Cardiology,American Heart Association.Non-ST segment elevation acute coronary syndromes:treatment guidelines for the nurse practitioner[J].J Am Acad Nurse Pract,2007,19(6):277-289.
[3]Ferguson JJ,Wilson JM,Diez J.Antithrombotic therapy and the transition to the catheterization laboratory in UA/NSTEMI[J].Minerva Cardioangiol,2007,55(5):529-556.
[4]Mousa S,Kaiser B.Tissue factor pathway inhibitor in thrombosis and beyond:role of heparin[J].Drugs of the Future,2004,29(7):751-766.
[5]Tobu M,Ma Q,Lqbal O,et al.Comparative tissue factor pathway inhibitor release potential of heparin[J].Clin Appl Thromb Haemost,2005,11(1):37-47.
[6]Greinacher A.Heparin-induced thrombocytopenia:frequency and pathogenesis[J].Pathophysiol Haemost Thromb,2006,35(1-2):37-45.
[7]Weitz JI.Low-molecular-weight heparins[J].N Engl J Med,1997,337(10):688-698.
[8]Collet JP,Montalescot G,Lison L,et al.Percutaneous coronary intervention after subcutaneous enoxaparin pretreatment patients with unstable angina pectoris[J].Circulation,2001,103(5):658-663.
[9]Madan M,Radhakrishnan S,Reis M,et al.Comparison of enoxaparin versus heparin during elective percutaneous coronary intervention performed with either eptifibatide or tirofiban(the ACTION Trial)[J].Am J Cardiol,2005,95(11):1295-1301.