黄芩苷与利巴韦林联用体内外抗流感病毒作用
2011-07-28何子华付阳劲韦兰萍何蓉蓉栗原博杨耀智陈建新
何子华,付阳劲,韦兰萍,何蓉蓉,栗原博,杨耀智,陈建新
(1.华南农业大学兽医学院,广东 广州 510640;2.暨南大学中药及天然药物研究所,广东 广州 510632)
近年来流感频繁爆发,严重危害人类和动物生命健康。2003年底爆发的高致病性禽流感,不仅造成全球数千万家禽、野禽死亡,而且导致250余人感染死亡,死亡率高达60%[1]。2009年4月源于北美的新型甲流很快席卷全球,并导致万余人死亡[2]。尽管人类对流感的认识已有近百年历史,但现有防治流感(特别是高致病性流感)的医药技术仍十分薄弱。可用于流感防治的药物品种很少,主要有M2离子通道抑制剂金刚烷胺和金刚乙胺、神经氨酸酶抑制剂奥司米韦(俗称“达菲”)和扎那米韦及广谱抗病毒药利巴韦林三类药物。金刚烷胺临床上应用了多年,多种亚型流感毒株对其已产生严重的耐药性[3],而达菲价格昂贵,且病毒对其耐药性的报道也日渐增多[4]。为提高药物疗效,减缓流感毒株耐药性的产生,抗流感药物的联用成为近年来国际医药界的研究热点。
黄芩是重要的清热解毒类中药,具有抗菌、抗病毒、抗炎等多种药理作用[5]。黄芩苷(baicalin)及其苷元黄芩素 (baicalein)在黄芩中的含量分别高达10.1%和5.4%[6],是黄芩的主要药效成分。文献报道[7-8]和本课题组研究结果表明黄芩苷对感染流感病毒小鼠具有明显保护作用。利巴韦林 (ribavirin)是病毒合成酶的竞争性抑制剂,为广谱抗病毒药,临床上常用于流感防治。本文利用流感病毒MDCK细胞感染和小鼠感染模型,首次对联合使用黄芩苷和利巴韦林的抗流感病毒效果进行了评价,旨在为临床合理用药提供实验依据。
1 材料与方法
1.1 药物 黄芩苷购于四川省维克奇生物科技有限公司,纯度≥98%;利巴韦林,广东肇庆星湖生物化学制药厂出品,含量98.5%,批号L040328;帕拉米韦,本实验室合成,纯度≥96%。
1.2 试剂 4-MUNANA(4-methylumbelliferyl-а-DN-acetylneuraminate)、MES 2-(N-吗啡啉)乙磺酸(Sigma公司);Nonidet P40(NP-40,BDH公司);MTT(Amresco公司);DMEM(Invitrogen公司)。
1.3 仪器 ELX-800UV酶标检测仪,Flx800荧光酶标检测仪(BioTek公司)。
1.4 细胞和病毒 狗肾细胞传代细胞株 (MDCK)购自中国科学院上海生命科学院细胞资源中心;A/PM/1/47(H1N1)流感病毒(FM1株)购自中国医学科学院生物技术研究所,A/Chicken/Guangdong/96(H9N2),A/Duck/Guangdong/99(H5N1)流感病毒由华南农业大学兽医科技中心惠赠。上述病毒经本研究室传代扩增并保存。H5N1细胞试验在生物安全三级实验室进行。
1.5 动物 体质量15~17 g的SPF♀ BALB/c小鼠,购自广东省医学实验动物中心,动物合格证号:SCXK(粤)2008-0002。
1.6 方法
1.6.1 药物细胞毒性试验 将指数生长期的细胞接种于96孔细胞培养板,待其生长至单层,加入DMEM倍比稀释的药物,同时设正常细胞对照。于37℃、5%CO2培养箱中培养72 h后,用 MTT法检测药物对MDCK细胞的毒性,按 Reed-Muench法计算药物对细胞半数有毒浓度(CC50)。
1.6.2 药物对流感病毒感染MDCK细胞的保护实验
1.6.2.1 合并指数法(CI)[9]单独给药:在无毒浓度范围内用基础培养液 (含青、链霉素各100 IU的DMEM培养液)将药物倍比稀释成不同浓度,加入到培养有单层 MDCK细胞的96孔细胞培养板中,每孔50 μl,每个稀释度4 孔。每孔加入50 μl含有100倍TCID50的病毒液。同时设置正常组、病毒对照组和帕拉米韦阳性药物对照组。37℃培养箱中培养,当病毒对照组的细胞病变(CPE)达到4+时,观察并记录各组的CPE结果。MTT法测定OD值,按下列公式计算药物对感染病毒MDCK细胞的保护率,用SPSS13.0统计软件的 Probit回归法计算半数有效浓度 (EC50)。

联合给药:选取黄芩苷 EC50以下的浓度,与倍比稀释的利巴韦林等体积混合,加入长有单层MDCK细胞的96孔细胞培养板中,每孔50 μl,其他步骤与单独给药相同,根据OD值计算保护率和EC50
值。选取利巴韦林EC50以下的浓度,同样方法测定其与黄芩苷联合应用后 EC50值。运用合并指数法分析两种药物的相互作用情况。
1.6.2.2 MacSynergyⅡ分析法[10]在无毒浓度范围内将黄芩苷用基础培养液进行倍比稀释,共10个浓度,以50 μl每孔横向加入长有单层 MDCK细胞的96孔细胞培养板,每个纵列为同一浓度。将利巴韦林用基础培养液进行倍比系列稀释,共7个浓度,50 μl每孔纵向加入同一细胞培养板,每个横排为同一浓度。每孔加入50 μl含有100倍 TCID50的病毒液。设置病毒对照,帕拉米韦阳性药物对照和正常对照,37℃培养箱中培养。当病毒对照组的细胞病变达到4+时,观察并记录各组的CPE结果。同时MTT法测定OD值。实验重复3次,实验数据用MacSynergyⅡ软件进行统计,分析药物相互作用的情况。
1.6.3 黄芩苷对流感病毒神经氨酸酶(NA)的抑制活性[11]分别用 H1N1、H5N1和 H9N2亚型流感病毒 (TCID50分别为 10-2.7/0.1 ml,10-5.8/0.1 ml和10-3.9/0.1 ml)感染 MDCK 细胞,制备 3种病毒的NA原酶液。酶促反应体系中含有33 mmol·L-1MES 缓冲液 (pH 6.5)、4 mmol·L-1CaCl2、20 μmol·L-1MUNANA 和适量的酶溶液,终容积 100 μl。37℃孵育 15 min后加入 150 μl反应终止液 (含83%乙醇、14 mmol·L-1NaOH、pH 10.7)终止反应,荧光酶标检测仪测定荧光强度值,计算药物对流感病毒NA的抑制率。
1.6.4 药物对感染流感病毒小鼠的保护实验 攻毒给药:将小鼠随机分为正常对照组、病毒对照组、实验药物组,每组10只。小鼠在乙醚轻度麻醉下,滴鼻感染5倍LD50的H1N1病毒稀释液,正常对照组滴予等量生理盐水。灌胃给药,病毒对照组给予等量生理盐水,感染前1 d开始给药,每天2次,每次0.2 ml,连续给药7 d。逐日观察动物发病情况并记录死亡数,共观察21 d,根据观察结果计算每组死亡小鼠存活率及平均存活时间。隔天称量小鼠体重,计算每组存活小鼠的平均体重。
1.6.5 数据分析 所用数据用统计软件 SPSS 13.0 for Windows软件汇总并作统计学处理,数值表示为±s,小鼠存活率组间比较采用χ2检验,其它参数组间比较采用t检验。
合并指数法的基础是 Loewe Additivity模型,公式表示为 CI=CA/EC50,A+CB/EC50,B,其中 EC50,A和 EC50,B是药物 A、B单独应用时产生50%效应的浓度,CA和CB是联合应用达到50%效应时药物A、B的浓度。CI值等于、小于、大于1分别定义两药为相加、协同和拮抗作用[9]。
MacSynergy II分析法的基础是 Bliss Independence模型。通过MacSynergyⅡ软件,OD值将转化为保护率,并从各药物单独作用的量效关系计算药物联合应用的理论相加值。联合用药试验中获得的实际效应值减去该理论相加值,得到的正值表示协同作用,得到的负值表示拮抗作用。把所有的正值加起来则为协同量,所有的负值加起来则为拮抗量,单位为:(mmol·L-1)2%。协同量大于100定义为协同作用,拮抗量小于-100定义为拮抗作用;拮抗/协同量在 -100~100之间定义为相加作用[10,12]。
2 结果与分析
2.1 细胞毒性 黄芩苷和利巴韦林对MDCK细胞的 CC50分别为 2.24 mmol·L-1和 2.66 mmol·L-1,表明黄芩苷的细胞毒性比利巴韦林稍大。
2.2 联合用药对病毒感染MDCK细胞的保护作用2.2.1 合并指数法 黄芩苷和利巴韦林单独给药及联合给药对感染3种亚型流感病毒 MDCK细胞的保护效果 (EC50)见Tab 1。结果表明,在联合给药中两种药物的 EC50都小于单独给药。对 H9N2病毒联合给药效果尤为明显,黄芩苷单独给药的EC50为 0.80 mmol·L-1,与 0.13 mmol·L-1利巴韦林联合给药时,其 EC50为 0.09 mmol·L-1,减少8.8倍(Tab 1)。
以黄芩苷为参照,按照判断标准,黄芩苷与利巴韦林联合应用对H1N1病毒的抑制表现为轻度协同作用,对H5N1病毒和H9N2病毒表现为协同作用。以利巴韦林为参照,黄芩苷与利巴韦林联用对H1N1病毒和 H5N1病毒表现为轻微的协同作用,而对H9N2病毒表现为协同作用。综合两种结果,可以认为黄芩苷与利巴韦林联合应用对H1N1病毒和H5N1病毒表现为轻度协同作用,而对 H9N2病毒表现为协同作用。

Tab 1 Inhibitory effects of baicalin and ribavirin against replication of influenza viruses in MDCK cells when used alone or in combination
2.2.2 MacSynergyⅡ分析 根据实验结果 (未列出)及 MacSynergy II软件计算结果,黄芩苷与利巴韦林联用对 H9N2病毒的抑制协同量/拮抗量为(906/-5)(mmol·L-1)2%;对 H5N1 病毒的协同量/拮抗量为(84/-12)(mmol·L-1)2%;对 H1N1的协同量/拮抗量为(93/-15)(mmol·L-1)2%。表明黄芩苷与利巴韦林联用对H9N2病毒表现为高度协同作用,而对 H5N1和 H1N1病毒表现为相加作用。
2.3 黄芩苷对流感病毒NA的抑制活性 黄芩苷对3种亚型流感病毒NA活性都有明显抑制作用,对H1N1、H5N1、H9N2 3种亚型流感病毒NA的50%活性抑制浓度 (IC50)值分别为0.29,0.49和0.47 mmol·L-1。
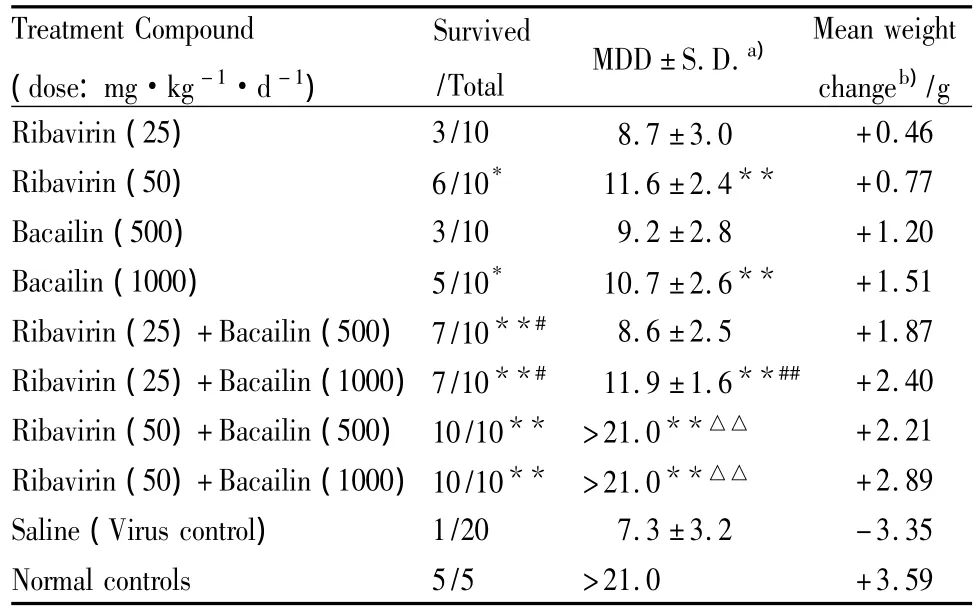
Tab 2 Protective effects of baicalin and ribavirin on mice infected with H1N1 virus when used alone or in combination
2.4 联合用药对H1N1流感病毒感染小鼠的保护作用 口服 25 mg·kg-1·d-1的利巴韦林和 500 mg·kg-1·d-1的黄芩苷,虽然感染小鼠的存活率达到30%,但与病毒对照组相比差异无显著性。口服 50 mg·kg-1·d-1的利巴韦林和 1000 mg·kg-1·d-1的黄芩苷,感染小鼠的存活率明显升高,分别为60%和 50%(Tab 2)。因此,以 25、50 mg·kg-1·d-1的利巴韦林分别与 500、1000 mg·kg-1·d-1的黄芩苷组方联合给药。两药联用后感染小鼠的存活率、平均存活时间 (MDD)和平均体重均有不同程度的改善(Tab 2),表明两药联用对防治小鼠流感具有协同效应。当50 mg·kg-1·d-1的利巴韦林与黄芩苷 (500 或1000 mg·kg-1·d-1)联用时,对感染小鼠的保护率达到100%。此外,黄芩苷单用或联用对感染小鼠的体重下降的抑制作用优于单用利巴韦林。
3 讨论
流感病毒抗原易变异及进化,易产生耐药毒株。耐药毒株的传播给流感的防治带来困难和挑战。而不同作用机制的抗流感药物联用可克服药物单用的缺点,为流感的防治提供新的方法。
本文研究结果表明,黄芩苷和利巴韦林联用具有相加或协同的抗流感效应。药物联用对不同亚型流感毒株的效果有差异,文献也有类似报道。Nguyen等[10]发现金刚乙胺加利巴韦林对 H3N2病毒表现为协同抑制作用,而对 H1N1和对 H5N1病毒表现为相加的抑制作用;Govorkova等[13]和 Smee等[14]报道利巴韦林加奥司米韦联用在小鼠模型中的相互作用与病毒株、药物的剂量有关。
现代药理学研究表明,黄芩苷及其苷元黄芩素具有抗氧化、抗炎、抗菌、抗病毒、抗肿瘤和心血管保护等广泛的生物活性[15-18]。日本学者 Nagai等发现一种与黄芩素结构类似的化合物:5,7,4'-三羟基-8-甲氧基黄酮 (F36),不仅对病毒 NA有明显抑制活性 (IC50:55 μmol·L-1),而且对病毒复制周期早期阶段病毒颗粒与细胞内涵体/溶酶体的融合有明显抑制作用[19-20]。我们推测黄芩苷对流感病毒的抑制机制可能与F36相同。
流感病毒一旦感染机体,机体迅速启动免疫机制。免疫反应引发免疫细胞和炎症因子大量增殖并汇集肺部,导致细胞凋亡、毛细管通透性提高、白细胞渗出、肺水肿和气道堵塞等炎症连锁反应,导致肺功能受损,甚至最终使人或动物致死[21]。在流感病毒感染致病过程中,若能在给予抗病毒药物的同时应用免疫调节和抗炎药物,纠正免疫系统的失常,干预肺炎进程,最大限度地减少免疫过度导致的肺损害,则可显著减缓病毒感染引起的症状,减少人或动物的死亡。因此,抗炎药物与抗病毒药物的联用成为近年来抗流感研究的另一重要研究方向[22]。文献报道[23-24]和我们的实验结果均表明黄芩苷具有明显的抗炎活性,其对一氧化氮酶 (iNOS)、环氧化酶-2(COX-2)和核因子 (NF-κB)等炎症通路均具有抑制活性[25-26]。
利巴韦林进入体细胞后迅速被磷酸化,其产物对参与病毒合成的多种酶均有抑制作用,是一种广谱抗病毒药物。其对流感病毒的抑制主要作用于RNA聚合酶。利巴韦林和黄芩苷对流感病毒的作用靶点及机制不同,决定了二者联用可能产生协同作用。二者联用在临床上的适宜剂量、可能产生的副作用还需要深入研究。此外,临床上主要应用“清开灵”和“双黄连”等富含黄芩苷的复方制剂防治流感,这些中成药与利巴韦林联用的相互作用情况也值得探讨。
[1] Wong S,Yuen K Y.Avian influenza virus infections in humans[J].Chest,2006,129(1):156 -68.
[2] Freund R,Le R C,Charlier C,et al.determinants of non-vaccination against pandemic 2009 h1n1 influenza in pregnant women:a prospective cohort study[J].PLoS ONE,2011,6:1 -7.
[3] Deyde V M,Xu X,Bright R A,et al.Surveillance of resistance to adamantanes among influenza A(H3N2)and A(H1N1)viruses isolated worldwide[J].Infect Dis,2007,196:249 -57.
[4] de Jong M D,Tran T T,Truong H K,et al.Oseltamivir resistance during treatment of influenza A(H5N1)infection[J].N Engl J Med,2005,353:2667 -72.
[5] 宋琳莉,孟庆刚.黄芩的药理作用研究进展[J].中华中医药学刊,2008,26(8):1676-8.
[5] Song L L,Meng Q G.Study development on pharmacodynamics effect of Scutellaria[J].Chin Arch Tradit Chin Med,2008,26(8):1676-8.
[6] 王宏志,喻春皓,高 钧,等.HPLC分析比较炮制和提取方法对黄芩活性成分的影响[J].中国中药杂志,2007,32(16):1637-40.
[6] Wang H Z,Yu C H,Gao J,et al.Effects of processing and extracting methods on active components in Radix Scutellariae by HPLC analysis[J].China J Chin Mat Med,2007,32(16):1637-40.
[7] Xu G,Dou J,Zhang L,et al.Inhibitory effects of baicalein on the influenza virus in vivo is determined by baicalin in the serum[J].Biol Pharm Bull,2010,33:238 -43.
[8] 初正云,初 明,滕 宇.黄芩苷体内抗流感病毒作用[J].中国中药杂志,2007,22(33):2413 -5.
[8] CHU Z Y,Chu M,Teng Y .Effect of baicalin on in vivo anti-virus[J].China J Chin Mat Med,2007,22(33):2413 -5.
[9] Berenbaum M C.A method for testing for synergy with any number of agents[J].Infect Dis,1978,137(2):122 - 30.
[10] Nguyen J T,Hoopes J D,Smee D F,et al.Triple combination of oseltamivir,amantadine,and ribavirin displays synergistic activity against multiple influenza virus strains in vitro[J].Antimicrob A-gents Chemother,2009,53(10):4115 -26.
[11]黄深惠,汤有志,周雪梦,等.茶多酚体内外抗流感病毒作用研究[J].茶叶科学,2010,30(4):302-8.
[11] Huang S H,Tang Y Z,Zhou X M,et al.Study on anti-influenza virus effect of tea polyphenols in vitro and in vivo[J].Tea Sci,2010,30(4):302-8.
[12] Prichard M N,Pilchard L E,Shipman C J.Strategic design and three-dimensional analysis of antiviral drug combinations[J].Antifimicrob Agents Chemother,1993,37(3):540 -5.
[13] Govorkova E A,Fang H B,Tan M,et al.Neuraminidase inhibitor-rimantadine combinations exert additive and synergistic antiinfluenza virus effects in MDCK cells[J].Antimicrob Agents Chemother,2004,48(12):4855 -63.
[14] Smee D F,Wong M H,Bailey K W,et al.Activities of oseltamivir and ribavirin used alone and in combination against infections in mice with recent isolates of influenza A(H1N1)and B viruses[J].Antivir Chem Chemother,2006,17(4):185 -92.
[15]王玉刚,吴 昊,孟 甄,等.黄芩总黄酮对金葡菌肺感染模式识别受体TLR2/Nod2及其相关炎性因子表达的影响[J].中国药理学通报,2009,25(7):866-70.
[15] Wang Y G,Wu H,Meng Z,et al.Effect of total flavonoids of Radix Scutellariae on TLR2/Nod2 expression in lung after infection of Staphylococcus aureus in vivo and in vitro[J].Chin Pharmacol Bull,2009,25(7):866 -70.
[16]洪 铁,杨 振,绳 娟,等.黄芩苷抗肿瘤作用及机制的研究[J].中国药理学通报,2008,24(12):1676-8.
[16] Hong T,Yang Z,Sheng J,et al.Experimental study on the anti- tumor effects and mechanisms of baicalin[J].Chin Pharmacol Bull,2008,24(12):1676 -8.
[17]张喜平,李宗芳,刘效恭.黄芩素的药理学研究概况[J].中国药理学通报,2001,17(6):711-3.
[17] Zhang X P,Li Z F,Liu X G.Review in pharmacological study of Baicalein[J].Chin Pharmacol Bull,2001,17(6):711 -3.
[18] Li-Weber M.New therapeutic aspects of flavones:the anticancer properties of Scutellaria and its main active constituents Wogonin,Baicalein and Baicalin[J].Cancer Treat Rev,2009,35(1):57 -68.
[19] Nagai T,Miyaichi Y,Tomimori T,et al.Inhibition of influenza virus sialidase and anti-influenza virus activity by plant flavonoids[J].Chem Pharm Bull,1990,38:29 -32.
[20] Nagai T,Moriguchi R,Suzuki Y,et al.Mode of action of the anti-influenza virus activity of plant flavonoid,5,7,4'-trihydroxy-8-methoxyflavone,from the roots of Scutellaria baicalensis[J].Antivir Res,1995,26:11 -25.
[21] Tracy H,Robert S,Ian R,et al.Co-stimulation:novel methods for preventing viral-induced lung inflammation[J].Trends Mol Med,2004,10(8):379 -86.
[22] Zheng B J,Chan K W,Lin Y P,et al.Delayed antiviral plus immunomodulator treatment still reduces mortality in mice infected by high inoculum of influenza A/H5N1 virus[J].Proc Natl Acad Sci,2008,105:8091 -6.
[23] Hong T,Ji G B,Cho S,et al.Evaluation of the anti-inflammatory effect of Baicalein on dextran sulfate sodium-induced colitis in mice[J].Planta Med,2008,68:268 -71.
[24] Lin C C,Shieh D E.The anti-inflammatory activity of Scutellaria rivularis extracts and its active components,baicalin,baicalein and wogonin[J].Am J Chin Med,1996,24(1):31 -6.
[25] Chen Y C,Shen S C,Chen L G,et al.Wogonin,Baicalin and Baicalein inhibition of inducible nitric oxide synthase and cyclooxygenase-2 gene expressions induced by nitric oxide synthase inhibitors and lipopolysaccharide[J].Biochem Pharmacol,2001,61:17-27.
[26] Woo K J,Lim J H,Suh S,et al.Differential inhibitory effects of baicalein and baicalin on LPS-induced cyclooxygenase-2 expression through inhibition of C/EBPβ DNA-binding activity[J].Immunobiology,2006,211:359 -68.
