预先给予酪氨酸激酶抑制剂IPTRK3对神经源性疼痛的影响
2011-07-28马伟英何惠燕纪风涛梁建军广濑宗孝曹铭辉
马伟英,何惠燕,纪风涛,刘 玲,梁建军,广濑宗孝,曹铭辉
(中山大学孙逸仙纪念医院1.麻醉科、2.消毒供应中心,广东 广州 510120;3.福井大学医学部麻醉和复苏科,福井910-1193,日本)
神经源性疼痛是临床上常见的难治性疼痛,目前尚没有安全有效的药物[1]。研究发现,局部或系统注射神经生长因子(nerve growth factor,NGF)可引起痛觉过敏和异常疼痛。NGF主要作用于其高亲和力受体——酪氨酸激酶(tyrosine kinase,TrkA),增加TrkA磷酸化水平,致敏并上调伤害性感觉神经元如瞬时感受器电位香草酸受体1(Transient receptor potential vaniloid 1,TRPV1),激活下游的伤害性因子,参与神经源性疼痛形成,有研究表明给予NGF或TrkA拮抗剂可以阻断这一过程,减轻神经源性疼痛[2]。实验证明IPTRK3(一种新合成的细胞穿透肽)可以抑制NGF引起的PC12细胞TrkA磷酸化以及TRPV1的表达增加,但对与TrkA具有同源性的胰岛素受体和表皮生长因子受体磷酸化无明显影响,是特异性的TrkA抑制剂[3]。动物实验也发现IPTRK3可明显抑制背根神经节(dorsal root ganglion,DRG)TRPV1 表达增加,减轻炎性疼痛[4]。我们前期的研究发现,部分坐骨神经结扎引起的神经源性疼痛小鼠术后7 d腹腔单次注射IPTRK3可明显缓解热、机械痛觉过敏24 h[5]。Fos蛋白是原癌基因c-fos的表达产物,是检测镇痛药物镇痛效果的常用神经元标志物[6]。有研究表明在疼痛刺激之前给予镇痛药可以减轻手术刺激所致的中枢神经元兴奋,以达到术后镇痛目的[7]。本实验通过建立小鼠神经源性疼痛模型,术前单次腹腔注射IPTRK3,观察IPTRK3对小鼠疼痛行为的治疗作用,及对DRG内TRPV1蛋白及脊髓背角Fos蛋白表达的影响,探讨预先给予 IPTRK3治疗神经源性疼痛的效果及其可能的作用机制。
1 材料与方法
1.1 动物及分组 72只♂ ddy小鼠,体质量25~35 g,由广东省动物实验中心提供,4只一笼,动物在12:12 h的黑夜/白昼环境中饲养,避免强光及噪音刺激,自由摄取水和食物。实验小鼠随机分为3组(每组24只):①假手术组(sham):腹腔单次给予PBS,10 min后切开暴露坐骨神经,然后依次缝合肌肉皮肤;② 部分坐骨神经结扎(partial sciatic nerve ligation,PSNL)组:腹腔单次给予PBS,10 min后行PSNL;③ IPTRK3组:腹腔单次给予 IPTRK3(10 mg·kg-1),10 min后行 PSNL术。各组随机取12只小鼠于不同时间点测疼痛行为学,随机取6只于术后2 h取新鲜的L4-5DRG用Western blot检测DRG内TRPV1蛋白表达水平变化,其余6只于术后2 h灌流,取脊髓用于免疫组织化学检测脊髓背角Fos阳性神经元的数目。
1.2 试剂材料 IPTRK3由日本大阪肽研究所合成;七氟醚(江苏恒瑞医药有限公司);多克隆兔抗Fos抗体(Calbiochem,Darmstadt,德国);多克隆兔抗TRPV1(Neromics,Edina,MN,美国);羊抗兔 HRP IgG 二抗(Vector Laboratories,Burlingame,CA,美国);痛行为测定仪(Ugo Basile,Comerio,意大利)。
1.3 动物模型制作 参照Seltzer等[8]的方法:小鼠采用5%七氟醚诱导30 s,2%的七氟醚维持麻醉,手术过程约3~5 min。在无菌操作下,股段高位暴露左侧坐骨神经。在坐骨神经干向后二头肌和半腱肌分支处的远端小心地将神经背侧与周围组织分离,用小止血钳夹住神经背侧,将一条8-0号硅制丝线缝入神经干内,结扎神经背侧1/3~1/2。sham组只作暴露坐骨神经,不予结扎。依次缝合皮肤肌肉。
1.4 疼痛行为学测量 小鼠分别于给药前(pre)和给药后 2、8、24、48、72 h测定左后爪的热敏缩足反射阈值(paw withdrawal latency,PWL)和机械刺激缩足反射阈值(paw withdrawal threshold,PWT)。PWL:仪器发射红外光(落在足底的光圈直径为5 mm)照射小鼠左足底,安静小鼠逃避性抬腿时,记录开始照射至出现缩足逃避反射时间(s)。重复3次,间隔10 min,取平均值用于统计分析。为防止小鼠足底灼伤,红外光照射最长时间设为20 s。PWT:采用足底机械痛敏测定仪测定各组小鼠PWT值,于安静小鼠左后足底加压至逃避性抬腿,记录开始加压至出现缩足逃避反射压力数值(g),重复3次,间隔10 min,取平均值。
1.5 TRPV1蛋白印迹法 乙醚麻醉后,迅速打开椎管,取左侧L4~L5背根神经节,立即置入液氮中保存。向组织中加入蛋白裂解液(1 ml蛋白裂解液加10 μl蛋白酶抑制剂),超声裂解组织,低温离心机中15 000×g离心30 min取上清。BCA法测定样品的蛋白含量,用8%SDS-聚丙酰胺凝胶分离蛋白,30 μg/well样品蛋白100 V电泳。然后将蛋白转移到 NC膜,转膜电压为100 V,时间90 min。5%的脱脂奶粉溶液封闭1 h,多克隆兔抗TRPV1(1∶2 000)4℃孵育过夜,TBST缓冲液冲洗3次,HRP标记二抗室温孵育1 h,TBST缓冲液冲洗3次,ECL曝光,高敏感X线片显色。同样方法测定内参βactin蛋白表达。用program Image J(version 1.35)进行相对灰度值分析。
1.6 Fos蛋白免疫组织细胞化学染色法 采用乙醚麻醉,经左心室灌流固定。先用50 ml生理盐水快速灌流冲洗血液,继以4%多聚甲醛30 ml持续灌注。取出L4~L5段脊髓,4%多聚甲醛后固定4~8 h,然后20%蔗糖脱水,置4℃冰箱过夜。冰冻连续切片(片厚 40μm)隔5取1,收集在 0.01 mol·L-1PBS缓冲液中。1%H2O2处理30 min,漂洗后5%正常山羊血清封闭1 h,浸入Fos一抗(1∶20 000),室温过夜。漂洗后浸入HRP IgG二抗(1∶600),孵育1 h。漂洗后浸入 ABC复合物,孵育30 min。DAB显色,乙醇脱水,二甲苯透明,中性树胶封片。细胞中有棕褐色或棕黄色颗粒沉积,无论染色深浅,即为Fos阳性细胞。每只小鼠随机抽取4张切片计数,取其平均值用于统计分析。
1.7 统计学分析 采用SPSS16.0统计软件分析。服从正态分布的计量资料以±s表示,多组样本均数间的比较采用单因素方差分析,进一步两两比较用LSD法。不服从正态分布的计量资料采用多组样本的秩和检验。
2 结果
2.1 小鼠热敏、机械缩足反射阈值的变化 各组小鼠术前基础值及sham组各时间点的PWL和PWT之间无差异(P>0.05)。与sham组相比,PSNL组PWL和 PWT于术后2 h即出现明显降低(P<0.05)。IPTRK3组PWL和PWT比PSNL组明显增高,并持续至术后72 h,差异有统计学意义(P<0.05)。见 Fig 1。
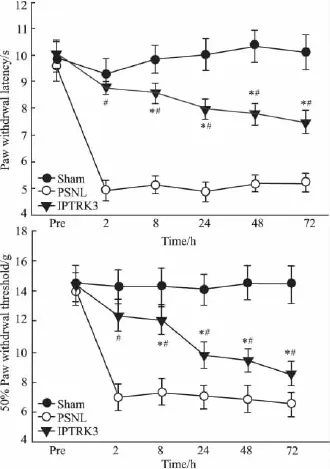
Fig 1 Effects of intraperitoneal(ip)injections of IPTRK3 on PSNL-induced thermal and mechanical hyperalgesia(±s,n=12)
2.2 DRG内TRPV1蛋白的表达变化 与sham组相比,PSNL组DRG中TRPV1蛋白表达水平明显增高。IPTRK3组 TRPV1蛋白含量比PSNL组明显降低(P<0.05),但仍明显高于 sham组(P<0.05)。见 Fig 2。

Fig 2 Effects of ip injections of IPTRK3 on the up-regulation expression of TRPV1 in DRG induced by PSNL(±s,n=6)
2.3 脊髓背角Fos蛋白的表达变化 与sham组相比,PSNL组脊髓背角浅层和深层Fos阳性神经元数目均明显增加(P<0.05)。与 PSNL组相比,IPTRK3组脊髓背角浅层和深层 Fos阳性神经元明显下降,差异有统计学意义(P<0.05)。见Fig 3,4。
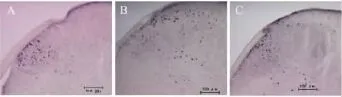
Fig 3 Effects of ip injections of IPTRK3 on increasing protein expression of Fos in the spinal dorsal horn induced by PSNL
3 讨论
因神经源性疼痛发生机制复杂,现有的药物尚不能明显缓解神经源性疼痛患者的疼痛症状,因此寻找新的药物作用靶点、探索新的镇痛药物对治疗神经病理性疼痛具有重要意义。在临床上,病人术后的慢性神经疼痛通常是由急性的手术疼痛和围术期神经损伤引起的。有研究表明在组织损伤之前给予镇痛药物对于术后疼痛是有效的,其主要通过减少有害刺激传入所导致的外周和中枢敏感化,以抑制神经可塑性变化,从而达到创伤后镇痛和减少镇痛药用量的目的[7]。我们的研究发现预先单次腹腔注射细胞穿透肽IPTRK3 10 mg·kg-1明显减轻PSNL引起的痛觉过敏,而且这种镇痛作用可持续至术后72 h,先前的研究在PSNL后7 d单次腹腔给予IPTRK3,镇痛作用仅可持续 24 h[5],这些结果提示神经损伤前预先给予IPTRK3镇痛效果较术后给药持久。
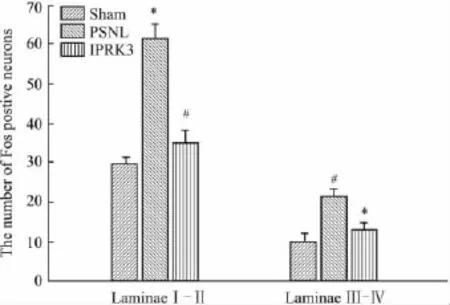
Fig 4 Effects of ip injections of IPTRK3 on the expression and distribution of Fos-positive neurons in the L4-L5segments of the laminaeⅠ-ⅡandⅢ-Ⅳ(±s,n=6)
既往研究发现对非甾体类或阿片类等传统镇痛药物治疗效果不佳的某些疼痛状态,NGF拮抗剂或TrkA抑制剂具有明显的治疗效果[2],但是这些药物往往作用时间较短,需要重复给药[9],或者对TrkA缺乏特异性,副作用较大[10]。因此,我们人工合成了IPTRK3,结构为 YGRKKRRQRRR-acp-SRDIYSTDYYR。其中47-YGRKKRRQRRR-57是建立在人类免疫缺陷病毒1型基础上,可以使IPTRK3穿透细胞膜,与作用靶点更好的结合;而666-SRDIYSTDYYR-676是可与 TrkA结合的氨基酸序列激活环,使IPTRK3可以特异性抑制TrkA的活性。细胞试验也已经证实IPTRK3可以特异性抑制 TrkA的活性,而且无明显细胞毒性[3]。NGF是一种亲神经性因子,在神经系统发育过程中参与中枢和周围神经的发育、存活和维持。但在成熟的机体NGF表达增加并激活其受体TrkA却是诱发痛觉过敏的重要原因之一。NGF结合细胞膜上的TrkA受体后,首先激活局部的TRPV1使神经元兴奋性增加,然后启动酪氨酸激酶信号传递系统,迅速使细胞内TRPV1、P物质、BDNF等蛋白表达增加,放大疼痛效应[2]。TRPV1主要分布于背根神经节和三叉神经节中的中、小直径神经元,是初级感觉神经元外周末端伤害性刺激的分子整合者。TRPV1可被伤害性热刺激(>42℃)、炎症介质(缓激肽、神经生长因子、组胺)、香草素类化合物(如辣椒碱、RTX)等激活[11]。激活的TRPV1可使钙离子内流,神经元去极化,产生动作电位,参与痛觉过敏的形成[12]。NGF作用于体外培养的DRG可明显增强辣椒素诱导的TRPV1活性[13]。本研究结果显示预先给予IPTRK3后DRG内TRPV1蛋白表达程度与单纯手术组相比明显降低,表明IPTRK3的使用可抑制神经损伤诱导的DRG内TRPV1的表达增加。上述结果提示IPTRK3可能通过抑制TrkA活性,减少TRPV1的表达和转运,降低神经元的兴奋性,从而达到抑制痛觉过敏的作用。
c-fos是一种即刻早期基因,外周伤害性刺激可迅速诱导脊髓内Fos表达增多,是检测镇痛药物镇痛效果的常用神经标志物。有研究证明坐骨神经部分损伤后1.5~2 h,Fos蛋白表达达到高峰,5 d恢复正常[14]。而使用TrkA抑制剂A77-1726可明显阻断IL-13介导c-fos表达[15]。本实验中腹腔预先给予TrkA抑制剂IPTRK3后2 h已有明显的镇痛效应,因此选择PSNL术后2 h的时间点检测Fos蛋白表达的改变。发现PSNL术后Fos蛋白表达明显增加,且主要分布于脊髓Ⅰ~Ⅱ,而给予 IPTRK3后,明显抑制PSNL诱导脊髓背角浅层Fos蛋白的表达增加。脊髓背角浅层多为伤害性刺激传入纤维终末,提示除了外周感觉神经系统,在脊髓水平IPTRK3也可以抑制疼痛信号的传递,从而产生迅速明显的抗伤害作用。
综上所述,本实验结果显示,预先给予IPTRK3减轻PSNL动物疼痛行为的表现,对神经病理性疼痛具有一定的治疗作用。其机制可能是通过抑制TrkA激活、减少DRG内TRPV1蛋白及脊髓背角Fos蛋白的表达,从外周和中枢同时抑制伤害性刺激信息传递从而发挥迅速的镇痛作用。
[1] O'Connor A B.Neuropathic pain:a review of the quality of life impact,costs,and cost-effectiveness of therapy[J].Pharmacoeconomics,2009,27(2):95 -112.
[2] Hefti F F,Rosenthal A,Walicke P A,et al.Novel class of pain drugs based on antagonism of NGF[J].Trends Pharmacol Sci,2006,27(2):85-91.
[3] Hirose M,Takatori M,Kuroda Y,et al.Effect of synthetic cellpenetrating peptide on TrkA activity in PC12 cells[J].J Pharmacol Sci,2008,106(1):107 -13.
[4] Ueda K,Hirose M,Murata E,et al.Local administration of a synthetic cell-penetrating peptide antagonizing TrkA function suppresses inflammatory pain in rats[J].J Pharmacol Sci,2010,112(4):438-43.
[5] Ma W Y,Murata E,Ueda K,et al.A synthetic cell-penetrating peptide antagonizing TrkA function suppresses neuropathic pain in mice[J].J Pharmacol Sci,2010,114(1):79 - 84.
[6] Harris J A.Using c-fos as a neural marker of pain[J].Brain Res Bull,1998,45:1 -8.
[7] Cheng K I,Lai C S,Wang F Y,et al.Intrathecal lidocaine pretreatment attenuates immediate neuropathic pain by modulating Nav1.3 expression and decreasing spinal microglial activation[J].BMC Neurol,2011,11(1):71.
[8] Seltzer Z,Dubner R,Shir Y.A novel behavioral model of neuropathic pain disorders produced in rats by partial sciatic nerve injury[J].Pain,1990,43(2):205-18.
[9] Watson J J,Fahey M S,van den Worm E,et al.TrkAd5:a novel therapeutic agent for treatment of inflammation pain and asthma[J].J Pharmacol Exp Ther,2006,316(3):1122 -9.
[10]Winston J H,Toma H,Shenoy M,et al.Acute pancreatitis results in referred mechanical hypersensitivity and neuropeptide up-regulation that can be suppressed by the protein kinase inhibitor K252a[J].J Pain,2003,4(6):329 -37.
[11]王 乐,王兰兰,曹 宇.TRPVl对LPS致热大鼠体温及下丘脑中Ca2+浓度和cAMP含量的影响[J].中国药理学通报,2009,25(1):51-5.
[11] Wang L,Wang L L,Cao Y.Effect of TRPV1 on LPS-induced fever and the content of Ca2+and camp in hypothalamus in rats[J].Chin Pharmacol Bull,2009,25(1):51 -5.
[12]王 乐,曹 宇.TRPV1阻断剂的研究进展[J].国际病理科学与临床杂志,2008,28(3):220-4.
[12] Wang L,Cao Y.Progress in vaniloid receptor1antagonist[J].Int J Pathol Clin Med,2008,28(3):220-4.
[13] Bonnington J K,McNaughton P A.Signalling pathways involved in the sensitisation of mouse nociceptive neurones by nerve growth factor[J].J Physiol,2003,551:433 -46.
[14] Li X,Clark J D.Heme oxygenase type 2 participates in the development of chronic inflammatory and neuropathic pain[J].J Pain,2003,4(2):101-7.
[15]石小玉,龚妍春,李文林,等.酪氨酸激酶抑制剂A77-1726阻断IL-13介导STAT6磷酸化和c-fos表达[J].中国药理学通报,2008,24(7):906-10.
[15] Shi X Y,Gong Y C,Li W L,et al.Tyrosine kinase inhibitor A77-1726 inhibiting STAT6 phosphorylation and c-fos expression induced by IL-13[J].Chin Pharmacol Bull,2008,24(7):906 -10.
