细胞因子信号传导抑制蛋白1对肿瘤坏死因子-α诱导的肾小管细胞凋亡的影响
2011-07-28杜春阳史永红崔立文任韫卓王月华段惠军
杜春阳,史永红,崔立文,任韫卓,王月华,赵 松,段惠军
(河北医科大学1.病理学教研室、2.第四医院,河北 石家庄 050017)
肿瘤坏死因子-α(TNF-α)是由157个氨基酸构成的生物学活性多样的多肽类物质,具有免疫及炎症双重功能,参与细胞的分化、增殖及凋亡[1]。以往研究表明,TNF-α能够通过激活JNK及NF-κB两条细胞信号传导通路参与了包括糖尿病肾病在内的多种肾脏疾病的发生发展过程[2]。TNF-α可以通过激活肿瘤坏死因子I型受体(TNFR1)诱导肾小管上皮细胞炎症反应及凋亡[3]。JAK/STAT信号通路是体内一条重要的信号转导通路,可以被包括TNF-α在内的多种细胞因子激活[4]。细胞因子信号传导抑制蛋白(suppressors of cytokine signaling,SOCS)家族是JAK/STAT信号通路重要的负调控因子[5]。我们最近的研究显示SOCS-1过表达能够抑制AGEs诱导的肾小管上皮细胞转分化[6]。目前,有关SOCS家族对TNF-α诱导肾小管上皮细胞 JAK/STAT信号通路活化及其细胞凋亡作用的研究还未见报道。本实验旨在观察SOCS-1基因转染对TNF-α诱导的肾小管上皮细胞凋亡和JAK/STAT信号通路活化的影响。
1 材料与方法
1.1 材料 pCR3.1/SOCS-1表达载体由德国慕尼黑大学Christoph J.Auernhammer教授惠赠。HKC细胞由解放军总医院肾内科陈香美教授惠赠。D-葡萄糖、AG490和rhTNF-α为Sigma公司产品。小鼠抗p-STAT1单克隆抗体(A-2),小鼠抗Bax单克隆抗体(P-19),兔抗 SOCS-1、p-JAK2、JAK2、STAT1、Bcl-2、Caspase-3多克隆抗体和ECL增强化学发光试剂盒为Santa Cruz公司产品。Cleaved caspase-3为美国Cell Signaling公司产品。脂质体2000和pCR3.1质粒载体购自Invitrogen公司。TUNEL试剂盒为美国Promega公司产品。辣根酶标记羊抗小鼠或兔IgG购自北京中杉金桥公司。聚偏二氟乙烯膜(PVDF)为美国Milipore公司产品。
1.2 方法
1.2.1 细胞培养和分组刺激实验 HKC细胞在低糖型DMEM完全培养基(含体积分数0.1胎牛血清,105U·L-1青霉素,100 mg·L-1链霉素)中常规培养。将HKC细胞分为5组:正常对照组(N)、TNF-α 组(T)、SOCS-1 转染 +TNF-α 组(pCR3.1/SOCS-1,S1+T)、空质粒载体对照组(pCR3.1,V+T)和 AG490干预组(AG490+T)。采用脂质体2000分别转染pCR3.1/SOCS-1和pCR3.1质粒载体。采用G418(0.5 g·L-1)筛选阳性克隆。将筛选出的阳性克隆细胞进行传代培养。待细胞达60% ~80%融合后用无血清培养基同步12 h。然后采用 TNF-α(20 μg·L-1)进行刺激。12 h收集细胞,进行以下观察。
1.2.2 流式细胞术(FCM)检测 收集上清中细胞及贴壁细胞,PBS洗两次,采用体积分数为0.70的冷乙醇4℃固定24 h,PBS洗两次,碘化丙啶4℃避光染色30 min,流式细胞仪分析。
1.2.3 末端脱氧核苷酸转移酶介导dUTP缺口标记法(TUNEL)检测 细胞接种于8孔Leb-Tak腔室玻片(美国Nalge Nunc公司)上,进行分组刺激。具体步骤严格按试剂盒使用说明书进行。细胞核呈棕黄色者为阳性细胞,每孔至少计数500个细胞,计算阳性细胞百分比。
1.2.4 Western blot检测 细胞用冰冷PBS洗2遍,加入细胞裂解液(25 mmol·L-1Tris-HCl,10 mmol·L-1EDTA,体积分数 0.01 NP-40,150 mmol·L-1氯化钠,质量浓度1 g·L-1苯甲基磺酰氟),冰浴1 h,4℃、14 000 r·min-1离心25 min,Lowry 法测定上清液蛋白浓度。取细胞裂解蛋白50 μg,经十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳后电转移至PVDF膜;质量分数为0.05脱脂奶粉封闭 PVDF 膜 2 h,分别加入 p-JAK2、p-STAT1、Bax、Bcl-2、SOCS-1、JAK2、STAT1、Caspase-3 及 Cleaved caspase-3抗体,4℃过夜,洗膜后加辣根过氧化物酶标记的羊抗小鼠或兔抗体(1∶5 000稀释),37℃孵育1.5 h;洗膜后加ECL试剂,然后将PVDF膜放入X线片暗盒,压片,显影,定影。用美国UVP公司LabWorks 4.5分析系统软件对Western blot条带进行定量分析。
2 结果
2.1 SOCS-1对TNF-α诱导HKC细胞凋亡的影响 Western blot结果显示,与其他3组相比,SOCS-1蛋白在pCR3.1/SOCS-1质粒转染组肾小管细胞表达明显升高(P<0.01,Fig 1),表明 SOCS-1基因成功导入了细胞,并在蛋白水平获得高效表达。流式细胞术(FCM)结果显示,与正常对照组相比,在刺激的12 h TNF-α组和空载体对照组凋亡细胞明显增多。与TNF-α和空载体对照组相比,SOCS-1转染组与AG490干预组肾小管上皮细胞凋亡均明显降低(P<0.01,Fig 2);TUNEL结果同流式细胞术结果一致(P <0.01,Fig 3)。
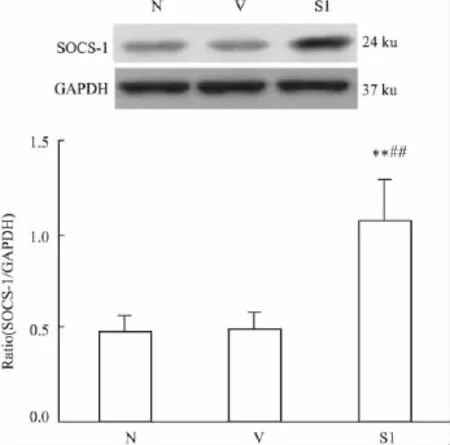
Fig 1 Expression of SOCS-1 in HKC cells(n=6)
2.2 SOCS-1对细胞凋亡相关蛋白表达的影响与正常对照组相比,在刺激的12 h TNF-α组和空载体对照组Caspase-3活性明显增高,Bax/Bcl-2蛋白比率明显升高(P均<0.01)。SOCS-1转染组肾小管上皮细胞Caspase-3活性及Bax/Bcl-2蛋白比率明显低于TNF-α组和空载体对照组;AG490干预组肾小管上皮细胞Caspase-3活性及Bax/Bcl-2蛋白比率也明显低于TNF-α组和空载体对照组;AG490干预组和SOCS-1转染组之间表达差异无显著性(Fig 4)。
2.3 SOCS-1对JAK2和STAT1激活的影响 与正常对照组相比,在刺激的12 h TNF-α组和空载体对照组p-JAK2和p-STAT1表达均明显升高,TNF-α组和空载体对照组之间表达差异无显著性。与TNF-α组和空载体对照组相比,SOCS-1转染组与AG490干预组p-JAK2和p-STAT1表达明显降低(Fig 5)。
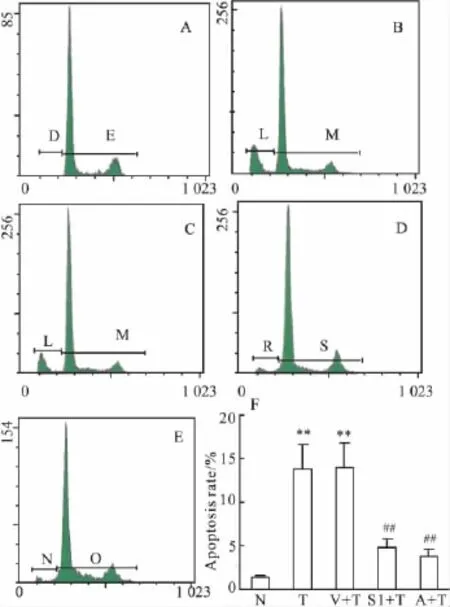
Fig 2 Effect of SOCS-1 on TNF-α-induced apoptosis rate of HKC is analyzed by FCM(n=6)
3 讨论
细胞凋亡是一个主动的由基因决定的自动结束生命的过程,也常常被称为细胞程序性死亡(programmed cell death,PCD)。细胞凋亡是肾功能损伤的重要环节,近年来的研究表明,细胞凋亡在细胞生存控制中起重要作用,与多种肾脏疾病的发生及修复有关[7]。以往对肾脏疾病的研究大多集中在肾小球病变,对肾小管间质病变的发生发展及其机制研究较少。然而,近来越来越多的关于肾脏疾病长期预后的研究证据表明,肾小管间质的病变程度与肾脏疾病较肾小球病变有更为密切的相关性。有研究提示[8],肾脏疾病晚期凋亡细胞数与肾功能恶化程度成正比,成为肾功能进一步恶化的重要因素之一。因此,寻求肾脏疾病中抑制肾小管上皮细胞的凋亡的方法将在一定程度上延缓肾脏疾病的发展。

Fig 3 Effect of SOCS-1 on TNF-α-induced apoptosis rate of HKC is analyzed by TUNEL(n=6)
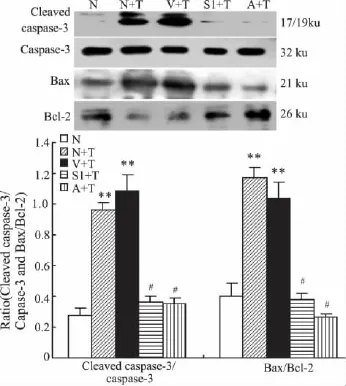
Fig 4 Effect of SOCS-1 on activation of Caspase-3,Bax and Bcl-2 in HKC cells(n=6)
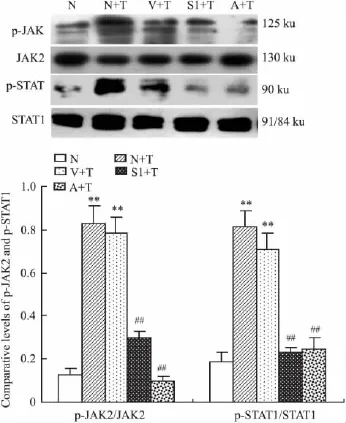
Fig 5 Effect of SOCS-1 on TNF-α-induced activation of JAK2 and STAT1 in HKC cells(n=6)
TNF-α是由单核巨噬细胞等分泌产生的细胞因子,在血管内皮细胞表面广泛分布,肾小球系膜细胞、肾小管上皮细胞也可合成和分泌。TNF-α能够通过第二信使系统激活转录因子、刺激细胞因子和生长因子及其他炎症介质的合成对肾脏细胞发挥作用。TNF-α对肾脏细胞具有明显的毒性,能够导致肾脏细胞的凋亡和坏死[9]。研究发现[10],TNF-α 对HKC的毒性作用呈剂量和时间依赖性;TNF-α(10 mg·L-1),作用时间8 h,可明显诱导 HKC凋亡。AL-Rasheed 等[11]在研究中也证实,TNF-α 对负鼠肾脏近端肾小管上皮细胞的活性有明显抑制作用并呈剂量依赖性,并可诱导其凋亡。我们的实验结果也显示TNF-α能够诱导人肾小管上皮细胞凋亡,上调肾小管上皮细胞Bax和Cleaved caspase-3蛋白的表达,同时下调Bcl-2蛋白的表达,Bax/Bcl-2蛋白比率增高。
JAK/STAT通路是细胞因子信号传导的重要途径,STATs是潜在的转录因子,静息状态下存在于细胞质内,可被 IL-2、IL-6、IL-10、TNF-α、干扰素(IFNs)等多种细胞因子激活。本课题组多年研究发现,JAK/STAT信号通路激活参与了糖尿病肾病的发病过程,在糖尿病大鼠肾小球及高糖培养的系膜细胞中,JAK/STAT信号通路活性明显增强[12]。对于JAK/STAT通路与肾小管损伤的关系却知之甚少。最近研究发现白蛋白能够激活体外培养的肾小管细胞的JAK/STAT信号通路[13]。在梗阻性肾病模型,STAT6能够抑制肾脏细胞凋亡,同时激活胶原合成促进肾小管间质纤维化[14]。AGEs能够通过JAK/STAT信号通路诱导肾小管上皮细胞的转分化[6]。我们的实验结果亦显示,伴随 TNF-α诱导HKC凋亡的同时;肾小管上皮细胞JAK2和STAT1的磷酸化水平明显增高,初步提示JAK/STAT信号通路可能在肾小管损伤导致慢性肾脏疾病过程中发挥一定作用,但具体的激活机制还有待进一步研究。
细胞因子信号传导抑制蛋白-1(SOCS-1)是SOCS家族重要成员之一,其发挥作用主要通过抑制JAK/STAT信号传导通路的激活[5]。本课题组最近的研究表明[6],SOCS-1基因转染能够抑制AGEs诱导的肾小管上皮细胞转分化,减少细胞外基质的合成。我们的实验结果显示,SOCS-1转染组 TNF-α诱导的HKC凋亡细胞明显减少;SOCS-1过表达能够抑制TNF-α诱导的肾小管细胞JAK2和STAT1的磷酸化,同时降低凋亡相关蛋白质Cleaved caspase-3和促凋亡基因Bax的表达、逆转抑凋亡基因Bcl-2的低表达;Bax/Bcl-2蛋白比率亦明显下降;提示SOCS-1在一定程度上抑制JAK2、STAT1的磷酸化及TNF-α诱导的肾小管上皮细胞的凋亡。本实验中,我们同时采用了JAK激酶抑制剂AG490进行干预,结果显示,AG490干预组肾小管细胞凋亡相关蛋白质Cleaved caspase-3表达水平及 Bax/Bcl-2蛋白比率明显下调,和SOCS-1过表达的结果相一致。
综上所述,SOCS-1基因转染能够抑制TNF-α诱导的肾小管上皮细胞凋亡,这种作用可能部分是通过抑制JAK/STAT信号通路的活化实现的。
[1] Tansey M G,Szymkowski D E.The TNF super family in 2009:new pathways,new indications,and new drugs[J].Drug Discovery Today,2009,14(23-24):1082-8.
[2] Sanchez-Niño M D,Benito-Martin A,Gonçalves S.TNF super family:A growing saga of kidney injury modulators[J].Mediators Inflamm,2010,2010.pii:182958.
[3] Ernandez T,Mayadas T N.Immunoregulatory role of TNFalpha in inflammatory kidney diseases[J].Kidney International,2009,76(3):262-76.
[4] Schindler C,Levy D E,Decker T.JAK-STAT signaling:From interferons to cytokines[J].J Biol Chem,2007,282(28):20059-63.
[5] Kubo M,Hasana T,Yoshimura A.Suppressors of cytokine signa-ling and immunity[J].Nat Immunol,2003,4(12):1169-76.
[6] 史永红,王 晨,赵 松,等.氟伐他汀对糖基化终末产物诱导的肾小管细胞转分化及ERK1/2信号通路的影响[J].中国药理学通报,2008,24(10):1356-60.
[6] Shi Y H,Wang C,Zhao S,et al.Effects of fluvastatin on epithelial-myofibroblast transdifferentiation and activation of ERK1/2 in HKC cells stimulated by AGEs[J].Chin Pharmacol Bull,2008,24(10):1356-60.
[7] Martinez-Salgado C,Eleno N,Morales A I.Gentamicin treatment induces simultaneous mesangial proliferation and apoptosis in rats[J].Kidney Int,2004,65(6):2161-71.
[8] Hauser P,Oberbauer R.Tubuler apoptosis in the pathophysiology of renal disease[J].Wien Klin Wochenschr,2002,114(15-16):671-7.
[9] Navarro-González J F,Mora-Fernández C.The role of inflammatory cytokines in dibetic nephropathy[J].J Am Soc Nephrol,2008,19(3):433-42.
[10]王 琳,徐西振,凃 玲,等.银杏叶提取物抗肿瘤坏死因子-α诱导的人肾小管上皮细胞凋亡及机制[J].华中科技大学学报(医学版),2008,37(2):181-4.
[10] Wang L,Xu X Z,Tu L,et al.Protective effect of extract of Ginkgo biloba against human renal tubular epithelial cell apoptosis induced by Tumor necrosis factor alpha[J].Acta Med Univ Sci Technol Huazhong,2008,37(2):181-4.
[11] Al-Rasheed N M,Willars G B,Brunskill N J.C-peptide signals via galphai to protect against TNF-α-mediated apoptosis of opossum kidney proximal tubular cells[J].J Am Soc Nephrol,2006,17(4):986-95.
[12]史永红,段惠军,王丽晖,等.缬沙坦对高糖培养系膜细胞信号转导和转录活化因子1、3表达的影响[J].中国药理学通报,2006,22(2):203-6.
[12] Shi Y H,Duan H J,Wang L H,et al.Effects of valsartan on the expression of STAT1 and STAT3 in glomerular mesangial cells under high concentration of glucose[J].Chin Pharmacol Bull,2006,22(2):203-6.
[13] Erkan E,Devaraian P,Schwartz G J.Mitochondria are the major targets in albumin-induced apoptosis in proximal tubular cells[J].J Am Soc Nephrol,2007,18(4):1199-208.
[14] Yukawa K,Kishino M,Goda M.STAT6 deficiency inhibits tubulointerstitial fibrosis in obstructive nephropathy[J].Int J Mol Med,2005,15(2):225-30.
