大肠杆菌莽草酸生产菌株培养条件的优化
2011-07-26张惠展
钱 晋,杨 捷,叶 江,张惠展
(华东理工大学 生物反应器工程国家重点实验室,上海 200237)
传统中药八角的重要提取物莽草酸,具有镇定、消炎、抗血栓形成[1]的作用,同时是多种抗癌、抗病毒药物的合成中间体[2]。莽草酸的分子结构中含有1个六碳环、3个羟基、1个羧基、1个双键,这样的结构可以成盐,也可以成酯。此外还具有3个不对称中心,如此优良的手性结构可以作为一个应用面很广的生物合成重要化合物的光学纯骨架[3]。近年来,专家发现莽草酸在超临界水中可以反应生成苯酚,提供了一条从可更新原料生产苯酚的新路线[4]。另外,莽草酸还可以用作食品添加剂[5]。而莽草酸最受关注的是其作为关键起始材料合成神经氨酸酶抑制剂GS4104,进而合成得到防治禽流感的特效药达菲[6]。
为了研究莽草酸代谢途径中各个基因对于莽草酸积累的作用,本实验室在前期构建了含有不同单基因或多基因串联表达盒的大肠杆菌莽草酸生产菌株,并尝试通过测量培养基中莽草酸的积累量来对各基因的作用进行考量。然而菌体培养过程和测量过程均会引入不同程度的误差,为了降低这些过程所引入的误差从而提高实验结果的准确性,在此对各个莽草酸生产菌株的培养条件进行优化,并对培养过程和测量方法进行考察,为后续深入研究奠定基础。
1 实验
1.1 菌株、重组质粒与培养基
菌株JM83[F-araΔ(lac-proAB)rpsL(Strr)φ80ΔlacZΔM15],自行保藏;JDL02(The same as JM83,but ΔaroL),杨捷硕士构建。
重组质粒pTrc-aroG、pTrc-ppsA、pTrc-aroG-tktA、pTrc-ppsA-aroG、pTrc-ppsA-aroG-tktA均由杨捷硕士构建,其载体均为pTrc99a,重组基因分别为aroG、ppsA、aroG-tktA、ppsA-aroG、ppsA-aroG-tktA。
LB培养基:氯化钠1.0%、酵母提取物 0.5%、胰蛋白胨1.0%、琼脂 1.8%(配制固体培养基时添加)。
M9培养基:5×M9盐溶液(64 g·L-1Na2HPO4·7H2O、15 g·L-1KH2PO4、2.5 g·L-1NaCl、5.0 g·L-1NH4Cl)20%,1 mol·L-1CaCl20.01%,25%葡萄糖 4%,1 mol·L-1MgSO40.002%(在培养前加入已消毒的葡萄糖和1 mol·L-1MgSO4)。
1.2 试剂与仪器
氨苄西林钠(Ampicillin,Ap),上海新先锋药业有限公司;异丙基硫代-β-D-半乳糖苷(IPTG),Promega;莽草酸标准品,上海自杰生化科技有限公司;琼脂糖(Agarose),上海赛百盛基因技术有限公司;其余试剂均为国产分析纯。
Gilson型精细移液器,法国;SORVALL SUPER T21型高速冷冻离心机,美国;TL-18M型台式高速冷冻离心机、SCS-24型摇床,上海离心机械研究所;CA-1390-1型循环气流垂直洁净工作台,上海上净净化设备有限公司;YXQ-LS-SⅡ型全自动立式电热压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;UV-7504型单光束紫外可见分光光度计,上海欣茂仪器有限公司。
1.3 方法
1.3.1 细菌培养条件
将大肠杆菌接种于LB液体培养基中,置于37 ℃摇床培养12~16 h,或者划线扩增在LB固体培养基平板上,倒置于37 ℃培养箱培养12~16 h。对于胞内含有表达氨苄青霉素抗性基因(Apr)的质粒(如pTrc-99a)的大肠杆菌,需要在培养环境中额外加入氨苄西林钠(终浓度100 μg·mL-1)。对于要用Trc启动子诱导表达蛋白产物的情况,则向培养环境中添加异丙基硫代-β-D-半乳糖苷(终浓度50 μg·mL-1)作为诱导剂。
1.3.2 菌株的保藏
LB-甘油保藏法:将1.5 mL培养液于常温8000 r·min-1离心2 min,弃上清,打散菌体。之后各取无菌LB液体培养基和甘油300 μL加至含有打散菌体的Eppendorf管中,用漩涡振荡器振匀,置于-20 ℃或-80 ℃冰箱;或者先取600 μL无菌LB液体培养基—甘油(1∶1)混合液于Eppendorf管中,再用无菌牙签从固体培养物上挑取目的菌落于管中,然后旋转牙签使其均匀悬浮于保藏液中,置于-20 ℃或-80 ℃冰箱。此法保藏的菌株活性可维持数年,但需要每隔一段时间取出振荡一下,防止由于甘油沉入管底而导致菌株失活。
1.3.3 莽草酸的检测[7]
用牙签从甘油保藏管中蘸取少量大肠杆菌接种于5 mL LB液体培养基中,置于37 ℃摇床培养12~16 h。次日取适量菌液用最小培养基M9培养基洗涤,接种于25 mL M9液体培养基中并添加相应的抗生素,于37 ℃摇床培养48 h,之后吸取适量菌液至Eppendorf管中,于室温15 000 r·min-1离心15 min,取上清。吸取适量上清加入250 μL高碘酸盐试剂,用M9培养基补足反应体系至500 μL,置于37 ℃培养箱保温0.5 h后加入NaOH-Na2SO3混合溶液终止反应。于382 nm处测吸光度OD382。
2 结果与讨论
2.1 高碘酸显色法的误差分析
用莽草酸标准品配制0.04 mg·mL-1莽草酸标准溶液,取250 μL标准溶液(相当于10 μg莽草酸),加入250 μL高碘酸盐溶液,置于37 ℃培养箱保温0.5 h后加入500 μL NaOH-Na2SO3混合溶液,测OD382值,做5管(A~E)平行管。结果十分接近,依次为2.624、2.623、2.624、2.624、2.624,由此可以确定显色实验本身是非常稳定的。
2.2 不同批次操作之间的误差分析
取250 μL 0.04 mg·mL-1莽草酸标准溶液,用高碘酸显色法测OD382值,每隔2 d重复1次,共做5次,结果依次为2.630、2.625、2.633、2.623、2.624,极差相对值为0.04。表明不同批次的实验操作所引入的误差是在允许范围内的。
2.3 莽草酸标准曲线的绘制
配制0.1 mg·mL-1莽草酸标准溶液,分别取0 μL、 20 μL、40 μL、80 μL、100 μL、150 μL的莽草酸标准溶液,用ddH2O补足到250 μL,随后加入250 μL高碘酸盐溶液,置于37 ℃培养箱保温0.5 h后加入500 μL NaOH-Na2SO3混合溶液,测OD382值。绘制标准曲线,见图1。
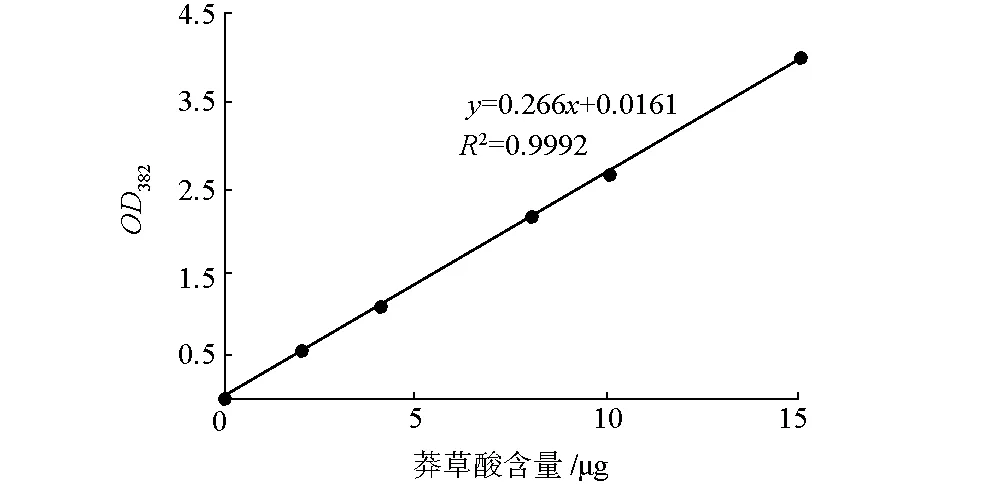
图1 莽草酸标准曲线
2.4 培养环境的检验
实验所用SCS-24型摇床的平面示意图,见图2。

图2 摇床平面示意图
在摇床上挑选16个位置(编号1~16)进行培养环境的实验。从大肠杆菌JM83的单克隆板上挑取单克隆接种于5 mL LB液体培养基中,置于37 ℃摇床培养过夜,次日分别取相同菌体量接种于16份添加了脯氨酸和酪蛋白水解物的25 mL M9培养基中,置于培养箱的相应位置,于37 ℃培养48 h。最后测菌密度OD600。此实验每隔一周重复一次,共重复3次,结果见表1。
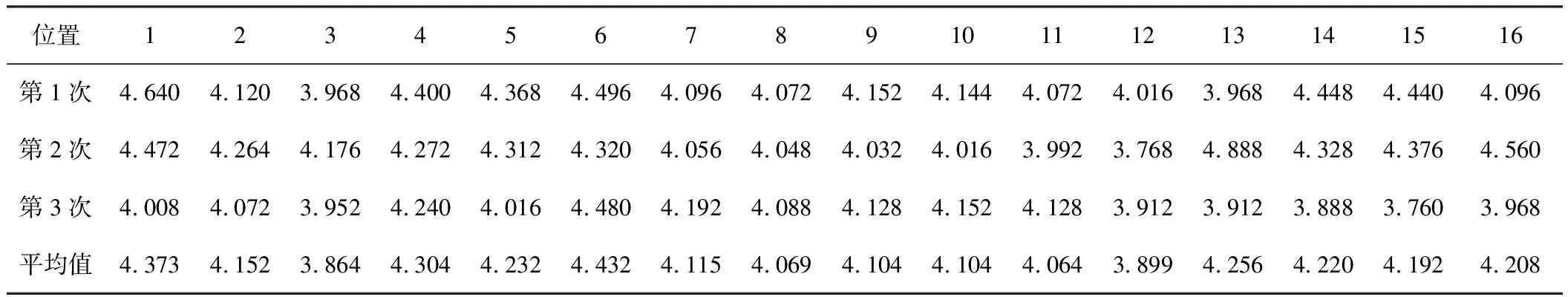
表1 不同培养位置的菌密度OD600
从表1可以看出,在培养箱中不同位置培养的菌体的生长状况存在较大的差异。这可能是由于不同的培养位置距离出风口的距离不同,因此各个位置的局部环境温度有所差异,从而导致不同位置菌体的生长产生了差别。而3次实验之间数值也有差异,这可能是由于翻瓶时的菌液加入量有少许差异以及不同培养周期环境温度差异的共同影响。根据位置1和2的数值,可知风口右端位置的菌体生长状况较差;根据位置2与3的数值,可以推断摇床最上面一排位置培养的菌体生长状况较差;比较位置10、15、16的数值,可知斜面方向上离风口越远菌体生长状况越好。为了提高实验的准确性,尽量选取培养条件差不多的位置进行后续实验。
2.5 诱导时间的优化
由于培养工程菌使用的是最小培养基M9培养基,因此菌体生长速度较之用LB培养基培养时要慢许多。在这种情况下就不能按照原来的诱导时间进行诱导,这是因为,如果添加IPTG过早就会影响到菌体的生长状况;而添加过晚就会影响产量,因此,需要重新确定合适的IPTG诱导时间。
选择pTrc-aroG-tktA/JDL02作为测试菌株,从甘油保藏管中蘸取少许菌体接种于5 mL LB液体培养基中,置于37 ℃摇床培养过夜,次日按照1%接种量吸取培养菌液接种于添加了脯氨酸和酪蛋白水解物的300 mL M9培养基中,置于37 ℃摇床培养。分别于3.0 h、3.5 h、4.5 h、5.5 h、6.5 h、7.5 h、8.5 h、9.5 h、10.5 h、11.5 h、12.5 h取出部分菌液测菌密度OD600,同时从母瓶中取出25 mL培养液加入到已消毒的250 mL摇瓶中并加入终浓度为0.167 mg·mL-1的IPTG进行诱导,随后继续培养;培养48 h后取出部分菌液测菌密度OD600,剩余菌液继续培养;诱导48 h后取出部分菌液测菌密度OD600,并将剩余菌液15 000 r·min-1离心15 min,取适量上清,测莽草酸含量。不同诱导时间下诱导时、培养48 h、诱导48 h的菌密度OD600见图3,不同诱导时间的莽草酸产量见图4。
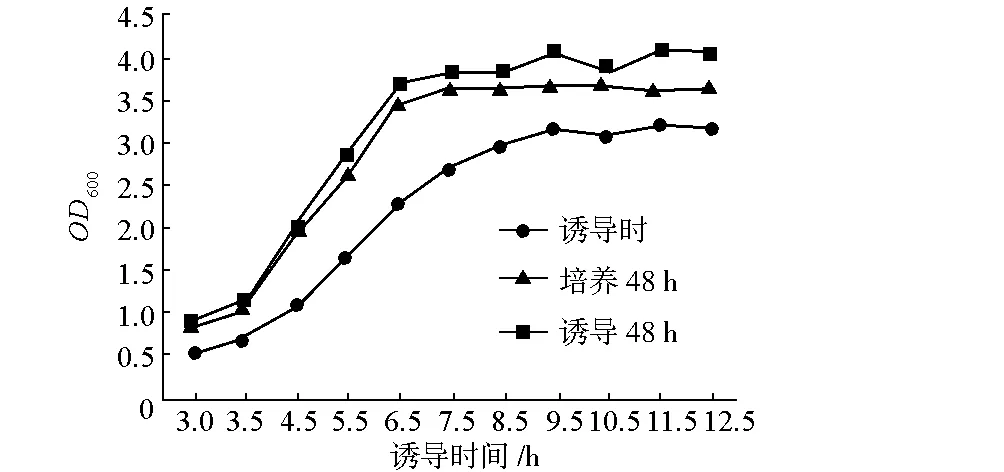
图3 不同诱导时间的菌密度
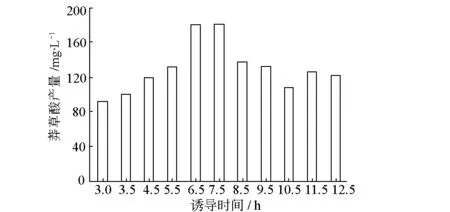
图4 不同诱导时间的莽草酸产量
从图3可以看出,如果按照实验室LB培养时常用的当菌体生长到OD600为0.6时进行诱导,将会影响到菌体的正常生长,导致菌体在培养48 h后菌密度OD600只有1.0左右,远远低于正常的3.5;在6.5 h之前进行诱导都会对菌体的生长产生一定的影响;而在6.5~12.5 h进行诱导都不会对菌体生长产生影响。
从图4可以看出,虽然6.5 h之后诱导对于菌体生长不会有影响,但是过晚诱导还是会对莽草酸的产量产生影响,莽草酸产量的最高值出现在7.5 h时诱导的样品。综合菌体生长情况和莽草酸产量,确定合适的诱导时间是在培养7.5 h左右。
2.6 莽草酸生产菌株的产量测定
在确定了高碘酸显色法的稳定性和准确性并优化了摇瓶培养条件之后,对实验室现有的一系列莽草酸生产菌株进行摇瓶培养并测定其莽草酸的产量。分别在5 mL LB液体培养基中接种JM83、JDL02、pTrc-aroG/JDL02(A/02)、pTrc-ppsA/JDL02(P/02)、pTrc-aroG-tktA/JDL02(AT/02)、pTrc-ppsA-aroG/JDL02(PA/02)、pTrc-ppsA-aroG-tktA/JDL02(PAT/02)菌株,置于37 ℃摇床培养过夜。次日吸取相同菌体量的菌液分别接种于25 mL添加了脯氨酸和酪蛋白水解物的液体M9培养基中,置于37 ℃摇床培养。培养7.5 h时分别添加终浓度为0.167 mg·mL-1的IPTG进行诱导,继续培养48 h,将菌液15 000 r·min-1离心15 min,取适量上清测莽草酸产量,结果见表2。

表2 各工程菌莽草酸产量/mg·L-1
从表2可以看出,pTrc-ppsA-aroG-tktA/JDL(PAT/02)的莽草酸产量比其它单基因表达菌株的产量要低,与杨捷等[8]实验结论相同。在优化了包括培养位置、诱导时间在内的摇瓶培养条件之后,摇瓶培养pTrc-aroG-tktA/JDL02(AT/02)的莽草酸产量提高到了224.324 mg·L-1,比原来摇瓶发酵的94.33 mg·L-1提高了2.38倍。
3 结论
为了降低实验培养环节所引入的误差,对前期构建的一系列莽草酸生产菌株进行培养条件的优化。研究表明,高碘酸显色法本身以及不同批次操作所引入的误差是可以忽略的,然而菌体生长环境的不同将会导致菌株的生长状况不同。优化了莽草酸工程菌摇瓶培养的位置以及诱导时间(7.5 h)后,pTrc-aroG-tktA/JDL02的莽草酸摇瓶产量由原来的94.33 mg·L-1提高到224.324 mg·L-1。
[1] 刘永友,廖晓峰.莽草酸的研究进展[J].化工时刊,2007,21(3):54-57.
[2] 马怡,孙建宁,徐秋萍,等.莽草酸对血小板聚集和凝血的抑制作用[J].药学学报,2000,30(1):1-3.
[3] Kramer M,Bongaerts J,Bovenberg R,et al.Metabolic engineering for microbial production of shikimic acid[J].Metabolic Engineering,2003,5(4):277-283.
[4] Gibson J M,Thomas P S,Thomas J D,et al.Benzene-free synthesis of phenol[J].Angew Chem Int Ed,2001,40(10):1945-1948.
[5] Tan D S,Foley M A,Shair M D,et al.Stereoselective synthesis of over two million compounds having structural features both reminiscent of natural products and compatible with miniaturized cell-based assays[J].Am Chem Soc,1998,120(33):8565-8566.
[6] Kim C U,Lew W,Williams M A,et al.Influenza neuraminidase inhibitors possessing a novel hydrophobic interaction in the enzyme active site:Design,synthesis,and structural analysis of carbocyclic sialic acid analogues with potent anti-influenza activity[J].Am Chem Soc,1997,119(4):681-690.
[7] Cromartie Thomas H,Polge Nicholas D.Method of detecting shik-imic acid[P].USP 6 482 654,2002-11-19.
[8] 杨捷,钱晋,叶江,等.大肠杆菌莽草酸生物合成途径的基因操作[J].华东理工大学学报(自然科学版),2008,35(2):207-212.
