家蚕抗菌肽Cecropin D基因的原核表达、纯化及抑菌活性测定
2011-07-25章玉萍牛晓利曹玉桥代君君王储言吴传华
章玉萍 牛晓利 曹玉桥 范 涛 代君君 王储言 吴传华 刘 健
(1安徽省农业科学院蚕桑研究所,安徽合肥 230061; 2石药集团河北中润制药有限公司,河北石家庄 050000)
家蚕病毒病、细菌病和真菌病等主要的传染性蚕病遍及世界各蚕区。有些家蚕品种对某一种或几种家蚕病毒具有抗性或不感受性。如菁松对家蚕浓核病病毒(BmDNV)敏感,菁松近等基因系表现为不感受性。通过利用抑制性消减杂交研究家蚕品系菁松和菁松近等基因系在添食家蚕浓核病病毒前后基因表达的变化,检测到家蚕抗菌肽在添毒后表达水平增高[1]。抗菌肽是一类具有光谱抗细菌、病毒和真菌的较为保守的小分子蛋白[2-3],多带有正电荷,同时具有亲水和疏水性2种特性。抗菌肽作为家蚕先天性免疫的效应分子,具有很好的抗菌活性,并对抑制BmNPV在家蚕体内增殖有一定作用[4]。我们通过构建抗菌肽Cecropin D重组表达载体,表达载体导入E.coli BL21宿主菌中,经异丙基β-D硫代半乳糖苷(IPTG)诱导表达,再通过谷胱甘肽硫转移酶(glutathione s2transferase,GST)亲和层析纯化出GST-Cecropin D融合蛋白,最后检测其抑菌活性。
1 材料与方法
1.1 试验材料
供试家蚕品种:黄血蚕7019(Nistari),由中国农业科学院蚕业研究所提供;菌株DH5α、TOP10和BL21,表达载体pET-41b,由中国科学院上海植物生理生态研究所昆虫中心实验室提供;T4DNA连接酶、限制性内切酶EcoRⅠ、XhoⅠ,购自NEB公司;异丙基 β-D硫代半乳糖苷(IPTG)、X-gal、Ex Taq DNA聚合酶,购自TaKaRa公司;蛋白质分子量标准、GST抗体,均购自上海生工生物公司;RNA提取试剂盒,购自上海英骏公司,其它常规试剂均为国产。
1.2 方法
1.2.1 引物设计 CecF:5'-GGAATTCTGACG ACGACGACAAGGCTCCCGGCAACTTCTTC-3',其 中GAATTC为EcoRⅠ酶切位点,GACGACGACGACAAG为肠激酶酶切位点(为了后期去除 GST标签)。CecR:5'-GGCCTCGAGCTAGTTTTGTCCGAGAGCTT TTG-3',CTCGAG为XhoⅠ酶切位点。
1.2.2 总RNA提取和RT-PCR 参照RNA提取试剂盒说明提取5龄第3天家蚕幼虫的总RNA,然后用家蚕总RNA为模板,按反转录酶的使用说明进行cDNA第1链的合成。以家蚕cDNA为模板,用引物对CecF/CecR进行PCR扩增,反应条件:94℃预变性3 min;94℃ 30 s,57℃ 30 s,72℃30 s,共30个循环;最后72℃延伸10 min,4℃保存。
1.2.3 载体构建 PCR胶回收后,EcoRⅠ、XhoⅠ双酶切,回收酶切产物并连接到经同样双酶切的pET-41b载体上,转化感受态DH5α,阳性克隆通过鉴定后送桑尼生物公司测序。
1.2.4 重组蛋白的诱导表达及表达条件优化 将测序正确的载体pET-41b-CecD转化到感受态大肠杆菌BL21中,挑单克隆接种于含卡那霉素的LB液体培养基中,37℃、250 r/min振荡培养12 h,按1∶100的体积比,将培养的菌液接到新的含卡那霉素的LB培养基中,37℃培养至OD600为0.6~0.8,加入1 mmol/L异丙基β-D硫代半乳糖苷 (IPTG)于37℃诱导4 h,离心收集菌体,PBS重悬,冰浴下超声波破碎菌体,离心收集上清和沉淀,10%SDSPAGE电泳分析。表达条件优化分2组进行,1组分别诱导1、3、4、6 h,取样;另1 组分别以 IPTG 终浓度0.01、0.02、0.05、0.10、0.50 mmol/L 进行诱导,取样。
1.2.5 蛋白质印迹(Western blot)鉴定融合蛋白IPTG诱导前后的菌液样品经SDS-PAGE电泳,将凝胶上的蛋白转印至硝酸纤维素膜上,利用融合蛋白上的GST标签,以抗GST抗体为一抗,辣根过氧化物酶标记山羊抗小鼠IgG为二抗,进行Western blot分析。
1.2.6 重组蛋白的纯化 大量诱导的细菌经超声破碎后,离心,上清液用0.4 μm微孔滤膜过滤,利用GST亲和层析法进行重组蛋白的纯化[5]。
1.2.7 抗菌肽抑菌效果的测定 分别采用抑菌圈法[6]和测定细菌生长曲线的方法来检测抗菌肽的抑菌效果。
2 结果与分析
2.1 抗菌肽Cecropin D基因克隆及pET-41b-CecD载体构建
从NCBI上下载家蚕抗菌肽Cecropin D基因的氨基酸序列,利用在线软件(http:www.cbs.dtu.dk/services/SignalP/)进行信号肽预测。前22氨基酸应该为信号肽。根据预测结果,在载体构建时去除信号肽。以家蚕5龄幼虫 cDNA为模板,扩增Cecropin D基因,连接到pET-41b载体上,构建成重组载体pET-41b-CecD(图1)。
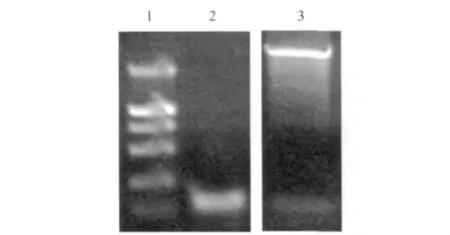
图1 Cecropin D PCR扩增及pET-41b-CecD载体双酶切验证
2.2 重组蛋白GST-Cecropin D的原核表达结果
SDS-PAGE电泳结果显示,重组载体pET-41b-CecD导入E.coli BL21宿主菌中经IPTG诱导表达后,过表达的重组蛋白 GST-Cecropin D约为36.7 kDa(图2)。IPTG诱导3 h重组蛋白表达量最大(图2-A,泳道4),诱导剂IPTG的浓度变化对蛋白表达量没有显著影响(图2-B)。经超声波破碎细菌并离心后,分别收集沉淀和裂解上清进行SDSPAGE电泳分析,结果在沉淀和上清中都检测到了目的蛋白条带(图2-B,第9、11泳道),说明该融合蛋白具有可溶性表达和形成包涵体2种形式(图2-B,第8、10泳道分别是未诱导对照的沉淀和上清)。
2.3 Western blot分析
结果如图3所示,重组质粒pET-41b-CecD转化的BL21菌经IPTG诱导后,在36.7 kDa处出现与GST特异结合的条带。IPTG诱导后过表达的产物为GST融合蛋白。
2.4 重组蛋白GST-Cecropin D纯化及SDS-PAGE分析
大量培养菌液经超声破碎细菌并离心后,收集上清用GST柱进行亲和纯化。SDS-PAGE电泳分析显示,过GST柱后的滤出液中只含有少量的目的蛋白(图4,泳道1),而在洗脱液中分子量约为36.7 kDa位置处出现了一条清晰的蛋白带(图4,泳道2),即为纯化的目的蛋白。

图2 重组蛋白GST-Cecropin D的SDS-PAGE分析
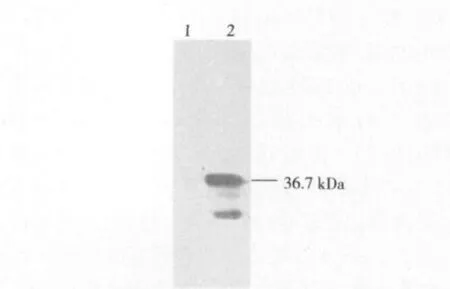
图3 重组蛋白的Western blot分析
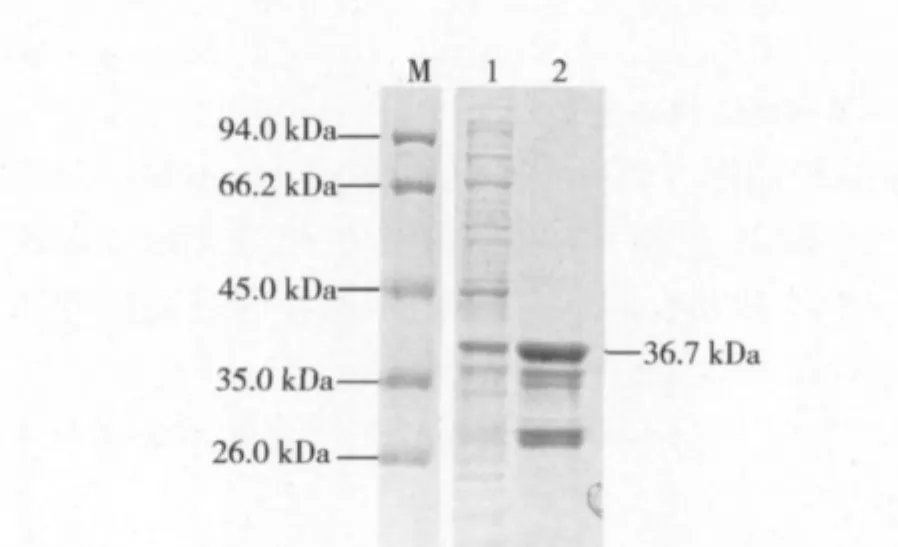
图4 重组蛋白纯化后SDS-PAGE分析
2.5 重组蛋白GST-Cecropin D抑菌活性测定
以大肠杆菌TOP10为指示菌株,采用平板抑菌圈法初步检测重组蛋白GST-Cecropin D的抑菌活性。结果表明:重组蛋白GST-Cecropin D有明显的抑菌活性(图5)。GST亲和纯化的滤出液也有一定的抑菌活性,说明在滤出液中存在未被完全吸附的抗菌肽。
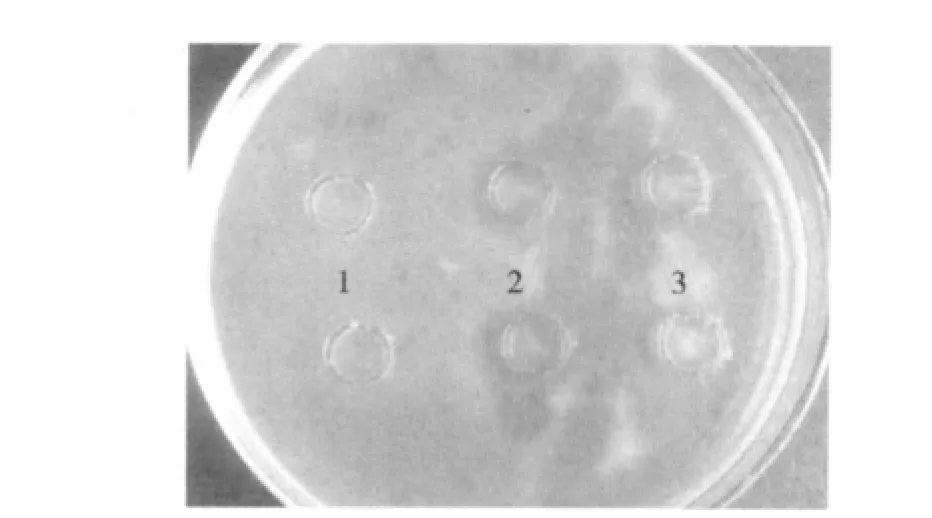
图5 抑菌圈实验
分别在1 mL LB培养基中加入10 μL滤出液(约0.1 mg/mL)、磷酸盐缓冲液(0.01M)和重组抗菌肽(2.5 mg/mL),卡那霉素(50 μg/mL)作为阳性对照,然后接菌1 μL(培养的TOP10菌株),37℃,250 r/min摇培,间隔2 h取样测OD600,检测不同处理下细菌生长情况并绘制生长曲线。发现重组抗菌肽和卡那霉素一样具有很好的抑菌效果,摇菌14 h,OD600仍然为0(图6)。
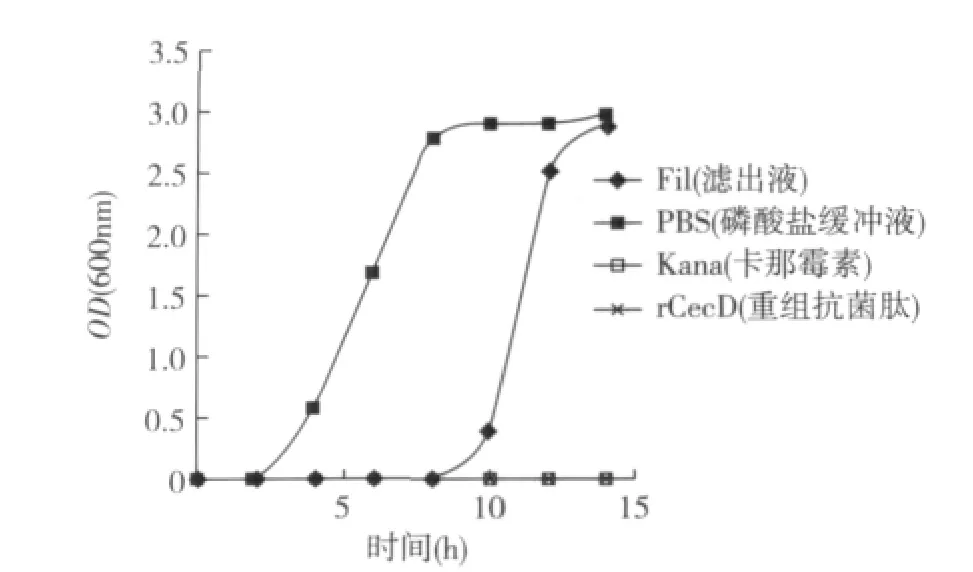
图6 不同处理条件下细菌生长曲线
3 讨论
抗菌肽Cecropin D是一种阳离子小蛋白,作用机制是通过其两亲性α-螺旋上正电荷与细胞质膜磷脂分子上负电荷之间的静电吸引而结合聚集在质膜上[7],随后疏水段C端α-螺旋插入到疏水的胞膜中央,打乱了质膜上蛋白质和脂质原有的排列秩序,导致膜去极化从而破坏质膜结构,并导致细菌和病毒死亡。由于家蚕Cecropin D是小分子多肽,对宿主有毒性,直接在E.coli中表达抗菌肽产量低,因此本研究以融合表达的方式,利用载体自带的谷胱甘肽硫转移酶蛋白实现了在E.coli中的高效可溶性表达,纯化后的重组抗菌肽可以很好地抑制并杀灭细菌,其效果与抗生素卡那霉素相似。
BmDNV为裸露的小病毒,病毒核酸为单链脱氧核糖核酸,其寄生部位高度特异,只寄生家蚕中肠前部和后部的圆筒形细胞的细胞核[8]。家蚕感染BmDNV后中肠及围食膜结构遭到破坏,消化管内的细菌可以透过围食膜感染中肠,细菌细胞壁上的肽聚糖、脂多糖通过Toll pathway的信号识别蛋白引起抗菌肽高效表达[9-10]。
[1]Bao Y Y,Li M W,Zhao Y P,et al.Differentially expressed genes in resistant and susceptible Bombyx mori strains infected with a densonucleosis virus[J].Insect Biochem Mol Biol,2008,9:853-861.
[2]Izadpanah A,Gallo R L.Antimicrobial peptides[J].J Am Acad Dermatol,2005,3:381 -391.
[3]Chernysh S,Kim S I,Bekker G,et al.Antiviral and antitumor peptides from insects[J].Proc Natl Acad Sci USA,2002,20:12628-12632.
[4]李伟灿,孟小林,徐进平,等.家蚕抗菌肽CD高效表达及其抗BmNPV感染作用[J].中国病毒学,2006,(6):589-593.
[5]章玉萍,蒋剑豪,赵云坡,等.家蚕G蛋白γ1亚基(BmGγ1)的克隆及其谷胱甘肽硫转移酶融合蛋白的表达与纯化[J].蚕业科学,2008,34(4):627-633.
[6]Li B C,Zhang S Q,Dan W B,et al.Expression in Escherichia coli and purification of bioactive antibacterial peptide ABP-CM4 from the Chinese silk worm,Bombyx mori[J].Biotechnol Lett,2007,7:1031-1036.
[7]Zhang L,Rozek A,Hancock R E.Interaction of cationic antimicrobial peptides with model membranes[J].J Biol Chem,2001,38:35714-35722.
[8]郭锡杰,钱元骏,胡雪芳,等.我国家蚕浓核病病毒(DNV)寄生组织部位研究[J].蚕业科学,1985,11(2):93-98.
[9]Lemaitre B,Hoffmann J.The host defense of Drosophila melanogaster[J].Annu Rev Immunol,2007,25:697 - 743.
[10]Kappler C,Meister M,Lagueux M,et al.Insect immunity.Two 17 bp repeats nesting a kappa B-related sequence confer inducibility to the diptericin gene and bind a polypeptide in bacteriachallenged Drosophila[J].EMBO J,1993,4:1561-1568.
