Mito-KATP在七氟醚延迟预处理减轻大鼠心肌缺血再灌注氧化损伤中的作用*
2011-07-16肖艳英常业恬李双凤
肖艳英 常业恬 冉 珂 李双凤
研究认为,过多氧自由基生成和氧化还原系统平衡被破坏是心肌缺血再灌注损伤的重要机制,吸入麻醉药预处理的早期心肌保护作用与其增加抗氧化酶的活性有关[1]。谷胱甘肽硫转移酶Mu(gluta⁃thione S-Transferase Mu,GSTM)是抗氧化系统的重要成员。近年来的研究证实GSTM能够抑制心肌兰尼碱受体钙离子释放通道(ryanodine receptor Ca2+release channel,RyR),减少钙离子释放,可能是减少心肌缺血再灌注后钙超载的因素[2-3]。线粒体三磷酸腺苷敏感性钾通道(mito-KATP)在吸入麻醉药预处理产生的心肌保护中发挥重要作用[4]。本研究旨在观察七氟醚延迟预处理对大鼠心肌缺血再灌注的抗氧化作用以及抗氧化酶GSTM的变化。
1 材料与方法
1.1 实验动物 清洁级成年雄性SD大鼠60只,9~10周龄,体质量250~300 g,购于湖南斯莱克景达实验动物有限公司,饲养于我院实验动物中心。按照随机数字法分为5组,每组12只:假手术组(Sham组)开胸但不结扎左冠状动脉;缺血再灌注组(IR组)阻断左冠状动脉前降支30 min,再灌注120 min;七氟醚预处理组(SPC组)心肌缺血前24 h吸入2.5%七氟醚1 h;七氟醚预处理+mito-KATP特异性阻断剂5-羟基癸酸(5-HD)组(SPC+5-HD组),七氟醚预处理前10 min经尾静脉给予mito-KATP特异性阻断剂5-HD(5 mg/kg);5-HD组,心肌缺血前24 h给予5-HD。
1.2 主要试剂与仪器 大鼠心肌肌钙蛋白I(cTnI)检测试剂盒(上海西唐生物科技有限公司),GSTM多克隆抗体(美国Santa Cruz公司),5-羟基癸酸(美国Sigma 公司),七氟醚(美国Abbott公司),超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽硫转移酶(GST)检测试剂盒(南京建成生物医学工程研究所),七氟醚挥发罐和气体监测仪(美国Datex-Ohmeda公司),Western blot电泳和电转仪设备(美国Bio Rad公司)。
1.3 造模 操作参照参考文献[1],SPC组和SPC+5-HD组大鼠放置于有机玻璃箱中保留自主呼吸,吸入2.5%七氟醚1 h,出气口连接麻醉气体监测仪监测出口气体七氟醚、O2及CO2的浓度。Sham组,IR组和5-HD组给予纯氧吸入。采用参考文献[5]的方法,结扎左冠状动脉前降支30 min后,再灌注120 min建立大鼠在体心肌缺血再灌注模型。于胸骨左缘3~4肋间开胸,结扎左冠状动脉前降支,Ⅱ导联心电图出现ST段抬高或者心尖发绀被认为结扎成功。30 min后松开结扎线再灌注120 min,以出现ST段回落1/2以上或者左室反应性充血为再灌注成功标志。MD3000型生物信号采集系统连续监测心率(HR)、平均动脉压(MAP)和Ⅱ导联心电图。
1.4 心肌梗死面积测定 每组6只大鼠用于确定梗死面积,灌注末再次结扎左冠状动脉,经尾静脉给予1%伊文思蓝2 mL确定心肌缺血危险区域。修剪留取左室沿心脏横轴切成1.5 mm厚左右切片,氯化三苯四氮唑(TTC)染色后拍照,采用Image pro plus 6.0专业分析软件分析测量左室面积(LV),危险区域面积(AAR)和梗死面积(IS),计算危险区域(AAR/LV)和梗死区域百分比(IS/AAR)。
1.5 血清cTnI检测 再灌注结束后留取颈动脉血1 mL,4℃相对离心力(RCF)1 800×g(3 000 r/min)离心15 min后取上清液,采用酶联免疫吸附测定(ELISA)试剂盒检测血清cTnI水平。
1.6 心肌MDA、Ca2+含量和SOD、GST活性检测 硫代巴比妥酸法测定MDA,甲基麝香草酚蓝比色法测定心肌内钙离子含量,黄嘌呤氧化酶法测定SOD活性。按照文献[6]的方法,根据GST对经典底物1-氯-2,4-二硝基苯(CDNB)的结合活性,以每分钟每毫克心肌消耗CDNB的摩尔数来表示心肌中GST的活性(nmolCDNB·mg-·1min-1)。按照MDA、SOD、GST试剂盒说明书配制试剂,测定各管光密度,Bio-Rad法检测蛋白含量。根据公式计算心肌组织中MDA、SOD、GST含量。
1.7 Western blot检测心肌GSTM表达 再灌注结束剪取左室提取心肌蛋白,于12%SDS-PAGE凝胶上电泳,电转印至PVDF膜,封闭2 h后,按照1∶500稀释比例加入一抗GSTM抗体,放置过夜,按照1∶1 000稀释比例加入辣根过氧化物酶标记的二抗IgG,进行化学发光反应,扫描后应用Gel pro4.0凝胶光密度分析软件进行分析。以Sham组为参照(100%),各组心肌GSTM含量以与Sham组比较相对表达量表示。
1.8 统计学处理 采用SPSS 13.0统计学软件进行分析。计量资料以均数±标准差±s)表示,多组间比较采用单因素方差分析,组间比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组AAR/LV、IS/AAR及cTnI比较 IR组IS/AAR和血清cTnI水平较Sham组明显增加;SPC组IS/AAR和血清cTnI水平较IR组减少;SPC+5-HD组IS/AAR和血清cTnI水平较SPC组增加,差异均有统计学意义(P<0.01),5-HD组各项指标与IR组及SPC+5-HD组差异无统计学意义(P>0.05),见表1。
2.2 各组大鼠心肌MDA、Ca2+含量、SOD、GST活性及心肌GSTM表达比较 IR组心肌MDA含量和Ca2+浓度较Sham组增加,而SOD和GST活性降低(P<0.01);SPC组较IR组减少了心肌MDA含量和Ca2+聚集,增加了SOD和GST活性(P<0.01);SPC+5-HD组较SPC组心肌MDA含量和Ca2+浓度增加,而SOD和GST活性降低(P<0.01)。SPC组较IR组心肌GSTM表达增加,而SPC+5-HD组较SPC组心肌GSTM降低(P<0.01),5-HD组各项指标与IR组及SPC+5-HD组比较差异无统计学意义(P>0.05),见表2。
3 讨论
心肌IR临床常见,氧化应激和钙超载被认为是其重要机制。再灌注后氧自由基大量生成,与细胞膜的不饱和脂肪酸结合生成脂质过氧化物,引起膜通透性改变和膜蛋白的脂质微环境改变,加重细胞内钙超载[1]。机体内有SOD和谷胱甘肽代谢酶系统2个重要的抗氧化系统,SOD能够清除多余的超氧阴离子,而后者是一系列氧自由基生成的启动环节;GST是谷胱甘肽代谢酶系统的重要成员,能催化脂质过氧化物与谷胱甘肽结合而消除脂质过氧化物[6]。MDA是脂质过氧化的代谢产物,可作为判断细胞氧化应激损伤程度的指标之一[6]。因此,本研究中选择Ca2和MDA作为判断氧化损伤指标,SOD和GST活性作为抗氧化能力指标。有研究显示七氟醚早期相预处理能够增加SOD活性,减少MDA产生,减少心肌梗死面积和改善心功能[1]。本研究中各缺血组心肌缺血危险区域(AAR/LV)在一个相似的范围,表明模型建立成功。七氟醚延迟预处理也能减少缺血再灌注后梗死面积、血清cTnI释放,增加了SOD和GST的活性,表明七氟醚延迟预处理也能够减轻氧化损伤。
表1 各组AAR/LV、IS/AAR及血清cTnI比较(n=6±s)
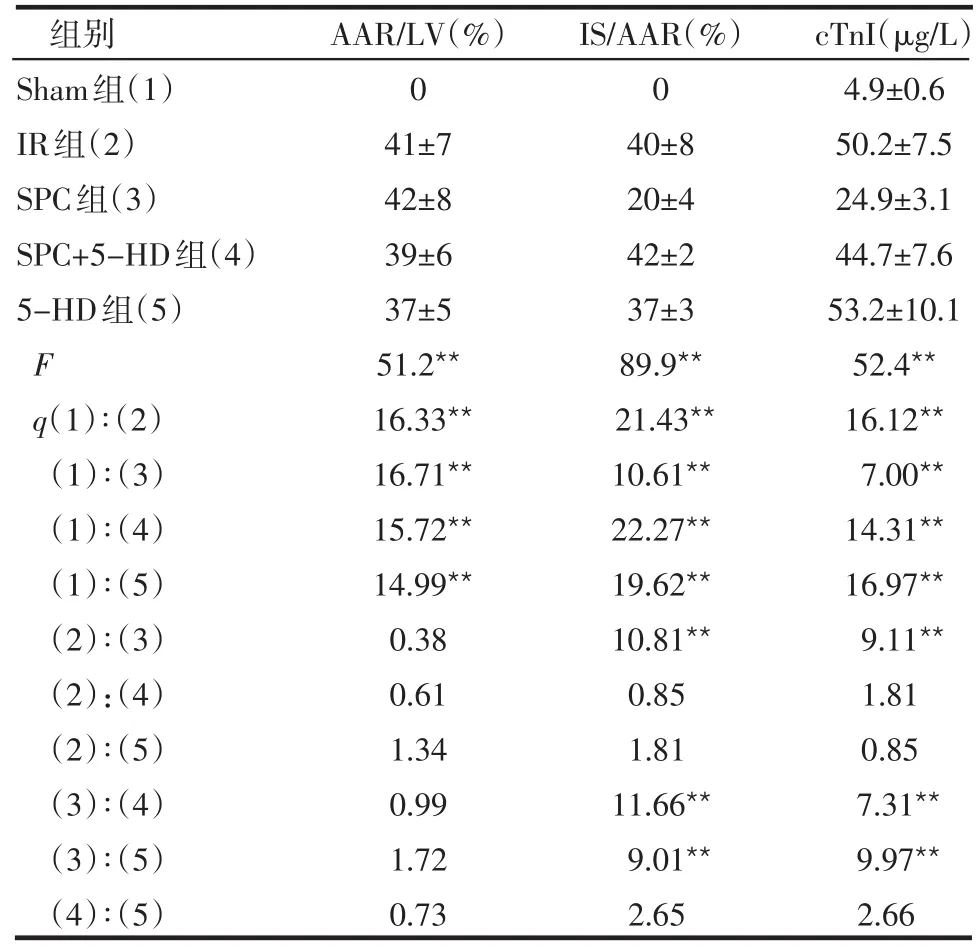
表1 各组AAR/LV、IS/AAR及血清cTnI比较(n=6±s)
*P<0.05,**P<0.01
组别Sham组(1)IR组(2)SPC组(3)SPC+5-HD组(4)5-HD组(5)F q(1)∶(2)(1)∶(3)(1)∶(4)(1)∶(5)(2)∶(3)(2):(4)(2)∶(5)(3)∶(4)(3)∶(5)(4)∶(5)AAR/LV(%)0 41±7 42±8 39±6 37±5 51.2**16.33**16.71**15.72**14.99**0.38 0.61 1.34 0.99 1.72 0.73 IS/AAR(%)0 40±8 20±4 42±2 37±3 89.9**21.43**10.61**22.27**19.62**10.81**0.85 1.81 11.66**9.01**2.65 cTnI(μg/L)4.9±0.6 50.2±7.5 24.9±3.1 44.7±7.6 53.2±10.1 52.4**16.12**7.00**14.31**16.97**9.11**1.81 0.85 7.31**9.97**2.66
表2 各组大鼠心肌MDA、Ca2+含量、SOD、GST活性和GSTM表达比较 (n=6±s)
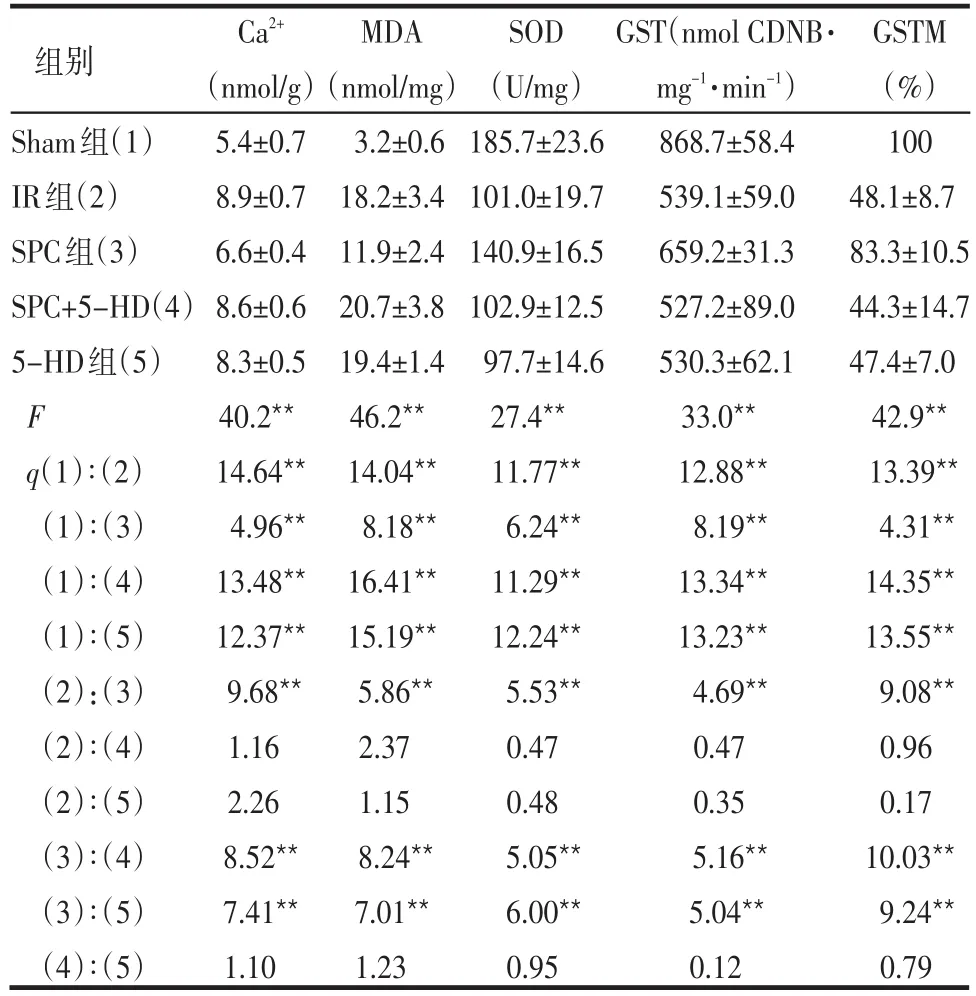
表2 各组大鼠心肌MDA、Ca2+含量、SOD、GST活性和GSTM表达比较 (n=6±s)
*P<0.05,**P<0.01
Sham组(1)IR组(2)SPC组(3)SPC+5-HD(4)5-HD组(5)F q(1)∶(2)(1)∶(3)(1)∶(4)(1)∶(5)(2):(3)(2)∶(4)(2)∶(5)(3)∶(4)(3)∶(5)(4)∶(5)Ca2+(nmol/g)5.4±0.7 8.9±0.7 6.6±0.4 8.6±0.6 8.3±0.5 40.2**14.64**4.96**13.48**12.37**9.68**1.16 2.26 8.52**7.41**1.10 MDA(nmol/mg)3.2±0.6 18.2±3.4 11.9±2.4 20.7±3.8 19.4±1.4 46.2**14.04**8.18**16.41**15.19**5.86**2.37 1.15 8.24**7.01**1.23 SOD(U/mg)185.7±23.6 101.0±19.7 140.9±16.5 102.9±12.5 97.7±14.6 27.4**11.77**6.24**11.29**12.24**5.53**0.47 0.48 5.05**6.00**0.95 GST(nmol CDNB·mg-1·min-1)868.7±58.4 539.1±59.0 659.2±31.3 527.2±89.0 530.3±62.1 33.0**12.88**8.19**13.34**13.23**4.69**0.47 0.35 5.16**5.04**0.12 GSTM(%)100 48.1±8.7 83.3±10.5 44.3±14.7 47.4±7.0 42.9**13.39**4.31**14.35**13.55**9.08**0.96 0.17 10.03**9.24**0.79组别
研究显示延迟预处理的心肌保护作用与基因激活和保护性蛋白质合成有关,抗氧化酶被认为是潜在的心肌保护性蛋白[4,6]。有研究认为SOD在多种形式延迟相预处理(包括热适应,低温,缺血预适应等)后表达增加[4]。Dikmen等[6]发现在七氟醚预处理后3 d不仅能增加SOD表达,也能增加GST表达,认为GST可能也是一种保护蛋白。GST具有多种同工酶,不同的同工酶在组织内表达有差异,其中Mu类GST(GSTM)在心肌大量表达[2]。本研究结果表明七氟醚延迟预处理能增加GSTM表达,考虑可能七氟醚心肌保护作用与GSTM表达增加有关。近年来研究认为GSTM不仅仅是谷胱甘肽代谢酶系统重要成分,而且可以与兰尼碱受体钙离子释放通道(RyR)结合,其中亚型GSTM2-2能特异性抑制心脏的RyR2的活性,抑制心肌肌浆网的钙离子释放[3]。缺血再灌注中钙超载和过量的氧自由基互相影响和促进,氧自由基使细胞膜结构破坏,对Ca2+通透性增加,加重细胞内钙超载;细胞内钙超载激活钙敏感蛋白水解酶以及钙依赖性磷脂酶,是形成大量活性氧的来源[5]。GSTM的作用可能与其抗氧化作用以及抑制钙离子释放有关。
mito-KATP是线粒体上一类特殊的内向整流钾离子通道。大量的研究认为mito-KATP在吸入麻醉药预处理的心肌保护机制中起重要作用[4]。有学者认为吸入麻醉药预处理引起mito-KATP开放的机制是患者吸入麻醉药后,激活细胞内复杂的蛋白激酶信号通路,通过PKC-ε转位于线粒体内膜而使mi⁃to-KATP开放[4]。但是也有学者认为吸入麻醉药可以自由通过细胞膜和线粒体膜,直接作用于线粒体膜上的mito-KATP,促使其开放[7]。Mito-KATP开放后引起线粒体膜电位短暂的去极化和线粒体呼吸脱偶联,产生少量的活性氧(ROS);而ROS的产生也可以促使mito-KATP开放,形成正反馈,促使预处理信号的不断传递和放大[7]。ROS的产生亦可以作为细胞内信号分子,激活细胞内信号转导途径以及心肌保护相关基因转录。本研究中在七氟醚预处理前给予5-HD取消七氟醚心肌保护作用,可能是5-HD阻断了预处理信号通过mito-KATP向下游传递,提示mito-KATP在吸入麻醉药延迟预处理心肌保护作用通路中重要作用。
[1]Chen CH,Liu K,Chan JY.Anesthetic preconditioning confers acute cardioprotection via up-regulation of manganese superoxide dis⁃mutase and preservation of mitochondrial respiratory enzyme activi⁃ty[J].Shock,2008,29(2):300-308.
[2]Abdellatif Y,Liu D,Gallant EM,et al.The Mu class glutathione transferase is abundant in striated muscle and is an isoform-specif⁃ic regulator of ryanodine receptor calcium channels[J].Cell Calci⁃um,2007,41(5):429-440.
[3]Liu D,Hewawasam R,Pace SM,et al.Dissection of the inhibition of cardiac ryanodine receptors by human glutathione transferase GSTM2-2[J].Biochem Pharmacol,2009,77(7):1181-1193.
[4]Landoni G,Fochi O,Torri G.Cardiac protection by volatile anaes⁃thetics:a review[J].Curr Vasc Pharmacol,2008,6(2):108-111.
[5]Konia MR,Schaefer S,Liu H.Nuclear factor-[kappa]B inhibition provides additional protection against ischaemia/reperfusion injury in delayed sevoflurane preconditioning[J].Eur J Anaesthesiol,2009,26(6):496-503.
[6]Dikmen B,Unal Y,Pampal HK,et al.Effects of repeated desflurane and sevoflurane anesthesia on enzymatic free radical scavanger sys⁃tem[J].Mol Cell Biochem,2007,294(1-2):31-36.
[7]Jiang MT,Nakae Y,Ljubkovic M,et al.Isof l urane activates human cardiac mitochondrialadenosine triphosphate-sensitive KATP channels reconstituted in lipid bilayers[J].Anesth Analg,2007,105(4):926-932.
