葛根素联合牛磺酸对2型糖尿病大鼠胰腺的保护作用*
2011-07-16门秀丽赵利军孔小燕李克宁张连元
门秀丽 赵利军 孔小燕 赵 霞 李克宁 张连元
胰岛β细胞功能紊乱是糖尿病的主要发生机制之一[1]。β细胞的抗氧化酶水平较机体其他组织细胞低,极易受到氧化因子的攻击[2]。线粒体是细胞活性氧(ROS)的主要来源,同时也是ROS损伤作用的主要靶点[3]。ROS可引起胰岛β细胞胰岛素启动因子胰十二指肠同源盒基因1(pancreatic duodenal homeobox-1,PDX-1)表达下调。研究表明,高血糖所致氧化应激可导致胰腺组织PDX-1表达下调[3]。葛根素和牛磺酸均具有一定的降血糖、抗自由基作用[4]。本研究旨在探讨葛根素联合牛磺酸对2型糖尿病大鼠胰腺的保护作用。
1 材料与方法
1.1 材料 (1)动物:健康雄性Wistar大鼠(SPF级)50只,2个月龄,体质量180~240 g,购自北京医科大学实验动物中心。实验期间动物自由饮水,摄食饲料为华北煤炭医学院实验动物中心提供的混合饲料(碳水化合物占总热量的66.5%、脂肪占10.2%、蛋白占23.3%),适应性喂养1周后进行实验。室温18℃~28℃,相对湿度62%~80%。(2)主要仪器与试剂:链脲佐菌素(streptozotocin,STZ)购自Sigma公司;胰岛素酶联免疫试剂盒购自美国Linco公司;糖化血红蛋白(HbA1c)检测采用挪威Axis-Shield(NycoCard ReaderⅡ)检测仪,葡萄糖(Glucose)、丙二醛(MDA)、超氧化物歧化酶(SOD)、ROS及总蛋白定量试剂盒购自南京建成生物工程研究所,牛磺酸粉剂购自中国湖州生物化学有限公司(批号:980018),葛根素注射液购自海南斯达制药有限公司(批号:H20023176)。PDX-1羊抗大鼠抗体购自Santa Cruz公司,抗羊二抗购自唐山灏洋生物制品公司。SIGMA-2M/ETM低温高速离心机购自美国Sigma公司;FSH-Ⅱ高速电动匀浆器购自江苏金坛国胜实验仪器厂;Salzburg酶标仪,721分光光度计购自上海第三分析仪器厂。
1.2 模型制备与分组 50只大鼠给以高糖高脂饲料,持续喂养4周后,尾静脉一次性注射STZ溶液25 mg/kg,72 h后测空腹血糖,以血糖值11.1~33.3 mmol/L为造模成功,共40只,按随机数字表随机分为糖尿病(DM)组、牛磺酸治疗(Tau)组、葛根素治疗(Pue)组和葛根素联合牛磺酸治疗(Pue+Tau)组,每组10只。Tau组大鼠腹腔注射质量浓度为20 g/L牛磺酸生理盐水溶液,200 mg(/kg·d),Pue组大鼠腹腔注射葛根素注射液160 mg(/kg·d),Tau+Pue组大鼠腹腔先后注射等量的葛根素和牛磺酸,DM组大鼠腹腔注射等体积生理盐水溶液,持续8周。
1.3 观察指标 末次给药后,4组大鼠均禁食12 h尾静脉取血测定HbA1c,从腹主动脉取血5 mL,2 000 r/min离心15 min 取血浆,按试剂盒说明书测Glucose、SOD、MDA、ROS和胰岛素(Insulin)水平。
1.4 胰腺组织处理及指标测定 取血后,每组取6只大鼠剖腹分离出胰腺,冲洗,拭干,分离去脂肪,称质量。用冷生理盐水溶液制成100 g/L的组织匀浆,2 000 r/min离心10 min取上清液,再以11 000 r/min低温高速离心20 min,沉淀,用冰冷生理盐水溶液制成线粒体混悬液,线粒体在光学显微镜下观察呈细沙样,用超声细胞粉碎仪将线粒体破碎,按试剂盒说明进行MDA、SOD及ROS测定。蛋白定量采用考马斯亮蓝法。
1.5 胰腺组织的免疫组织化学染色 处死大鼠即刻取胰尾部分进行PDX-1的免疫组织化学染色,光学显微镜下观察并照相。
1.6 统计学方法 采用SPSS 10.0软件进行分析,符合正态分布的计量数据均以±s表示,多组间比较用单因素方差分析,组间比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 各组血浆Glucose、Insulin及SOD等比较 Tau组、Pue组及Pue+Tau组较DM组大鼠血浆SOD活性和血浆胰岛素水平均有显著升高,而Glucose、MDA、ROS及HbA1c呈不同程度的降低,差异均有统计学意义(P<0.05),见表1。
表1 各组血浆葡萄糖、胰岛素及SOD等指标比较±s)
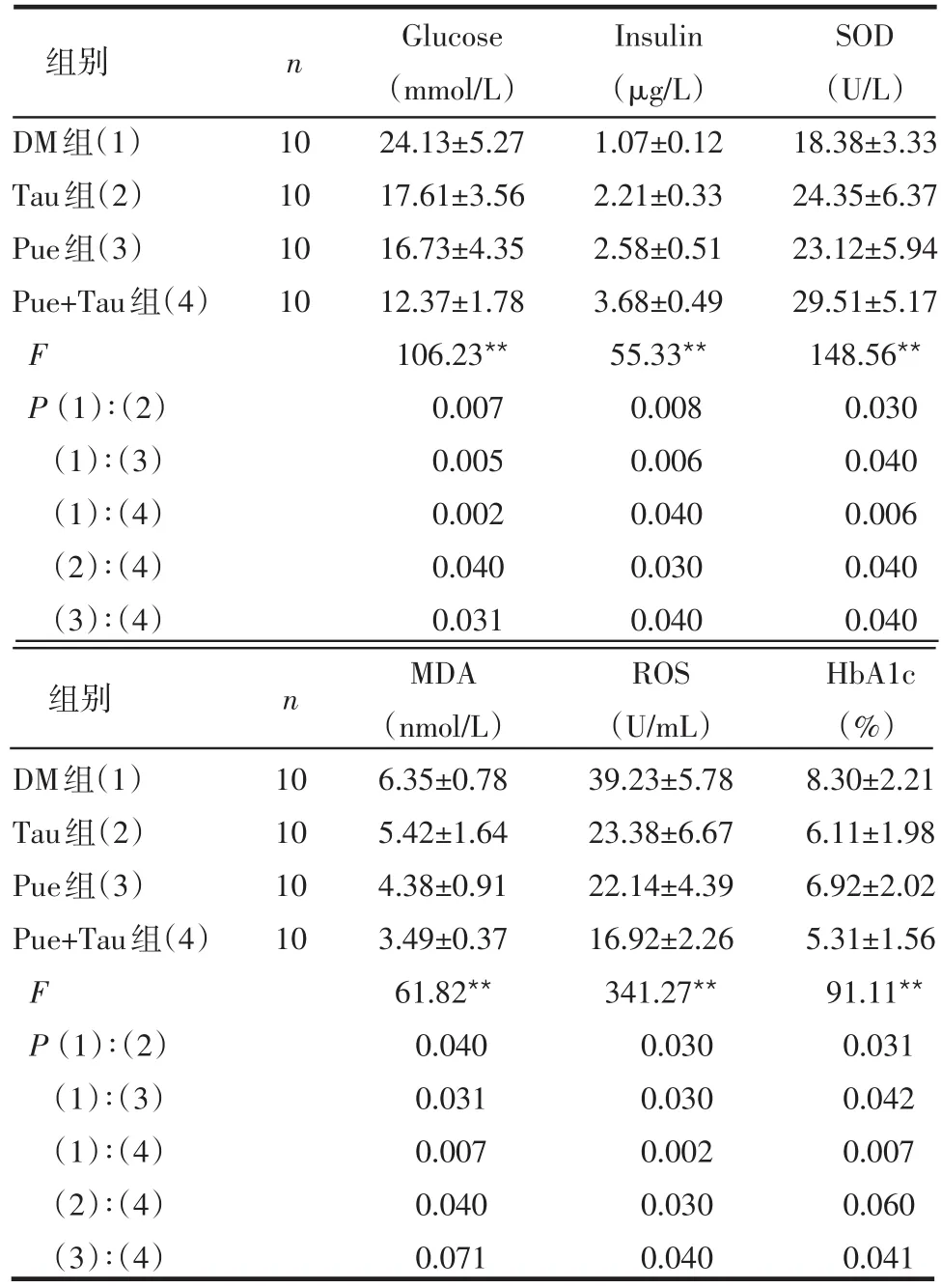
表1 各组血浆葡萄糖、胰岛素及SOD等指标比较±s)
*P<0.05,**P<0.01;表2同
DM组(1)Tau组(2)Pue组(3)Pue+Tau组(4)F P(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(4)(3)∶(4)10 10 10 10 Glucose(mmol/L)24.13±5.27 17.61±3.56 16.73±4.35 12.37±1.78 106.23**0.007 0.005 0.002 0.040 0.031 Insulin(μg/L)1.07±0.12 2.21±0.33 2.58±0.51 3.68±0.49 55.33**0.008 0.006 0.040 0.030 0.040 SOD(U/L)18.38±3.33 24.35±6.37 23.12±5.94 29.51±5.17 148.56**0.030 0.040 0.006 0.040 0.040 MDA(nmol/L)6.35±0.78 5.42±1.64 4.38±0.91 3.49±0.37 61.82**0.040 0.031 0.007 0.040 0.071 ROS(U/mL)39.23±5.78 23.38±6.67 22.14±4.39 16.92±2.26 341.27**0.030 0.030 0.002 0.030 0.040 HbA1c(%)8.30±2.21 6.11±1.98 6.92±2.02 5.31±1.56 91.11**0.031 0.042 0.007 0.060 0.041 DM组(1)Tau组(2)Pue组(3)Pue+Tau组(4)F P(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(4)(3)∶(4)10 10 10 10组别 n组别 n
2.2 各组胰腺线粒体MDA、SOD和ROS水平的比较 Tau组、Pue组及Pue+Tau组大鼠胰腺线粒体MDA和ROS水平较DM组均有不同程度的降低,而SOD活性均有显著升高,其中Pue+Tau组这种变化更加明显,差异有统计学意义(P<0.05或P<0.01),见表2。
2.3 各组胰腺组织PDX-1免疫组织化学染色结果 PDX-1免疫组化阳性细胞主要位于胰腺的胰岛细胞内,外分泌腺细胞未见表达,DM组大鼠胰岛细胞中PDX-1表达水平较低,Tau和Pue组胰岛细胞PDX-1表达上调,Pue+Tau组PDX-1表达明显上调,见图1~4。
表2 各组动物胰腺组织线粒体MDA、SOD和ROS比较 ±s)
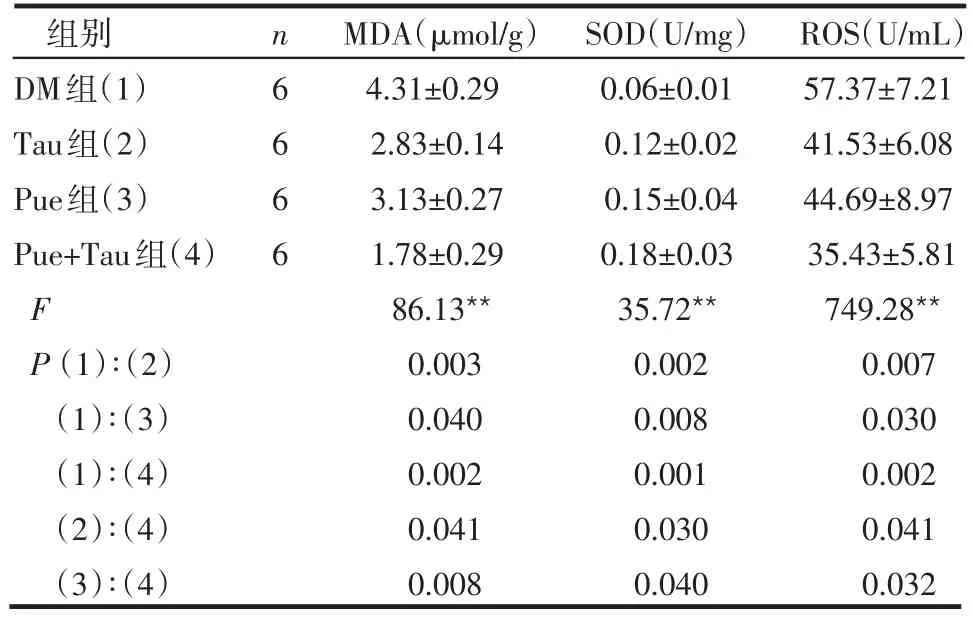
表2 各组动物胰腺组织线粒体MDA、SOD和ROS比较 ±s)
组别DM组(1)Tau组(2)Pue组(3)Pue+Tau组(4)F P(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(4)(3)∶(4)n6666 MDA(μmol/g)4.31±0.29 2.83±0.14 3.13±0.27 1.78±0.29 86.13**0.003 0.040 0.002 0.041 0.008 SOD(U/mg)0.06±0.01 0.12±0.02 0.15±0.04 0.18±0.03 35.72**0.002 0.008 0.001 0.030 0.040 ROS(U/mL)57.37±7.21 41.53±6.08 44.69±8.97 35.43±5.81 749.28**0.007 0.030 0.002 0.041 0.032

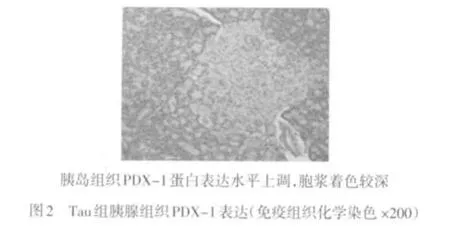
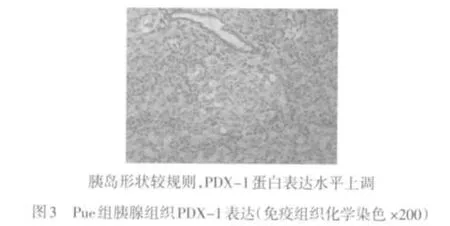

3 讨论
线粒体是细胞进行生物氧化和能量转换的主要场所,其不仅是ROS的主要来源,同时也是ROS损伤作用的主要靶点[5]。ROS可引起胰岛β细胞胰岛素启动因子PDX-1表达下调。研究表明,高血糖所致氧化应激会导致胰岛素启动子蛋白PDX-1的缺失,从而引起胰岛素基因表达下调,使胰岛素的分泌减少、β细胞功能衰退,进一步加重了糖脂代谢紊乱;而PDX-1主要在胰岛的β细胞中表达,其对胰腺的发育成熟及胰岛素基因转录水平的调控起重要作用[3]。
本研究显示,与DM组大鼠相比较,Pue+Tau组大鼠胰腺组织中ROS和脂质过氧化产物MDA水平明显降低,抗氧化酶SOD活性增强,同时观察到血浆胰岛素水平增加,而血糖和糖化血红蛋白水平降低,表明葛根素联合牛磺酸可通过增强糖尿病大鼠胰岛组织抗氧化酶的活性,加大对自由基的清除,减轻大量自由基对胰岛β细胞的过氧化损伤,保护了胰岛β细胞的功能。另外,糖尿病模型组大鼠胰腺PDX-1蛋白表达较弱,说明长期高血糖可以使PDX-1表达下降,并使其对于葡萄糖的反应性减弱,导致胰岛素的分泌减少。而葛根素联合牛磺酸干预可明显上调胰岛β细胞PDX-1蛋白的表达,从而促进胰岛素的分泌,保护胰岛细胞的功能。结合前面的实验结果,笔者认为葛根素联合牛磺酸可通过减轻2型糖尿病时的氧化应激反应上调PDX-1蛋白的表达,实现对糖尿病胰岛β细胞的保护作用。
[1]Kavaler S,Morinaga H,Jih A,et al.Pancreatic{beta}-cell failure in obese mice with human-like CMP-Neu5Ac hydroxylase deficiency[J].FASEB J,2011,25(6):1887-1893.
[2]Drews G,Krippeit-Drews P,Düfer M.Oxidative stress and be⁃ta-cell dysfunction[J].Pflugers Arch,2010,460(4):703-718.
[3]Robertson R,Zhou H,Zhang T,et al.Chronic oxidative stress as a mechanism for glucose toxicity of the beta cell in type 2 diabetes[J].Cell Biochem Biophys,2007,48(2-3):139-146.
[4]张艳敏,赵利军,孔小燕,等.牛磺酸联合葛根素对2型糖尿病大鼠血液流变学的影响[J].中国现代医学杂志,2010,20(14):2115-2117.
[5]Li N,Frigerio F,Maechler P.The sensitivity of pancreatic be⁃ta-cells to mitochondrial injuries triggered by lipotoxicity and oxi⁃dative stress[J].Biochem Soc Trans,2008,36(Pt 5):930-934.
