2型糖尿病合并非酒精性脂肪性肝病血浆chemerin与炎症指标的相关性
2011-07-16金二荣邸阜生洪燕青
金二荣 王 璐 张 洁 邸阜生 刘 聪 洪燕青
非酒精性脂肪性肝病(NAFLD)包括非酒精性单纯性脂肪肝(NAFL)以及由其演变的非酒精性脂肪性肝炎(NASH)和肝硬化,炎症在NAFLD的发生、发展过程中起重要作用。近来发现脂肪组织、肝脏分泌的脂肪因子chemerin可通过结合受体chemer⁃inR趋化巨噬细胞、淋巴细胞、自然杀伤细胞参与机体炎症反应,在NAFLD患者血浆chemerin水平明显增高[1]。本文就2型糖尿病(T2DM)伴NAFLD患者血浆chemerin水平变化以及chemerin与T2DM伴NAFLD炎症的关系进行探讨。
1 对象与方法
1.1 研究对象 选取2008年5月—2010年10月在天津市第三中心医院门诊新确诊或病史<5年而未使用任何降糖药物治疗的T2DM患者,其中合并NAFLD患者120例(A组),不合并NAFLD患者62例(B组),选取同期健康体检者60例(C组)。所有T2DM患者均排除糖尿病急慢性并发症、慢性肾功不全、冠心病、心律失常、肿瘤、妊娠及风湿免疫系统疾病,无饮酒史或饮酒折合乙醇量男性每周<140 g,女性每周<70 g,并排除病毒性肝炎、自身免疫性肝病、药物及毒物引起的肝病等。T2DM诊断采用1999年WHO诊断标准;NAFLD的诊断标准参照参考文献[2]。
1.2 研究方法
1.2.1 基本数据采集 测量各研究对象的身高、体质量,腰围、臀围,计算体质量指数(BMI)和腰臀比(WHR)。
1.2.2 标本采集 全部受试对象空腹8 h后取肘正中静脉血测空腹血糖(FBG)、餐后2 h血糖(2 hPG)、HbA1c(%)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、高敏C反应蛋白(hs-CRP)、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、chemerin。口服75 g无水葡萄糖行葡萄糖耐量试验(OGTT)及胰岛素、C肽释放试验测空腹胰岛素(FINS),计算稳态模型胰岛素抵抗指数(HOMA-IR)=FBG×FINS/22.5。
1.2.3 检测方法 内脏脂肪面积测量采用电阻抗法,血糖测定采用葡萄糖氧化酶法,血脂测定采用酶化学法,HbA1c测定采用高效液相层析法,血浆胰岛素测定采用放射免疫法,chemerin测定采用酶联免疫吸附法(试剂购自北京康肽生物科技有限公司),TNF-α、IL-6采用酶联免疫吸附法(试剂购自北京爱迪森生物科技有限公司),hs-CRP采用散射比浊法,B超检查用AKLOKA5000型B超检测仪。
1.3 统计学处理 数据采用SPSS 13.0软件统计处理,计量资料用±s表示,多组间比较采用方差分析及q检验,计数资料间比较采用χ2检验,指标间的关系判定采用Pearson相关分析和多元逐步回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 3组临床资料比较 除性别、年龄、身高外,体质量、BMI、腰围、WHR、TC、TG、LDL-C、FBG、2hPG、HbA1c、FINS、HOMA-IR、内脏脂肪面积在A、B组均显著高于C组,HDL-C显著低于C组(均P<0.01);A组与B组的体质量、BMI、腰围、WHR、TC、HDL-C、FBG、2 h PG、HbA1c、FINS、HOMA-IR差异无统计学意义(均P>0.05),TG、LDL-C、内脏脂肪面积差异有统计学意义(P<0.05或P<0.01),见表1。
2.2 3组间chemerin水平及炎性指标的比较 A组、B组的chemerin、hs-CRP、IL-6、TNF-α均高于C组(P<0.01),A组的chemerin、hs-CRP、IL-6、TNF-α均高于B组(P<0.05或P<0.01),见表2。
2.3 血浆chemerin与各变量间的相关性分析 T2DM合并NAFLD患者血浆chemerin水平与腰围、LDL-C、内脏脂肪面积、TNF-α、IL-6呈正相关(r分别为 0.193、0.185、0.822、0.687、0.731,P<0.05 或P<0.01),与臀围、WHR、身高、体质量、BMI、TC、TG、HDL-C、FBG、2 h PG、FINS、HOMA-IR、HbA1c、hs-CRP无相关性(r分别为 0.087、0.139、0.128、0.164、0.033、-0.061、-0.025、0.055、-0.132、-0.023、-0.076、-0.148、0.125、0.001,均P>0.05)。
表1 3组临床参数的比较 ±s)
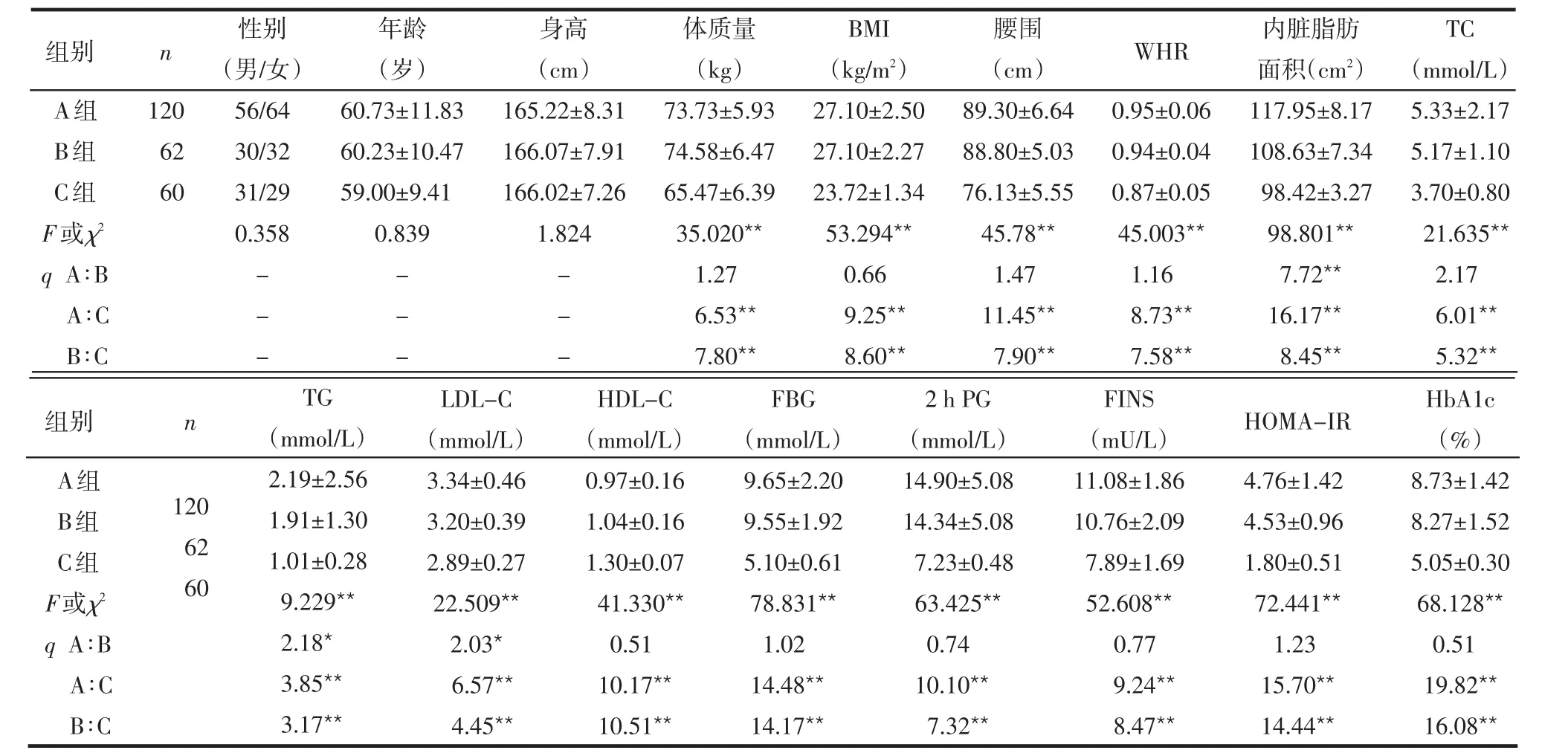
表1 3组临床参数的比较 ±s)
表中数据采用±s或例表示;*P<0.05,**P<0.01,表2同
组别 n WHR A组B组C组F或χ2 q A∶B A∶C B∶C 120 62 60性别(男/女)56/64 30/32 31/29 0.358---年龄(岁)60.73±11.83 60.23±10.47 59.00±9.41 0.839---身高(cm)165.22±8.31 166.07±7.91 166.02±7.26 1.824---体质量(kg)73.73±5.93 74.58±6.47 65.47±6.39 35.020**1.27 6.53**7.80**BMI(kg/m2)27.10±2.50 27.10±2.27 23.72±1.34 53.294**0.66 9.25**8.60**腰围(cm)89.30±6.64 88.80±5.03 76.13±5.55 45.78**1.47 11.45**7.90**0.95±0.06 0.94±0.04 0.87±0.05 45.003**1.16 8.73**7.58**内脏脂肪面积(cm2)117.95±8.17 108.63±7.34 98.42±3.27 98.801**7.72**16.17**8.45**TC(mmol/L)5.33±2.17 5.17±1.10 3.70±0.80 21.635**2.17 6.01**5.32**TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)FBG(mmol/L)2 h PG(mmol/L)FINS(mU/L)HbA1c(%)组别 n HOMA-IR A组B组C组F或χ2 q A∶B A∶C B∶C 120 62 60 2.19±2.56 1.91±1.30 1.01±0.28 9.229**2.18*3.85**3.17**3.34±0.46 3.20±0.39 2.89±0.27 22.509**2.03*6.57**4.45**0.97±0.16 1.04±0.16 1.30±0.07 41.330**0.51 10.17**10.51**9.65±2.20 9.55±1.92 5.10±0.61 78.831**1.02 14.48**14.17**14.90±5.08 14.34±5.08 7.23±0.48 63.425**0.74 10.10**7.32**11.08±1.86 10.76±2.09 7.89±1.69 52.608**0.77 9.24**8.47**4.76±1.42 4.53±0.96 1.80±0.51 72.441**1.23 15.70**14.44**8.73±1.42 8.27±1.52 5.05±0.30 68.128**0.51 19.82**16.08**

表2 3组chemerin及炎症指标的比较
2.4 多元逐步回归分析 以T2DM合并NAFLD患者血浆chemerin水平为因变量,以BMI、腰围、臀围、WHR、内脏脂肪面积、TC、TG、LDL-C、HDL-C、FBG、2 h PG、FINS、HOMR-IR、HbA1c、TNF-α、hs-CRP、IL-6为自变量进行多元逐步回归分析,结果表明内脏脂肪面积、TNF-α、IL-6进入分析模型,=-209.184+1.629X1+0.313X2+0.425X3(:chemer⁃in;X1:内脏脂肪面积;X2:TNF-α;X3:IL-6),所得模型决定系数(R2)=0.764(F=129.302,P<0.01)。
3 讨论
NAFLD是一种多病因引起的肝细胞内脂质蓄积过多的临床病理综合征。本研究发现A组、B组患者 TC、TG、LDL-C、FBG、2 h PG、HbA1c、FINS、HOMA-IR、内脏脂肪面积高于正常对照组,HDL-C低于正常对照组,表明T2DM、NAFLD患者存在有糖脂代谢紊乱。研究发现NAFLD与糖尿病、肥胖等代谢综合征密切相关,存在脂肪组织和肝脏的天然免疫功能紊乱,肥胖和肝脂肪变性时,脂肪组织、肝脏可分泌TNF-α、hs-CRP、IL-6多种炎性细胞因子,在NAFLD的形成和发展中发挥重要作用[3]。本研究亦显示A组、B组患者血浆IL-6、TNF-α、hs-CRP高于正常对照组,与以上所述一致,表明炎症在糖尿病、脂肪肝的发生、发展中起重要作用。
Kukla等[1]研究发现NAFLD血浆chemerin水平明显较正常人高。本研究得出相似的结果:T2DM合并NAFLD血浆chemerin水平高于正常对照组和单纯T2DM患者,同时T2DM合并NAFLD患者血浆IL-6、TNF-α、hs-CRP高于单纯 T2DM 患者,而chemerin又是机体炎症反应标志物[3]。提示chemer⁃in可能通过炎症机制参与T2DM合并NAFLD的发生、发展。国外研究发现肥胖患者血浆chemerin水平与炎症指标TNF-α、IL-6、hs-CRP呈正相关[3]。本研究显示T2DM合并NAFLD血浆chemerin水平与TNF-α、IL-6、腰围、内脏脂肪呈正相关,腰围、内脏脂肪面积是肥胖的临床指标,表明chemerin还与肥胖尤其是中心性肥胖的发生相关。Chemerin可促进脂肪细胞的分化,参与成熟脂肪细胞的脂肪分解,chemerin与LDL-C相关,提示chemerin还参与NAFLD的脂代谢。但本研究chemerin与hs-CRP、臀围、WHR、身高、体质量、BMI、TC、TG、HDL-C、FBG、2hPG、FINS、HOMA-IR 、HbA1c无相关性。
本研究表明TNF-α、IL-6是血浆chemerin的影响因素,TNF-α、IL-6可导致糖尿病患者胰岛素抵抗,增加糖尿病患者脂肪肝的发生率。由此推论T2DM患者炎症、胰岛素抵抗与NAFLD的发生、发展密切相关,而chemerin在这个环节起到重要作用。内脏脂肪面积也是影响血浆chemerin的危险因素,这可能与chemerin主要由内脏脂肪组织产生有关。
Chemerin的表达受炎性因子的调节。Parlee等[4]研究发现TNF-α可增强chemerin前体在脂肪细胞中的合成和分泌。国内研究发现高脂饮食诱导的非酒精性脂肪肝C57BL/6小鼠模型与对照组相比,肝脏chemerin的mRNA表达下调,但是肝脏中chemer⁃in R的mRNA表达却上调[5]。肝脏chemerin的mRNA表达下调是由炎症使脂肪变的肝细胞氧化应激、脂质过氧化不断加重,肝细胞的功能和完整性遭破坏所致;而chemerin R mRNA表达上调可能与TNF-α促进单核细胞chemerinR表达有关[5]。
[1]Kukla M,Zwirska-Korczala K,Hartleb M,et al.Serum Chemerin and vaspin in non-alcoholic fatty liver disease[J].Scand J Gastroen⁃terol,2010,45(2):235-242.
[2]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[3]Lehrke M,Becker A,Greif M,et al.Chemerin is associated with markers of inflammation and components of the metabolic syndrome but does not predict coronary atherosclerosis[J].Eur J Endo crinol,2009,161(2):339-344.
[4]Parlee SD,Ernst MC,Muruganandan S,et al.Serum chemerin levels vary with time of day and are modified by obesity and tumor necro⁃sis factor-{alpha}[J].Endocrinology,2010,151(6):2590-2602.
[5]张强,朱榕峰,刘爽,等.高脂诱导非酒精性脂肪性肝病小鼠肝脏Chemerin及其受体的表达[J].新乡医学院学报,2009,26(3):224-228.
