基于生长时间光谱法的大肠菌群单管定量检测技术研究
2011-07-12蔡尽忠庄峙厦赵丽汤新华鄢庆枇
蔡尽忠,庄峙厦,2,赵丽,汤新华,鄢庆枇
(1.厦门华厦职业学院食品药品安全检测实验室,福建厦门 361024)
(2.厦门大学化工学院,福建厦门 361005)
(3.厦门斯坦道生物公司,福建厦门 361006)
(4.集美大学水产学院,福建厦门 361021)
大肠菌群(Coliforms)分布较广,在温血动物粪便和自然界中广泛存在,故与大肠埃氏菌(Escherichia coli)一起被国际公认为检测医药、食品及各种水质在流行病学上安全性的指示菌[1,2]。大肠菌群传统检测方法耗时长、灵敏度低、特异性差,不能适应快速检测的需要。因此建立以特定底物为基础的新检测技术越来越受到重视[3]。目前以特定底物为基础的新检测技术仍然是基于MPN的方法而建立的[4,5],虽然检测时间优于传统的多管发酵法,但仍需18-24h甚至更长时间才能判定结果,而且操作繁琐。本文以ONPG为底物,研究初始接菌浓度与达到特定吸光度所需时间的关系。因分光光度计测得的吸光度值在0.2~0.8范围较为准确,为了达到快速检测的目的,故选择吸光度值下限0.2为特定的吸光度值。力求在更短时间内检测出大肠菌群并通过达到0.2吸光度所需时间来确定大肠菌群浓度。
1 材料与方法
1.1 试验菌株
大肠菌群混合菌株HX16.3分离于生活污水并鉴定(包括大肠埃希杆菌属、肠杆菌属、枸橼酸菌属、克雷伯菌属)。
1.2 试剂及培养基
ONPG购买自美国Sigma公司
ONPG培养基:胰蛋白胨10g,ONPG 500mg,硫酸锌0.5mg,硫酸镁0.1g,氯化钙100mg,磷酸二氢钾0.9g,磷酸氢二钾7.6g,氯化钠10g,蒸馏水定容至1000mL,pH7.2。
营养琼脂培养基和乳糖发酵培养基:按《微生物学实验》[6]配制。
1.3 仪器设备
生化培养箱(PHX-280)
大肠菌群快速检测仪(STD-CF)
1.4 菌悬液制备
将大肠菌群混合菌株HX16.3接种于营养琼脂斜面上培养18h后,用0.9%生理盐水洗脱制成菌悬液,然后调整到适当浓度待用。
1.5 ONPG酶解产物最佳检测波长的确定
将接种大肠菌群HX16.3并培养10h的ONPG培养液,大肠菌群HX16.3菌悬液,未接种大肠菌群的ONPG培养液进行全波长(200~800nm)扫描。
1.6 大肠菌群初始接种浓度与达到0.2吸光度所需时间的关系
将不同稀释度10-3,10-4,10-5,10-6,10-7大肠菌群混合菌株HX16.3接种1mL至装有10mLONPG培养基的瓶子中,并放到大肠菌群快速检测仪,将吸收波长设定于410nm,每10秒测定一次吸光度值,于37℃培养17小时。同时10-5,10-6,10-7稀释度的菌液用平板计数法[6]确定菌浓度。
1.7 单管定量法与多管发酵法的相对标准偏差
将1ml大肠菌群悬液接种到至装有10mLONPG培养基的瓶子中,分别接种8管,并放到大肠菌群快速检测仪,将吸收波长设定于410nm,每10秒测定一次吸光度值,于37℃培养17小时。然后根据1.6得到的初始接种浓度与达到0.2吸光度所需时间的关系求出菌浓度,计算单管定量法的相对标准偏差,并与多管发酵法测定结果的相对标准偏差进行比较。
2 结果与分析
2.1 ONPG酶解产物最佳检测波长的分析
对影响ONPG酶解产物最佳检测波长的各因素进行全波长扫描,结果如图2-1所示。接种大肠菌群HX16.3并培养10h的ONPG培养液有两个相对最大吸收波长,即309和410nm,大肠菌群HX16.3菌悬液有两个相对最大吸收波长,即305和396nm,未接种大肠菌群的ONPG培养液两个相对最大吸收波长,即307和330nm。为使底物和菌体的吸光度对结果的影响最小, 故ONPG酶解产物最佳检测波长确定为410nm。

2.2 大肠菌群初始接种浓度与达到0.2吸光度所需时间的关系
平板计数法得出10-6稀释度的菌浓为197cfu/mL,10-7稀释度的菌浓为20cfu/mL。各稀释度菌液生长时间光谱图如图2-2所示。各稀释度菌液初始接种浓度常用对数值与达到0.2吸光度所需时间的关系如图2-3所示。结果表明当初始菌浓度范围在101.3~105.3cfu/mL时,初始菌浓度常用对数值与达到0.2吸光度所需时间具有良好的线性关系,计算公式为y = -0.0138x + 8.759。
2.3 单管定量法与多管发酵法的相对标准偏差
生长时间光谱法测定8个平行样的谱图如图2-4所示,相对标准偏差为11.5%,多管发酵法相对标准偏差为53.3%。由此可见基于生长时间光谱法的单管定量检测的相对标准偏差远远低于多管发酵法。
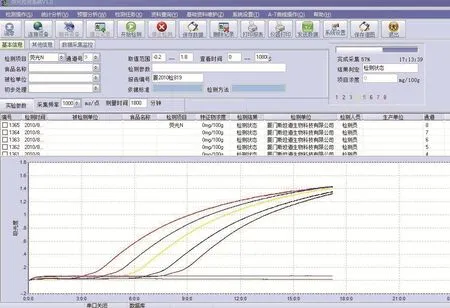
图2-2 各稀释度菌液生长时间光谱图
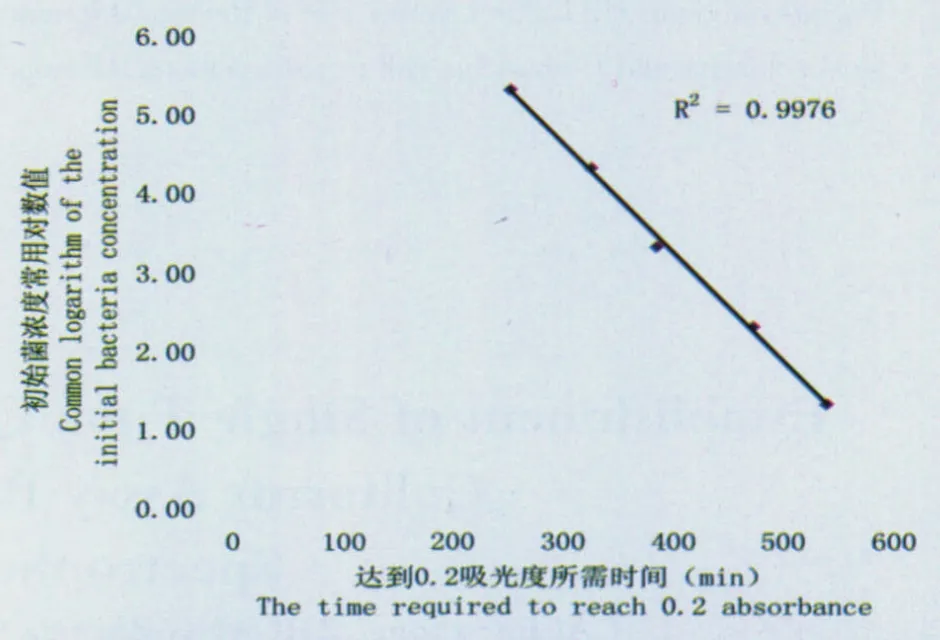
图2-3 初始菌浓度常用对数值与达到0.2吸光度所需时间的关系

图2-48个平行样生长时间光谱图
3 讨论
国内外有关样品中大肠菌群浓度的测定,不管是多管发酵法还是酶底物法主要是通过MPN来确定,虽然优于传统的多管发酵法,但仍需要培养18-24h甚至更长时间才能判定结果,不能满足快速检测的需要。
本文以ONPG为底物,研究大肠菌群混合菌株HX16.3初始接种量与达到0.2吸光度所需时间的关系,拟合的线性关系的菌浓度范围为101.3~105.3cfu/mL,发现它们存在良好的线性关系(R2=0.9976),反应所需的时间短,当初始菌浓为101.3cfu/mL时反应时间仅需9h,且其标准偏差低于多管发酵法,可以作为大肠菌群快速检测的方法,具有良好的应用前景。
[1]Dogan-Halkman HB,Cakir I,Keven F,et al.Relationship among fecal coliforms and Escherichia coli in various foods[J].European Food Research and Techmology,2003,216:331-334.
[2]O’Toole D K,Chiang M M P.The use of MUG supplement to detect Escherichia coli by the Multiple Tube Method in marine waters of Hong Kong[J].Marine Pollution Bulletin,1999,38(10):921-924.
[3]Noble R T,Leecastet M K,McGee C D,et al.Comparison of bacterial indicator analysis methods in stormwater-affected coastal waters[J].Water Reseach,2004,38(5):1183-1188.
[4]孙宗科,吴榕,丁培,等.水中大肠菌群快速检测方法-酶底物法与多管发酵法的比较[J].卫生研究,2006,35(4):497-498.
[5]赵春霞,张哲海,厉以强,等.酶底物法与多管发酵法和纸片法监测环境水样大肠菌群的比较[J].环境监测管理与技术,2009,21(2):63-64.
[6]沈萍,范秀容,李广武.微生物学实验(第三版)[M].北京:高等教育出版社,1999.
